அயனிச் சமநிலை | வேதியியல் - அமிலங்கள் மற்றும் காரங்கள் | 12th Chemistry : UNIT 8 : Ionic Equilibrium
12 ஆம் வகுப்பு வேதியியல் : அத்தியாயம் 8 : அயனிச் சமநிலை
அமிலங்கள் மற்றும் காரங்கள்
அமிலங்கள் மற்றும் காரங்கள்
'அமிலம்' எனும் சொல்லானது 'acidus' எனும் புளிப்பு எனப் பொருள்படும் கிரேக்க மொழிச் சொல்லிலிருந்து வருவிக்கப்பட்டது. இதன் பொருள் "புளிப்புச் சுவை" என்பதாகும். அமிலங்கள் புளிப்புச் சுவையுடையவை, நீல நிற லிட்மஸ் தாளை சிவப்பாக மாற்றக்கூடியவை. மேலும், ஜிங்க் போன்ற உலோகங்களுடன் வினைப்பட்டு ஹைட்ரஜன் வாயுவை வெளியேற்றக்கூடியவை. இதேபோல காரங்கள் கசப்பு சுவையுடையவை மேலும், இவை சிவப்பு நிற லிட்மஸ் தாளை நீல நிறமாக மாற்றக்கூடியவை என்பதை நாம் முந்தைய வகுப்புகளில் கற்றறிந்துள்ளோம்.
அமிலங்கள் மற்றும் காரங்களின் பண்புகளை விளக்குவதற்கு இந்த பழமையான கொள்கைகள் போதுமானவைகளாக இல்லை. எனவே, அறிவியலாளர்கள் அமில-காரங்களின் பண்புகளை அடிப்படையாகக் கொண்டு புதிய கொள்கைகளை உருவாக்கினர்.
அமிலங்கள் மற்றும் காரங்களின் பண்புகளை விளக்குவதற்காக அரீனியஸ், ப்ரான்ஸ்டட் மற்றும் லௌரி மற்றும் லூயி ஆகிய அறிவியலாளர்களால் உருவாக்கப்பட்ட கொள்கைகளை நாம் கற்போம்.
அரீனியஸ் கொள்கை
அமிலங்கள் மற்றும் காரங்கள் பற்றிய பழமையான கொள்கைகளில் ஒன்று ஸ்வீடன் நாட்டு வேதியியலாளர் ஸ்வாண்டே அரீன்யஸ் என்பவரால் முன்மொழியப்பட்டது. அவரின் கூற்றுப்படி, அமிலம் என்பது, நீர்க்கரைசலில் பிரிகையடைந்து ஹைட்ரஜன் அயனிகளை தரவல்ல ஒரு சேர்மமாகும். எடுத்துக்காட்டாக, HCl, H2SO போன்றவை அமிலங்களாகும். நீர்க்கரைசலில் அவற்றின் பிரிகையாதல் பின்வருமாறு குறிப்பிடப்படுகிறது.
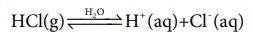
நீர்க்கரைசலிலுள்ள H+ அயனியானது அதிகளவில் நீரேற்றமடைந்து காணப்படுகிறது, பொதுவாக H3O+ என குறிப்பிடப்படுகின்றன. [H(H2O)]+ என்பது புரோட்டானின் மிக எளிய நீரேறிய அமைப்பாகும். இதை குறிப்பிட H+ மற்றும் H3O+ ஆகிய இரண்டையும் பயன்படுத்துவோம்.
இதேபோல, காரம் என்பது, நீர்க்கரைசலில் பிரிகையடைந்து ஹைட்ராக்ஸில் அயனிகளை தரவல்ல ஒரு சேர்மமாகும் எடுத்துக்காட்டாக, NaOH, Ca(OH)2 போன்ற சேர்மங்கள் காரங்களாகும்.
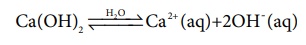
அரீனியஸ் கொள்கையின் வரம்புகள்
i. அசிட்டோன், டெட்ராஹைட்ரோஃப்யுரான் போன்ற கரிம கரைப்பான்களில் அமில மற்றும் காரங்களின் பண்பினை அரீனியஸ் கொள்கை விளக்கவில்லை
ii. ஹைட்ராக்ஸில் தொகுதியை கொண்டிராத அம்மோனியா (NH3) போன்ற சேர்மங்களின் காரத்தன்மையினை இக்கொள்கை விளக்கவில்லை.
தன்மதிப்பீடு - 1
அரீனியஸ் கொள்கையை பயன்படுத்தி பின்வருவனவற்றை அமிலம் (அல்லது) காரம் என வகைப்படுத்துக.
i)HNO3 ii) Ba(OH)2 iii) H3PO4 iv) CH3COOH
விடை :
அமிலம் : (i) HNO3 iii) H3PO3 iv) CH3COOH
காரம் : ii) Ba (OH)2
லௌரி - ப்ரான்ஸ்டட் கொள்கை (புரோட்டான் கொள்கை)
1923 ஆம் ஆண்டு, லௌரி மற்றும் ப்ரான்ஸ்டட் ஆகியோர் அமிலங்கள் மற்றும் காரங்கள் பற்றிய மிகப் பொதுவான ஒரு கொள்கையை முன்மொழிந்தனர். அவர்களின் கொள்கைப்படி, அமிலம் என்பது மற்றொரு பொருளுக்கு ஒரு புரோட்டானை வழங்கக்கூடிய ஒரு பொருளாகும். காரம் என்பது மற்றொரு பொருளிலிருந்து ஒரு புரோட்டானை ஏற்கக்கூடிய ஒரு பொருளாகும். அதாவது, அமிலம் என்பது ஒரு புரோட்டான் வழங்கி, மற்றும் காரம் என்பது ஒரு புரோட்டான் ஏற்பி.
ஹைட்ரஜன் குளோரைடை நீரில் கரைக்கும்போது, அது, நீர் மூலக்கூறுக்கு ஒருபுரோட்டானை வழங்குகிறது. அதாவது, HC1 ஒரு அமிலமாகவும், H2O ஒரு காரமாகவும் நடந்துகொள்கின்றன. அமிலத்திலிருந்து காரத்திற்கு புரோட்டான் மாற்றப்படும் நிகழ்வை பின்வருமாறு குறிப்பிடலாம்.
HCl +H2O ↔ H3O+ + Cl-
அம்மோனியாவை நீரில் கரைக்கும்போது, அது நீரிலிருந்து ஒரு புரோட்டானை ஏற்றுக்கொள்கிறது. இந்த நேர்வில், அம்மோனியா (NH3) மூலக்கூறு ஒரு காரமாகவும், H2O மூலக்கூறு அமிலமாகவும் செயல்படுகின்றன. வினையானது பின்வருமாறு குறிப்பிடப்படுகிறது
H2O+NH3 ↔ NH4+ +OH-
இதன் மறுதலை வினையை பின்வரும் சமநிலையில் கருதுவோம்.
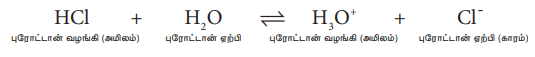
H3O+ ஆனது C1- க்கு ஒரு புரோட்டானை வழங்கி HCl ஐ உருவாக்குகிறது. அதாவது, விளைபொருட்களும் அமிலம் மற்றும் காரங்களாக செயல்படுகின்றன. பொதுவாக, லௌரி - ப்ரான்ஸ்டட் (அமிலம் - கார) வினையை பின்வருமாறு எழுதப்படுகிறது.
அமிலம்1 + காரம்2 ↔ அமிலம்2 + காரம்1
ஒரு புரோட்டானை வழங்கிய பிறகு எஞ்சியுள்ள பகுதி ஒரு காரமாகும் (காரம்) மேலும் இது ப்ரான்ஸ்டட் அமிலத்தின் (அமிலம்) இணைகாரம் என்றழைக்கப்படுகிறது. அதாவது ஒரு புரோட்டானால் மட்டும் வேறுபடும் வேதிக்கூறுகள் இணைஅமில-கார இரட்டைகள் என்றழைக்கப்படுகின்றன.
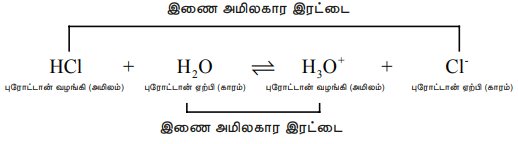
HCl மற்றும் Cl-, H2O மற்றும் H3O+ ஆகியன இரண்டும், வெவ்வேறு இணைஅமில - கார இரட்டைகளாகும். அதாவது, Cl- என்பது HCl அமிலத்தின் இணை காரம் (அல்லது) HCl என்பது Cl- அயனியின் இணை அமிலம் ஆகும். இதேபோல H3O+ என்பது H2O வின் இணை அமிலமாகும்.
லௌரி - ப்ரான்ஸ்டட் கொள்கையின் வரம்புகள்
1. BF3, AlCl3 போன்ற புரோட்டான்களை வழங்க இயலாத சேர்மங்களும் அமிலங்கள் போல செயல்படுவதை இக்கொள்கை விளக்கவில்லை.
தன்மதிப்பீடு - 2
பின்வருவனவற்றிற்கு, அவற்றின் நீர்க்கரைசலில் பிரிகையடைதலுக்கான சமன்படுத்தப்பட்ட சமன்பாட்டை எழுதுக. மேலும், இணைஅமில - கார இரட்டைகளை கண்டறிக.
i) NH4 + ii) H2SO4 iii) CH3 COOH.
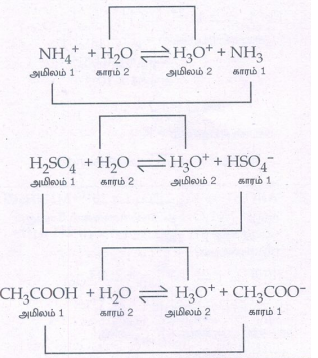
NH4+ + H2O ⇌ H3O+ + NH3
அமிலம் l காரம் 2 அமிலம் 2 காரம் 1
H2SO4 + H2O ⇌ H3O+ + HSO4-
அமிலம் l காரம் 2 அமிலம் 2 காரம் 1
CH3COOH + H2O ⇌ H3O+ + CH3COO-
அமிலம் l காரம் 2 அமிலம் 2 காரம் 1
லூயி கொள்கை
1923 ஆம் ஆண்டு , கில்பர்ட். N. லூயி என்பவர், அமில மற்றும் காரங்கள் பற்றிய மிகப் பொதுவான ஒரு கொள்கையை முன்மொழிந்தார். இவர் எலக்ட்ரான் இரட்டைகளை கருத்திற்கொண்டு ஒரு சேர்மத்தை அமிலம் அல்லது காரம் என வரையறுத்தார். இவரின் கருத்துப்படி, எலக்ட்ரான் இரட்டையை ஏற்றுக்கொள்ளும் சேர்மம் அமிலம் ஆகும். காரம் என்பது எலக்ட்ரான் இரட்டையை வழங்கும் சேர்மமாகும். இத்தகைய சேர்மங்களை நாம் லூயி அமிலங்கள் மற்றும் லூயி காரங்கள் என அழைக்கிறோம்.
லூயி அமிலம் என்பது ஒரு நேர்மின் அயனி (அல்லது) ஒரு எலக்ட்ரான் குறை மூலக்கூறு ஆகும். லூயி காரம் என்பது ஒரு எதிரயனி (அல்லது) குறைந்தபட்சம் ஒரு தனித்த இரட்டை எலக்ட்ரான்களை கொண்ட நடுநிலை மூலக்கூறு ஆகும்.
போரான் ட்ரைபுளூரைடு மற்றும் அம்மோனியா ஆகியவற்றிற்கிடையே நிகழும் வினையை கருதுவோம்.
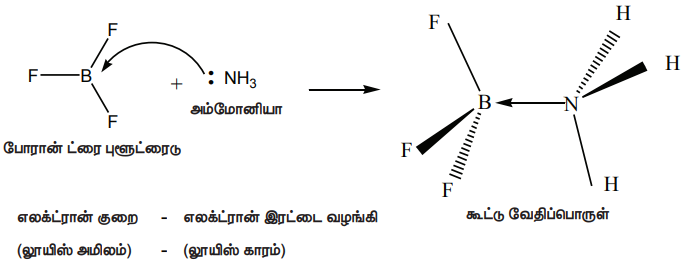
இங்கு, போரான் அணு ஒரு காலியான 2p ஆர்பிட்டாலைக் கொண்டுள்ளது. இது, அம்மோனியாவால் வழங்கப்படும் தனித்த எலக்ட்ரான் இரட்டையை ஏற்றுக்கொண்டு ஒரு புதிய ஈதல் சகப்பிணைப்பை உருவாக்குகிறது. அணைவுச் சேர்மங்களிலுள்ள ஈனிகள், லூயி காரங்களாகவும், ஈனிகளிடமிருந்து தனித்த எலக்ட்ரான் இரட்டைகளை ஏற்றுக்கொள்ளும் மைய உலோக அணு அல்லது அயனியானது லூயி அமிலமாகவும் செயல்படுகிறது என்பதை நாம் முன்னரே கற்றறிந்தோம்.
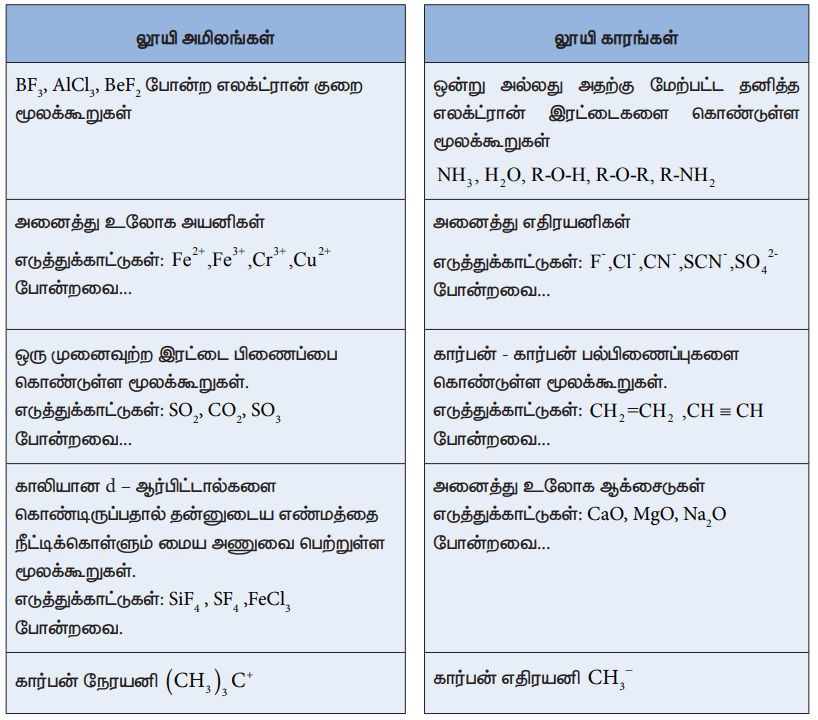
லூயி அமிலங்கள்
• BF3+ AlCl3+ BeF2 போன்ற எலக்ட்ரான் குறை மூலக்கூறுகள்
• அனைத்து உலோக அயனிகள்
எடுத்துக்காட்டுகள்: Fe2+, Fe3+, Cr'3+, Cu2+ போன்றவை...
• ஒரு முனைவுற்ற இரட்டை பிணைப்பை கொண்டுள்ள மூலக்கூறுகள். எடுத்துக்காட்டுகள்: SO2, CO2, SO3 போன்றவை...
• காலியான d - ஆர்பிட்டால்களை கொண்டிருப்பதால் தன்னுடைய எண்மத்தை நீட்டிக்கொள்ளும் மைய அணுவை பெற்றுள்ள மூலக்கூறுகள்.
எடுத்துக்காட்டுகள்: SiF4 , SF4 ,FeCl3 போன்றவை.
• கார்பன் நேரயனி (CH3)3 C+
லூயி காரங்கள்
• ஒன்று அல்லது அதற்கு மேற்பட்ட தனித்த எலக்ட்ரான் இரட்டைகளை கொண்டுள்ள மூலக்கூறுகள்
NH3, H2O, R-O-H , R-O-R, R-NH2
• அனைத்து எதிரயனிகள்
எடுத்துக்காட்டுகள்: F-,Cl-,CN- ,SCN- ,SO42- போன்றவை...
• கார்பன் - கார்பன் பல்பிணைப்புகளை கொண்டுள்ள மூலக்கூறுகள். எடுத்துக்காட்டுகள்: CH2 = CH2 , CH = CH போன்றவை...
• அனைத்து உலோக ஆக்சைடுகள் எடுத்துக்காட்டுகள்: CaO, MgO, Na2O போன்றவை...
• கார்பன் எதிரயனி CH3-
எடுத்துக்காட்டு
பின்வரும் வினையில் உள்ள லூயி அமிலம் மற்றும் லூயி காரங்களை கண்டறிக.
Cr3+ + 6 H2O → [Cr(H2O) 6] 3+
அயனியின் நீரேற்றத்தில், ஒவ்வொரு நீர் மூலக்கூறும் ஒரு எலக்ட்ரான் இரட்டையை Cr3+ அயனிக்கு வழங்குவதால் ஹெக்ஸாஅக்குவாகுரோமியம் (III) அயனி எனும் நீரேற்றம் பெற்ற அயனி உருவாகிறது. அதாவது, Cr3+ அயனி லூயி அமிலமாகவும் மற்றும் H2O மூலக்கூறு லூயி காரமாகவும் செயல்படுகின்றன.
தன்மதிப்பீடு - 3
பின்வரும் வினைகளில் லூயி அமிலம் மற்றும் லூயி காரங்களை கண்டறிக.
i. CaO + CO2 → CaCO3
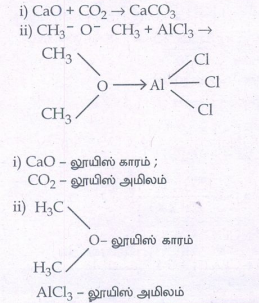
i) CaO - லூயிஸ் காரம் ;
CO2 - லூயிஸ் அமிலம்
AlCl3லூயிஸ் அமிலம்
தன்மதிப்பீடு - 4
கீழே குறிப்பிடப்பட்டுள்ளவாறு H3BO3 மூலக்கூறானது நீரிடமிருந்து ஹைட்ராக்சைடு அயனியை ஏற்றுக்கொள்கிறது
H3BO3 (aq) + H2O(1) ↔ B(OH)4 - + H+
லூயி கொள்கையை பயன்படுத்தி H3BO3 மூலக்கூறின் தன்மையை கண்டறிக.
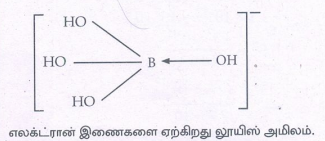
எலக்ட்ரான் இணைகளை ஏற்கிறது லூயிஸ் அமிலம்.