10வது அறிவியல் : அலகு 7 : அணுக்களும் மூலக்கூறுகளும்
அணு மற்றும் அணு நிறை
அணு மற்றும் அணு
நிறை
எந்த ஒரு பொருள் நிறை மற்றும்
பருமனைப் பெற்றுள்ளதோ, அப்பொருள் பருப்பொருள் எனப்படும். பருப்பொருள்களின் அடிப்படைத் துகள்கள்,
அணுக்கள் ஆகும். இந்த அணுக்களே பருப்பொருள்களின் நிறைக்குக் காரணம்.
நவீன அணுக்கொள்கையின் படி அணுவானது எலக்ட்ரான், புரோட்டான்,
நியூட்ரான் போன்ற உபதுகள்களைத் தன்னுள் கொண்டுள்ளது. இவற்றில் புரோட்டான்களும்
நியூட்ரான்களும் குறிப்பிட்டத்தக்கநிறையைப் பெற்றுள்ளன. இவற்றுடன் ஒப்பிடும்போது
எலக்ட்ரான்களின் நிறை மிகவும் குறைவு. எனவே ஒரு அணுவின் நிறைக்கு
புரோட்டான்களும் நியூட்ரான்களுமே காரணமாக உள்ளன. இதன்படி புரோட்டான்கள் மற்றும்
நியூட்ரான்களின் கூடுதலே அந்த அணுவின் “நிறை
எண்" எனப்படும்.
தனித்த அணுவானது மிகவும் சிறியது.
எனவே அதன் நிறையைக் கணக்கிடுவது மிகவும் சிரமமானது. நாம் பெரும் பொருள்களின்
நிறையைக் கிராம் மற்றும் கிலோகிராமில் கணக்கிடுவோம். அதுபோல அணுவின் நிறையானது "அணு
நிறை அலகினால்" (amu)
அளக்கப்படுகிறது.
கார்பன் ஐசோடோப்புகளில் 6 புரோட்டான்களையும் 6 நியூட்ரான்களையும் பெற்றுள்ள C – 12 அணுவின்
நிறையில் 12இல் ஒரு பகுதியே அணு நிறை அலகு ஆகும்.
(குறிப்பு: தற்காலத்தில் அணுநிறையைக் குறிப்பிட amu என்ற
குறியீட்டிற்கு பதில் ‘U' என்ற குறியீடு
பயன்படுத்தப்படுகிறது. ஏறத்தாழ ஒரு புரோட்டானின் நிறை அல்லது நியூட்ரானின்
நிறையானது 1 amu ஆகும்.)
1. ஒப்பு அணுநிறை (RAM)
அணு என்பது மிகச்சிறியதாக
இருப்பதால் அதனுடைய நிறையை நேரடியாகக் கணக்கிட முடியாது. எனவே முற்காலத்தில்
அணுநிறையைக் கணக்கிடுவதற்கு,
அதனோடு தொடர்புடைய மற்றொரு தனிமத்தின் நிறையோடு ஒப்பிட்டு
கணக்கிட்டார்கள். அவர்கள் ஒரே மாதிரியான நிறையைக் கொண்ட இரண்டு அல்லது அதற்கு
மேற்பட்ட அணுக்களை ஒரே
நேரத்தில் எடுத்துக் கொண்டு,
அவற்றில் ஒரு தனிமத்தின் அணுநிறைக்கு குறிப்பிட்ட மதிப்பை அளித்து
அதனை திட்ட அளவாகக் கொண்டு, அதனுடன் ஒப்பிட்டு மற்ற
தனிமங்களின் அணுநிறைகளைக் கணக்கிட்டனர். இவ்வாறு பெறப்பட்ட அணுநிறை ஒப்பு
அணுநிறை எனப்படும். முதலில் ஹைட்ரஜன் அணுவின் நிறையை திட்ட அளவாகக் கொண்டு
மற்ற அணுக்களின் நிறைகள் கணக்கிடப்பட்டன. ஹைட்ரஜனின் (1H1, 1H2, 1H3) ஐசோடோப் பண்புகளால்
பின்னர் ஹைட்ரஜன் அணுவிற்குப் பதில் ஆக்சிஜன் அணுவானது திட்ட அளவாக எடுத்துக்
கொள்ளப்பட்டது. தற்போது, அணுநிறை 12
கொண்ட கார்பனின் நிலைத்த ஐசோடோப்பான C - 12 ஐசோடோப்பானது
ஒப்பீட்டு அணு நிறையைக் கணக்கிட திட்ட அளவாக எடுத்துக் கொள்ளப்படுகிறது.
ஒரு தனிமத்தின்
ஒப்பு அணுநிறை என்பது அத்தனிமத்தின் ஐசோடோப்புகளின் சராசரி அணு நிறைக்கும் C - 12 அணுவின்
நிறையில் 1/12 பங்கின் நிறைக்கும் உள்ள விகிதமாகும். இது 'A,'
என்று குறிப்பிடப்படுகிறது. இதனை ‘திட்ட அணு
எடை’ எனவும் அழைக்கலாம்.
ஒப்பு அணுநிறை

அணு நிறையைக் கணக்கிடக்கூடிய நவீன
முறையான "நிறை நிறமாலைமானி" முறையில் (mass spectrometric method) C - 12 திட்ட
அளவாகப் பயன்படுத்தப்படுகிறது. பெரும்பாலான தனிமங்களில் ஒப்பு அணுநிறையானது முழு
எண்களை ஒட்டியே உள்ளதால் கணக்கீட்டிற்கு எளிதாக முழு எண்களாக மாற்றியே
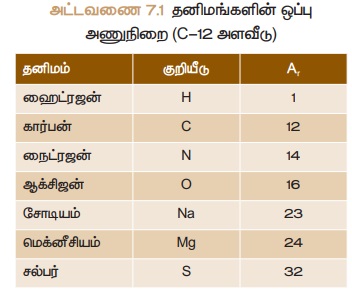
பயன்படுத்துகிறோம். அட்டவணை 7.1-இல் சில தனிமங்களின் ஒப்பு
அணு நிறைகள் பட்டியலிடப்பட்டுள்ளது.
உங்களுக்குத் தெரியுமா?
ஒப்பு அணுநிறை என்பது ஒரு விகிதம், எனவே அதற்கு அலகு
இல்லை. ஒரு தனிமத்தின் அணு நிறையை கிராமில் குறிப்பிடுவதாகக் கொண்டால் அதற்கு "கிராம்
அணுநிறை” என்று பெயர்.
ஹைட்ரஜனின் கிராம் அணு நிறை = 1 கி
கார்பனின் கிராம் அணுநிறை = 12 கி
நைட்ரஜனின் கிராம் அணுநிறை = 14 கி
ஆக்சிஜனின் கிராம் அணுநிறை - = 16 கி
2. சராசரி அணு நிறை (AAM)
ஒரு தனிமத்தின் அணு நிறையை எவ்வாறு
கணக்கிடுவாய்? இவற்றைக் கணக்கிடுவது என்பது மிகவும் சிரமம். ஏனெனில் தனிமங்கள்
இயற்கையில் பல ஐசோடோப்புகளின் கலவையாக உள்ளன. ஒவ்வொரு ஐசோடோப்பும் தனித்தனி
அணுநிறையைக் கொண்டுள்ளது. தனிமத்தின் அணு நிறையைக் கணக்கிடும்பொழுது இந்த
ஐசோடோப்புகளைக் கணக்கில் எடுத்துக்கொள்வது அவசியம்.
ஒரு தனிமத்தின்
சராசரி அணு நிறை என்பது இயற்கையில் கிடைக்கக்கூடிய கணக்கிடப்பட்ட ஐசோடோப்புகளின்
சராசரி நிறையைக் குறிப்பதாகும்.
ஆனால் இயற்கையில் அனைத்து
ஐசோடோப்புக்களும் ஒரே அளவில் கிடைப்பதில்லை. அணு நிறையைக் கணக்கிடும் போது அனைத்து
ஐசோடோப்புகளின் நிறைகள் மற்றும் சதவீத அளவுகள் போன்றவை கணக்கில் எடுத்துக்
கொள்ளப்படுகிறது. எனில், சராசரி அணு நிறை என்றால் என்ன? உதாரணமாக 9amu
அணுநிறை உள்ள ஐசோடோப்பு 50 விழுக்காடும் 10
amu அணுநிறை உள்ள ஐசோடோப்பு 50 விழுக்காடும்
எடுத்துக் கொள்ளப்பட்டால் அதனுடைய சராசரி அணுநிறை கீழ்கண்டவாறு கணக்கிடப்படுகிறது.
சராசரி அணுநிறை = (1வது ஐசோடோப்பின்
நிறை × 1 வது ஐசோடோப்பின் சதவீத அளவு) + (2வது ஐசோடோப்பின் நிறை × 2 வது ஐசோடோப்பின் சதவீத
அளவு)
எனவே கொடுக்கப்பட்ட தனிமத்தின் சராசரி
= 4.5 + 5 = 9.5 amu
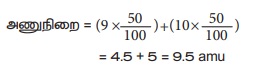
(குறிப்பு: கணக்கிடும் போது விழுக்காட்டினை, தசமமாக மாற்றி
கணக்கிட வேண்டும். உதாரணமாக 50 விழுக்காடு என்பதை 50/100
(அ) 0.50 என்றவாறு கணக்கில் எடுத்துக் கொள்ள
வேண்டும்.)
தனிம வரிசை அட்டவணையில்
குறிப்பிடப்பட்டுள்ள தனிமங்களின் அணுநிறை என்பது சராசரி அணுநிறையாகும். சில
நேரங்களில் அணு எடை என்பது சராசரி அணுநிறையைக் குறிப்பதாகும். தனிம வரிசை
அட்டவணையின்படி பெரும்பாலான தனிமங்களின் அணு நிறை என்பது முழு எண்களாக இருப்பதில்லை
என அறியப்படுகிறது. உதாரணமாக தனிம வரிசை அட்டவணையில் கார்பனின் அணு நிறை 12.00 amu என்பதற்கு
பதிலாக 12.01 amu என்று கொடுக்கப்பட்டுள்ளது. இதற்கு காரணம்
கார்பனின் அணுநிறையைக் கணக்கிடும் போது C - 12 மற்றும் C
- 13 ன் ஐசோடோப்புகள் கணக்கில் எடுத்துக் கொள்ளப்படுகின்றன. கார்பன்
- 12 மற்றும் கார்பன் - 13 ஆகியவற்றின்
இயற்கை பரவல்கள் முறையே 98.90% மற்றும் 1.10% ஆகும். கார்பனின் சராசரி அணுநிறை கீழ்க்கண்டவாறு கணக்கிடப்படுகிறது.
கார்பனின் சராசரி அணுநிறை
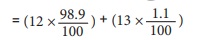
= (12 × 98.9/100 ) + (13 × 1.1/100)
= (12 × 0.989) + (13 × 0.011)
= 11.868 + 0.143 = 12.011 amu
இதிலிருந்து கார்பனின் அணுநிறை 12 amu என்பது
கார்பன் ஐசோடோப்புகளின் சராசரி அணுநிறையே தவிர, தனித்த
கார்பனின் அணுநிறை அல்ல.
சராசரி
அணுநிறையைக் கணக்கிடுதல்
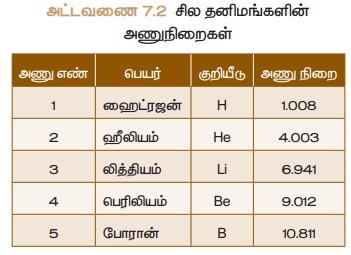
எ.கா.கணக்கு 1: பூமியின் மேற்பரப்பு
மற்றும் மனித உடலில் அதிகமாகக் காணப்படக்கூடிய தனிமம் ஆக்சிஜன். அது அட்டவணை 73 இல் கொடுக்கப்பட்டுள்ளவாறு மூன்று வகையான நிலைத்த ஐசோடோப்புகளின் கலவையாக
உள்ளது.
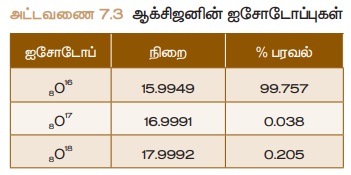
ஆக்சிஜனின் அணு நிறை = (15.9949 × 0.99757) + (16.9991 × 0.00038) + (17.9992 ×
0.00205)
= 15.999 amu.
எ.கா.கணக்கு 2: இயற்கையில் தனிமம் போரான் என்பது போரான் - 10 (5 புரோட்டான்கள் + 5 நியூட்ரான்கள்) மற்றும் போரான்-11 (5 புரோட்டான்கள் + 6 நியூட்ரான்கள்) ஆகியவற்றின் கலவையாக உள்ள து. B -10 ன் சதவீத பரவல் 20 ஆகவும் B - 11ன் சதவீத பரவல் 80 ஆகவும் உள்ளது. எனில் போரானின் சராசரி நிறை கீழ்கண்டவாறு கணக்கிடப்படுகிறது.
போரானின் அணு நிறை = (10 × 20/100) + (11 × 80/100)
= (10 × 0.20) + (11 × 0.80)
= 2 + 8.8
= 10.8 amu