தாதுக்களின் தோற்றம், இயற்பியல் மற்றும் வேதியியல் பண்புகள், பயன்கள் - இரும்பின் உலோகவியல் | 10th Science : Chapter 8 : Periodic Classification of Elements
10வது அறிவியல் : அலகு 8 : தனிமங்களின் ஆவர்த்தன வகைப்பாடு
இரும்பின் உலோகவியல்
இரும்பின்
உலோகவியல்
கிடைக்கும்
பாங்கு :
அலுமினியத்திற்கு அடுத்து, மிக அதிகமாக காணப்படும் உலோகம் இரும்பு ஆகும். இயற்கையில், இது ஆக்சைடு, சல்பைடு மற்றும் கார்பனேட்டுகளாக
கிடைக்கின்றன. இரும்பின் தாதுக்களாவன:
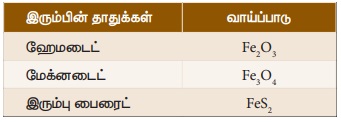
இரும்பின் முக்கிய தாது ஹேமடைட் (Fe2O3) ஆகும்
1. புவியீர்ப்பு முறையில் அடர்ப்பித்தல்: தூளாக்கப்பட்ட தாதுவை, சீராக ஓடும் நீரில்
கழுவும்போது லேசான மாசுக்கள் அகற்றப்பட்டு, கனமான தாதுக்கள்
கீழே படிகின்றன.
2. காற்றுள்ள மற்றும் காற்றில்லா சூழலில் வறுத்தல்: அடர்ப்பிக்கப்பட்ட தாதுவானது, அளவான காற்றில்
உலையில் சூடேற்றப்படும் போது, ஈரப்பதம் வெளியேறி சல்பர்,
ஆர்சனிக் மற்றும் பாஸ்பரஸ் மாசுக்கள் ஆக்ஸிஜனேற்றம் அடைகின்றன.
3. ஊது உலையில் உருக்கிப்பிரித்தல்: வறுக்கப்பட்ட தாது, கல்கரி, சுண்ணாம்புக்கல் இவற்றை 8:4:1 என்ற விகிதத்தில்
எடுத்துக் கொண்டு, உலையின் மேலுள்ள கிண்ணக்கூம்பு அமைப்பு
வழியாக, செலுத்தப்படுகிறது. உலையில் மூன்று முக்கிய பகுதிகள்
உள்ளன.
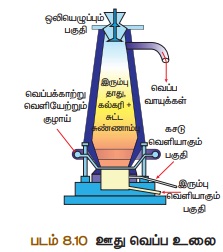
அ. கீழ்ப்பகுதி (எரிநிலை மண்டலம்)
இந்தப் பகுதியின் வெப்பநிலை 1500°C ஆகும்
வெப்பக்காற்றுடன் தாதுக்கலவை சேரும் போது, ஆக்ஸிஜனுடன்
எரிந்து CO2 வாக மாறுகிறது.
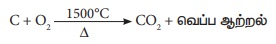
இவ்வினையிலிருந்து வெப்ப ஆற்றல்
வெளியாவதால் வெப்ப உமிழ்வினை எனப்படும்.
ஆ. நடுப்பகுதி
அல்லது உருக்கு மண்டலம்
இப்பகுதி 1000°C வெப்பநிலையில்
உள்ளது. இங்கு CO2 ஆனது CO ஆக
ஓடுக்கமடைகிறது.
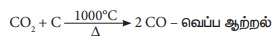
சுண்ணாம்புக்கல் சிதைந்து, கால்சியம்
ஆக்சைடையும், CO2 வையும் தரும்.
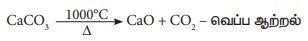
மேற்கண்ட இருவினைகளில், வெப்பம்
உட்கவரப்படுவதால் வெப்ப கொள்வினைகள் ஆகும். கால்சியம் ஆக்சைடு மணலுடன் சேர்ந்து
கால்சியம் சிலிகேட் எனும் கசடாகிறது.
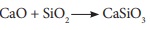
இ. மேற்பகுதி
(ஒடுக்கும் மண்டலம்)
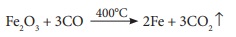
இப்பகுதியில் 400°C வெப்பநிலையில்
ஃபெரிக் ஆக்சைடு, கார்பன் மோனக்சைடு மூலம் இரும்பாக ஒடுக்கம்
அடைகிறது.
கசடை நீக்கிய பிறகு, உருகிய இரும்பானது,
உலையின் அடியில் சேகரிக்கப்படுகிறது. இவ்விரும்பு மீண்டும்
உருக்கப்பட்டு விதவித அச்சுக்களில் வார்க்கப்படுவதால், இது
வார்ப்பிரும்பு எனப்படும்.
இயற்பண்புகள்
· இது ஒரு பளபளப்பான உலோகம், சாம்பல் வெள்ளை
நிறமுடையது.
· இழுவிசை, தகடாக்கும் தன்மை
மற்றும் கம்பியாக்கும் தன்மையைப் பெற்றிருக்கும்.
· காந்தமாக மாற்ற இயலும்.
வேதிப்பண்புகள்
1. காற்றுடன் வினை: இரும்பு, காற்றுடன் சூடேற்றும் போது வினைபுரிந்து இரும்பு ஆக்சைடு உருவாகிறது.
3Fe + 2 O2 → Fe3O4 (கறுப்பு நிறம்)
2. ஈரக்காற்றுடன் வினை: இரும்பானது ஈரக்காற்றுடன் வினைபுரிந்து பழுப்பு நிற, நீரேறிய பெர்ரிக்
ஆக்சைடை உருவாக்குகின்றது. இச்சேர்மமே துரு எனப்படும். இந்நிகழ்ச்சி துருபிடித்தல்
எனப்படும்.
4 Fe+ 3 O2 + x H2O → 2
Fe2O3 . xH2O (துரு)
3. நீராவியுடன் வினை: செஞ்சூடெற்றிய இரும்பின் மீது, நீராவியை பாய்ச்சும் போது மேக்னட்டிக் ஆக்சைடு
உருவாகிறது.
3Fe + 4 H2O (நீராவி) → Fe3O4 + 4 H2 ↑
4. குளோரினுடன் வினை: இரும்பு குளோரினுடன் சேர்ந்து ஃபெரிக்குளோரைடு உருவாகிறது.
2Fe + 3Cl2 → 2FeCl3 (ஃபெரிக்குளோரைடு)
5. அமிலங்களுடன் வினை: நீர்த்த HCl மற்றும் H2SO4 அமிலங்களுடன்
இரும்பு வினைபுரிந்து, H2 வாயுவை
வெளியேற்றுகின்றது.
Fe + 2HCl → FeCl2 + H2 ↑
Fe + H2SO4 → FeSO4 +
H2 ↑
நீர்த்த நைட்ரிக் அமிலத்துடன், இரும்பு குளிர்ந்த
நிலையில் வினைபுரிந்து பெரஸ் நைட்ரேட் மற்றும் அம்மோனிம் நைட்ரேட்டை
உருவாக்குகின்றது.
4 Fe + 10 HNO3 → 4 Fe(NO3)2 +
NH4NO3 + 3 H2O
அடர்கந்தக அமிலத்துடன், இரும்பு
வினைபுரிந்து ஃபெரிக் சல்பேட்டை உருவாக்குகின்றது.
2 Fe + 6 H2SO4 → Fe2(SO4)3 +
3 SO2 + 6 H2O
அடர் நைட்ரிக் அமிலத்தில், இரும்பை
அமிழ்த்தும் போது இரும்பு ஆக்சைடு படலம் உருவாவதால், இரும்பு
தன் திறனை இழக்கின்றது.
இரும்பின்
வகைகள் மற்றும் பயன்கள்
வார்ப்பிரும்பு (2%
- 4.5% கார்பன் உடைய இரும்பு) ஸ்டவ்கள், கழிவு
நீர்க் குழாய்கள், ரேடியேட்டர்கள், கழிவு
நீர் சாக்கடை மூடிகள் இரும்பு வேலிகள் ஆகியவற்றை உருவாக்கப் பயன்படுகிறது.
எஃகு
( 0.25% - 2%கார்பன்
உடைய இரும்பு ) கட்டிடக் கட்டுமானங்கள், எந்திரங்கள்
மின்கடத்து கம்பிகள், TV கோபுரங்கள் மற்றும் உலோகக் கலவைகள்
ஆகியவற்றை உருவாக்கப் பயன்படுகிறது.
தேனிரும்பு
(< 0.25% கார்பன்
உடைய இரும்பு ) கம்பிச்சுருள், மின்காந்தங்கள் மற்றும்
நங்கூரம் இவற்றை செய்யப் பயன்படுகிறது.