மின்வேதிக் கலன் - கால்வானிக் மின்கலன் | 12th Chemistry : UNIT 9 : Electro Chemistry
12 ஆம் வகுப்பு வேதியியல் : அத்தியாயம் 9 : மின் வேதியியல்
கால்வானிக் மின்கலன்
கால்வானிக் மின்கலன்
ஜிங்க் உலோக பட்டையை, காப்பர் சல்பேட் கரைசலில் வைக்கும்போது, கரைசலின் நீல நிறம் வெளுத்து, ஜிங்க் பட்டை மீது சிவப்பு - பழுப்பு நிறத்தில் காப்பர் படிகிறது, என்பதை நாம், XI வகுப்பிலேயே கற்றறிந்தோம். இதற்கு காரணம் பின்வரும் தன்னிச்சை வினையாகும்.
Zn(s) + CuSO4(aq) → ZnSO4(aq) + Cu(s)
மேற்கண்ட வினையில் உருவாக்கப்படும் ஆற்றலானது, வெப்ப ஆற்றலாக சூழலுக்கு இழக்கப்படுகிறது.
மேற்காண் ஆக்ஸிஜனேற்ற ஒடுக்க வினையில், ஜிங்க் ஆக்ஸிஜனேற்றமடைந்து Zn2+ அயனிகளும், Cu2+ அயனிகள் ஒடுக்கமடைந்து உலோக காப்பரும் உருவாகின்றன. இந்த அரை வினைகள் கீழே குறிப்பிடப்பட்டுள்ளன.
Zn(s) → Zn2+(aq) +2e- (ஆக்ஸிஜனேற்றம்)
Cu2+(aq) + 2e– → Cu (s) (ஒடுக்கம்)
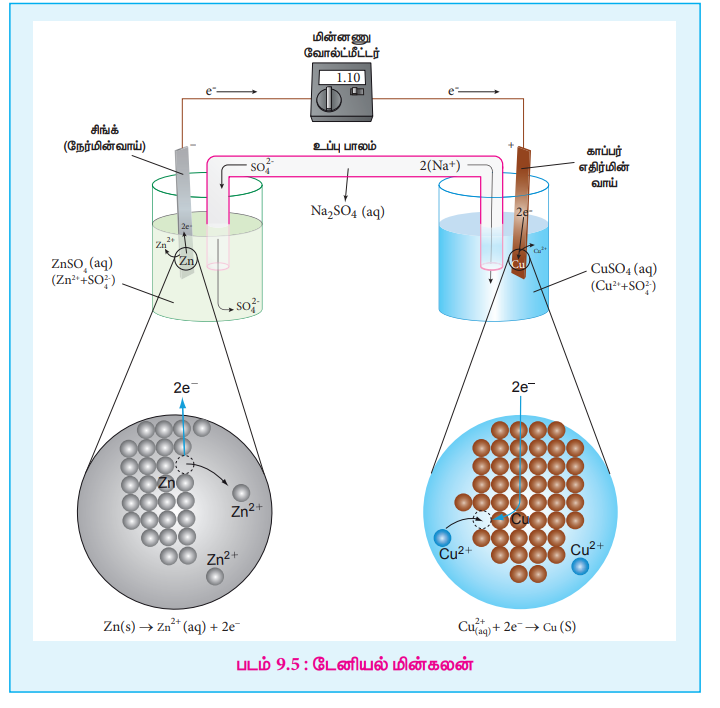
மேற்கூறிய இரண்டு அரை வினைகளை படம் 9.5 ல் காட்டியுள்ளவாறான அமைப்பில் தனித்தனியாக நிகழ்த்தும்போது, உருவாக்கப்படும் ஆற்றலின் ஒரு பகுதியானது மின்னாற்றலாக மாற்றப்படக் கூடும். டேனியல் மின்கலத்தை எடுத்துக்காட்டாக கொண்டு கால்வானிக் மின்கலத்தின் செயல்பாட்டை புரிந்து கொள்வோம். இந்த மின்கலமானது மேற்கூறிய வினையை பயன்படுத்தி மின்னாற்றலை உருவாக்குகிறது.
இந்த அரை வினைகளை தனித்தனியாக நடத்துதலே டேனியல் மின்கல கட்டமைப்பின் அடிப்படை ஆகும். இது இரண்டு அரை மின்கலங்களை கொண்டுள்ளது.
ஆக்ஸிஜனேற்ற அரை மின்கலன்
படம் 9.5 ல் காட்டியுள்ளவாறு முகவையிலுள்ள நீர்த்த ஜிங்க் சல்பேட் கரைசலில் ஜிங்க் உலோகப் பட்டை மூழ்க வைக்கப்பட்டுள்ளது.
ஒடுக்க அரை மின்கலன்
படம் 9.5ல் காட்டியுள்ளவாறு முகவையிலுள்ள நீர்த்த காப்பர் சல்பேட் கரைசலில் காப்பர் உலோகப் பட்டை மூழ்க வைக்கப்பட்டுள்ளது.
அரை மின்கலங்களை இணைத்தல்
ஜிங்க் மற்றும் காப்பர் பட்டைகள் வெளிப்புறமாக ஒரு கம்பி மூலம் இணைக்கப்படுகின்றன. இதனூடே ஒரு இணைப்பியும் (k) ஒரு மின்மூலமும் இணைக்கப்பட்டுள்ளன. (எடுத்துக்காட்டு: வோல்ட் மீட்டர்). எதிர்மின்முனைப் பகுதி மற்றும் நேர்மின்முனைப் பகுதிகளிலுள்ள மின்பகுளிக் கரைசல்கள், தலைகீழாக கவிழ்த்து வைக்கப்பட்டுள்ள U வடிவ குழாய் மூலம் இணைக்கப்பட்டுள்ளன. இந்த U வடிவ குழாயில், அகார்-அகார் ஜெல்லுடன் KCl, Na2SO4 போன்ற வினையுறா மின்பகுளிகள் கலந்த பசை வைக்கப்பட்டுள்ளது. இந்த வினையுறா மின்பகுளிகளின் அயனிகள் அரை மின்கலன்களிலுள்ள மற்ற அயனிகளுடன் வினைபுரிவதில்லை, மேலும் அவை மின்முனைகளில் ஆக்ஸிஜனேற்றமோ அல்லது ஒடுக்கமோ அடைவதில்லை. உப்புப்பாலத்தில் உள்ள கரைசல் வழிவதில்லை ஆனால், இந்த உப்புப்பாலத்தின் வழியே அயனிகள் அரை மின்கலத்திலிருந்து உள்ளேயோ அல்லது வெளியேயோ செல்ல முடியும்.
இணைப்பி (k) மூலம் மின்சுற்றை மூடும்போது, எலக்ட்ரான்கள் ஜிங்க் பட்டையிலிருந்து காப்பர் பட்டைக்கு பாய்கின்றன. இதற்கு காரணம் அந்தந்த மின்முனைகளில் நிகழும் ஆக்ஸிஜனேற்ற ஒடுக்க வினைகளே ஆகும். அவை கீழே கொடுக்கப்பட்டுள்ளன.
நேர்மின்வாய் ஆக்ஸிஜனேற்றம்
எந்தமின்முனையில் ஆக்ஸிஜனேற்றம் நிகழ்கிறதோ அது நேர்மின்முனை என்றழைக்கப்படுகிறது. டேனியல் மின்கலத்தின், ஜிங்க் மின்முனையில் ஆக்ஸிஜனேற்றம் நிகழ்கிறது. அதாவது, ஜிங்க் ஆனது Zn2+ அயனிகளாகவும், எலக்ட்ரான்களாகவும் ஆக்ஸிஜனேற்றமடைகின்றன. இந்த Zn2+ அயனிகள் கரைசலுக்குள் நுழைகின்றன. மேலும், எலக்ட்ரான்கள் கம்பியின் வழியே வெளிச்சுற்றிற்கு பாய்கின்றன, பின்னர் அவை காப்பர் பட்டைக்குள் நுழைகின்றன. ஜிங்க் மின்முனையில் எலக்ட்ரான்கள் விடுவிக்கப்படுவதால், எதிர்குறியை ( - ve) பெறுகிறது.
Zn(s) → Zn2+ (aq) + 2e- (எலக்ட்ரான் இழப்பு- ஆக்ஸிஜனேற்றம்)
எதிர்மின்வாய் ஒடுக்கம்
முன்னரே விவாதித்தபடி, எலக்ட்ரான்கள் மின்சுற்று வழியே ஜிங்க் பட்டையிலிருந்து காப்பர் பட்டைக்கு பாய்கின்றன. இங்கு கரைசலிலுள்ள Cu2+ அயனிகள் எலக்ட்ரான்களை ஏற்றுக்கொண்டு காப்பர் உலோகமாக ஒடுக்கமடைகின்றன, மேலும் இவை காப்பர்மின் முன்னையின் மீதே படிகின்றன. காப்பர் மின்முனை எலக்ட்ரான்களை உட்கொள்ளப்படுவதால் நேர்க்குறியை (+ve) பெறுகிறது.
Cu2+ (aq) 2e- → Cu (s) (எலக்ட்ரான் ஏற்பு- ஒடுக்கம்)
உப்புப் பாலம்
இரண்டு அரை மின்கலன்களிலுள்ள மின்பகுளிக் கரைசல்கள் உப்புப் பாலத்தை பயன்படுத்தி இணைக்கப்படுகின்றன. ஜிங்க் மின்முனையின் நேர்மின்முனை ஆக்ஸிஜனேற்றத்தால் கரைசலில் Zn2+ அயனிச் செறிவு அதிகரிக்கிறது என்பதை நாம் கற்றறிந்தோம். அதாவது, SO42- அயனிகளுடன் ஒப்பிடும்போது அதிகளவில் Zn2+ அயனிகளை கொண்டிருப்பதால் நேர்மின்முனைப்பகுதியானது அதிக நேர்மின்சுமையை பெறுகிறது. இதேபோல, எதிர்மின்முனைப் பகுதியில் Cu2+ அயனிகள் காப்பராக ஒடுக்கப்படுவதால், அதிக எதிர்மின்சுமையை பெறுகிறது. அதாவது Cu2+ அயனிகளுடன் ஒப்பிடும்போது SO42- அயனிகள் அதிகமாக உள்ளன.
இரண்டு பகுதிகளிலும் மின்நடுநிலைத்தன்மையை பராமரிக்கும் பொருட்டு, வினையுறா எதிரயனிகள் Cl- (உப்புப் பாலத்தில் வைக்கப்பட்டுள்ள KCl லிருந்து) உப்புப் பாலத்திலிருந்து நேர்மின்முனைப்பகுதிக்குள் நுழைகின்றன. அதே நேரத்தில் K+ அயனிகள் உப்புப்பாலத்திலிருந்து எதிர்மின்முனைப்பகுதிக்குள் நகருகின்றன.
மின்சுற்று முழுமையடைதல்
எதிர்மின்சுமை கொண்ட ஜிங்க் மின்முனையிலிருந்து , நேர்மின்சுமை கொண்ட காப்பர் மின்முனையை நோக்கி வெளிச்சுற்றின் வழியே எலக்ட்ரான்கள் பாய்கின்றன. அதே நேரத்தில், எதிரயனிகள் நேர்மின்முனைப் பகுதியை நோக்கியும், நேரயனிகள் எதிர்மின்முனைப் பகுதியை நோக்கியும் நகருகின்றன. இதனால் மின்சுற்று முழுமையடைகிறது.
மின்முனைகள் அழிதல்
டேனியல் மின்கலமானது செயல்பட, ஜிங்க் மின்முனையில் நிறை தொடர்ந்து குறைகிறது, ஆனால் காப்பர் மின்முனையின் நிறை தொடர்ந்து அதிகரிக்கிறது. எனவே ஜிங் மின்முனையானது முற்றிலுமாக Zn2+ அயனிகளாக மாறும் வரையிலோ அல்லது மொத்த Cu2+ அயனிகளும் உலோக காப்பராக மாறும் வரையிலோ மின்கலன் வேலை செய்யும்.
டேனியல் மின்கலம் போலல்லாமல், சில நேர்வுகளில், வினைபடுபொருட்கள் அல்லது வினைவிளை பொருட்கள் மின்முனைகளாக செயல்படுவதில்லை, அத்தகைய நேர்வுகளில் கிராஃபைட் அல்லது பிளாட்டினம் போன்ற வினையுறா மின்முனைகளை பயன்படுத்தப்படுகின்றன, இவை மின்னோட்டத்தை வெளிச்சுற்றுக்கு கடத்துகின்றன.