அயனிச் சமநிலை | வேதியியல் - நீரின் சுய அயனியாக்கம் | 12th Chemistry : UNIT 8 : Ionic Equilibrium
12 ஆம் வகுப்பு வேதியியல் : அத்தியாயம் 8 : அயனிச் சமநிலை
நீரின் சுய அயனியாக்கம்
நீரின் சுய அயனியாக்கம்
அமிலத்தன்மை அல்லது காரத்தன்மை கொண்ட சேர்மத்தை நீரில் கரைக்கும்போது அதன் தன்மையை பொருத்து ஒரு புரோட்டானை வழங்கவோ அல்லது ஏற்கவோ முடியும். கூடுதலாக, தூய நீரும் தானே சிறிதளவு பிரிகையடையும் திறனைக் கொண்டுள்ளது. அதாவது, ஒரு நீர் மூலக்கூறானது மற்றொரு நீர் மூலக்கூறுக்கு ஒரு புரோட்டானை வழங்குகிறது. இது நீரின் அயனியாக்கம் என அறியப்படுகிறது. இது கீழ்காணுமாறு குறிப்பிடப்படுகிறது.
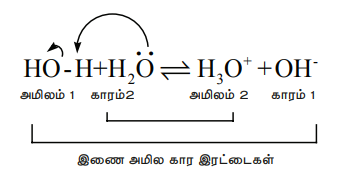
மேற்காண் அயனியாதலில், ஒரு நீர் மூலக்கூறு அமிலமாகவும், அதே சமயம் மற்றொரு நீர் மூலக்கூறு காரமாகவும் செயல்படுகிறது.
மேற்காண் அயனியாதலுக்கான பிரிகை மாறிலியை பின்வரும் சமன்பாடு குறிப்பிடுகிறது.
K = [H3O+] [OH-] / [H2O]2 ....... (8.3)

தூய திரவ நீரின் செறிவு. அதாவது, [H2O]2 = 1
ஃ Kw = [H3O+] [OH-] ... (8.4)
இங்கு Kw என்பது நீரின் அயனிப் பெருக்கத்தை (அயனிப் பெருக்கம் மாறிலி) குறிப்பிடுகிறது. 25°C வெப்பநிலையில் தூய நீரில் H3O+ அயனியின் செறிவு 1×10-7 ஆக இருக்கும் என்பது சோதனை மூலம் கண்டறியட்டுள்ளது. நீர் பிரிகையடையும் போது சம எண்ணிக்கையில் H3O+ மற்றும் OH- அயனிகள் உருவாக்கப்படுவதால் OH - அயனிச் செறிவு மதிப்பும் 25°C வெப்பநிலையில் 1×10-7 க்கு சமமாக இருக்கும்.
எனவே, 25°C ல் நீரின் அயனிப் பெருக்கம்
Kw = [H3O]+ [OH-] ... (8.4)
Kw = (1 × 10-7) (1 × 10-7)
= 1×10-14
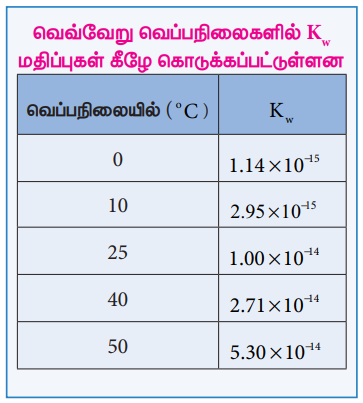
மற்ற எல்லா சமநிலை மாறிலிகளைப் போலவே, ஒரு குறிப்பிட்ட வெப்பநிலையில் Kw யும் ஒரு மாறிலி நீரின் அயனியாக்கம் ஒரு வெப்பம் கொள்வினையாகும் வெப்பநிலை அதிகரிக்கும் போது, H3O+ மற்றும் [OH-] அயனிச் செறிவுகளும் அதிகரிக்கின்றன, எனவே அயனிப் பெருக்கமும் அதிகரிக்கிறது.
NaCl போன்ற நடுநிலையான நீர்க்கரைசல்களில், H3O+ அயனிகளின் செறிவானது எப்பொழுதும் OH- அயனிகளின் செறிவிற்கு சமமாக இருக்கும். ஆனால் அமிலமாகவோ அல்லது காரமாகவோ செயல்படும் ஒரு பொருளின் நீர்க்கரைசலில் [H3O+] அயனியின் செறிவானது, [OH-] அயனிச் செறிவிற்கு சமமாக இருக்காது.
நீரிய HCl கரைசலை ஒரு எடுத்துக்காட்டாக கருதுவதன் மூலம் இதை நாம் புரிந்து கொள்ள முடியும். நீரின் சுய அயனியாதலுடன் கூடுதலாக, HCl பிரிகையடைவதால் ஏற்படும் பின்வரும் சமநிலையும் உள்ளன.
HCl+H2O ↔ H3O+ + C1-
இந்த நேர்வில், நீரின் சுய அயனியாதலுடன் கூடுதலாக, HCl மூலக்கூறுகளும் நீருக்கு ஒரு புரோட்டானை வழங்கி H3O+ அயனிகளை உருவாக்குகின்றன எனவே, [H3O+] > [OH-). அதாவது நீரிய HCl கரைசல் அமிலத்தன்மை வாய்ந்தது. இதேபோல, NH3, NaOH போன்ற நீரிய காரக் கரைசல்களில் [OH-] > [H3O+]
எடுத்துக்காட்டு 8.1
2 × 10-3 M, H3O+ அயனிச் செறிவைக் கொண்டுள்ள ஒரு பழரசத்தில் OH- அயனிச் செறிவை கணக்கிடுக. கரைசலின் தன்மையை கண்டறிக. கொடுக்கப்பட்டது H3O+ = 2×10-3M
Kw = [H3O+] [OH-]
ஃ[OH-] Kw / [H3O+] = 1×10-14 / 2×10-3 = 5×10-12M
2×10-3 > > 5×10-12
அதாவது [H3O+] >> [OH- ), எனவே பழச்சாறு அமிலத்தன்மை கொண்டது
தன்மதிப்பீடு - 5
ஒரு குறிப்பிட்ட வெப்பநிலையில் ஒரு நடுநிலைக் கரைசலின் Kwமதிப்பு 4×10-14 எனில், [H3O+] மற்றும் (OH-) அயனிச் செறிவுகளை கணக்கிடுக.
கொடுக்கப்பட்ட கரைசல் நடுநிலைத் தன்மை யுடையது.
ஃ [H3O]+ '= [OH-] Let [H3O+] = x; எனக் கருதினால் [OH-] = x
Kw = [H3O+] [OH-]
4 × 10-14 =X.X
x2 = 4 × 10-14
X = √4 × 10-14