அயனிச் சமநிலை | வேதியியல் - எண்ணியல் கணக்குகளுக்கான விடைகள் மற்றும் தீர்வுகள் | 12th Chemistry : UNIT 8 : Ionic Equilibrium
12 ஆம் வகுப்பு வேதியியல் : அத்தியாயம் 8 : அயனிச் சமநிலை
எண்ணியல் கணக்குகளுக்கான விடைகள் மற்றும் தீர்வுகள்
எடுத்துக்காட்டு 8.1
2 × 10-3 M, H3O+ அயனிச் செறிவைக் கொண்டுள்ள ஒரு பழரசத்தில் OH- அயனிச் செறிவை கணக்கிடுக. கரைசலின் தன்மையை கண்டறிக. கொடுக்கப்பட்டது H3O+ = 2×10-3M
Kw = [H3O+] [OH-]
ஃ[OH-] Kw / [H3O+] = 1×10-14 / 2×10-3 = 5×10-12M
2×10-3 > > 5×10-12
அதாவது [H3O+] >> [OH- ), எனவே பழச்சாறு அமிலத்தன்மை கொண்டது
எடுத்துக்காட்டு 8.2
0.001M HCl கரைசலின் pH மதிப்பை கணக்கிடுக
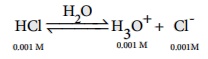
103-M HCIயில் உள்ள [H3O+] செறிவுடன் ஒப்பிடும்போது, நீரின் சுய அயனியாக்கத்திலிருந்து உருவாகும் [H3O+] (10-7 M) செறிவு ஒதுக்கத்தக்கது.
எனவே [H3O+] = 0.001 mol dm-3
pH = - log 10[H3O+]
= - log 10 (0.001)
= - log 10 (10-3) = 3
குறிப்பு: ஒரு அமிலம் அல்லது காரத்தின் செறிவு 10-6 M ஐவிட குறைவாக இருந்தால், நீரின் சுய அயனியாக்கத்திலிருந்து உருவாகும் H3O+ செறிவை நாம் ஒதுக்க இயலாது. இத்தகைய நேர்வுகளில்
[H3O+] + = 10-7(நீரிலிருந்து) + H3O+ ( அமிலத்திலிருந்து).
இதேபோல, [OH-] = 10-7 M (நீரிலிருந்து) + [OH-] (காரத்திலிருந்து)
எடுத்துக்காட்டு 8.3
10-7 M HCl ன் pH மதிப்பை கணக்கிடுக.
H2O அயனியாவதிலிருந்து உருவாகும் [H3O+] + கருத்தில் கொள்ளாத போது
[H3O+] = [HCl] = 10-7 M
i.e.,pH=7, இது நடுநிலைக் கரைசலின் pH மதிப்பாகும். HCl கரைசலின் செறிவு எதுவாயினும் அக்கரைசல் அமிலத்தன்மை கொண்டது என்பதை நாம் அறிவோம். அதாவது pH மதிப்பு 7 ஐ விட குறைவாக இருத்தல் வேண்டும். இந்த நேர்வில் அமிலத்தின் செறிவு மிகக் குறைவு (10-7 M) எனவே, நீரின் சுய அயனியாக்கத்திலிருந்து உருவாகும் [H3O+] (10-7 M) செறிவை நாம் ஒதுக்க முடியாது.
எனவே, இதில் நீரின் சுய அயனியாக்கத்திலிருந்து உருவாகும் [H3O]+ செறிவை கருத்தில் கொள்ள வேண்டும்.
[H3O+] = 10-7 (நீரிலிருந்து) + [H3O+] ( HCl அமிலத்திலிருந்து)
= 10-7 (1+1) = 2×10-7
pH = - log 10 [H3O+]
= - log 10 (2×10-7) = - [log 2 + log 10-7 ]
= -log2-(-7). log 1010
=7 - log2
= 7- 0.3010 = 6.6990
= 6.70
எடுத்துக்காட்டு 8.4
ஒரு வலிமை குறைந்த மின்பகுளியின் 0.10M செறிவுடைய கரைசல் 25°C ல் 1.20% வரை பிரிகையடைகிறது என கண்டறியப்பட்டுள்ளது. அமிலத்தின் பிரிகை மாறிலி மதிப்பை காண்க.
கொடுக்கப்பட்டது α =1.20% = 1.20/100 = 1.2×10-2
Ka = α2C
= (1.2 × 10-2) 2 (0.1) =1.44 × 10 -4 × 10-1
= 1.44 × 10-5
எடுத்துக்காட்டு 8.5
0.1M CH3COOH கரைசலின் pH மதிப்பை கணக்கிடுக. அசிட்டிக் அமிலத்தின் பிரிகை மாறிலி மதிப்பு 1.8 × 10-5
pH = -log [H+ ]
வலிமை குறைந்த அமிலங்களில்
[H+ ] = √Ka × C
= √1.8 × 10-5 × 0.1
= 1.34 × 10-3M pH = - log (1.34×10-3)
= 3 - log 1.34
= 3 - 0.1271
= 2.8729 ≈ 2.87
எடுத்துக்காட்டு 8.6
1.0.20 மோல் லிட்டர்-1 சோடியம் அசிட்டேட் மற்றும் 0.18 மோல் லிட்டர்1 அசிட்டிக் அமிலம் ஆகியவை கலந்துள்ள ஒரு தாங்கல் கரைசலின் pH மதிப்பை கணக்கிடுக. அசிட்டிக் அமிலத்தின் Ka மதிப்பு 1.8 × 10-5.
pH = pKa + log [உப்பு] / [காரம்]
கொடுக்கப்பட்டது Ka = 1.8 × 10-5
ஃ pKa =- log (1.8×10-5) = 5- log 1.8
= 5 - 0.26
= 4.74
ஃ pH = 4.74 + log 0.20 / 0.18
= 4.74 + log 10 / 9 = 4.74 + log 10 – log 9
= 4.74 + 1 - 0.95 = 5.74 - 0.95
= 4.79
எடுத்துக்காட்டு 8.7
500 ml கனஅளவுள்ள நீரில், 6 கிராம் அசிட்டிக் அமிலம் மற்றும் 8.2 கிராம் சோடியம் அசிட்டேட் ஆகியவற்றை நீரில் கரைத்து பெறப்பட்ட கரைசலின் pH மதிப்பு என்ன? (கொடுக்கப்பட்டது: அசிட்டிக் அமிலத்தின் Ka மதிப்பு 1.8 × 10-5 )
ஹென்டர்சன் – ஹேசல்பாக் சமன்பாட்டின்படி,
pH = pKa+ log [உப்பு] / [அமிலம்]
pKa = - log Ka = - log (1.8 × 10-5) = 4.74 (எடுத்துக்காட்டு 8.6-ஐ காண்க)

ஃ pH = 4.74 + log (0.2) / (0.2)
pH = 4.74 + log 1
pH = 4.74 + 0 = 4.74
எடுத்துக்காட்டு 8.8
0.1M திறனுடைய CH3COONa கரைசலின் i) நீராற்பகுத்தல் வீதம், ii) நீராற்பகுத்தல் மாறிலி, மற்றும் iii) pH ஆகியவற்றைக் கணக்கிடுக. (CH3COOH அமிலத்தின் pKa மதிப்பு 4.74).
தீர்வு : (a) CH3COONa என்பது, ஒரு வலிமைகுறைந்த அமிலம் (CH3COOH) மற்றும் ஒரு வலிமைமிகு காரம் (NaOH) ஆகியவற்றின் உப்பாகும்.எனவே, நீராற்பகுத்தலின் காரணமாக கரைசலானது காரத் தன்மையை பெற்றுள்ளது.
CH3COO- (aq) + H2O (aq) ↔ CH3COOH (aq) + OH+ (aq)
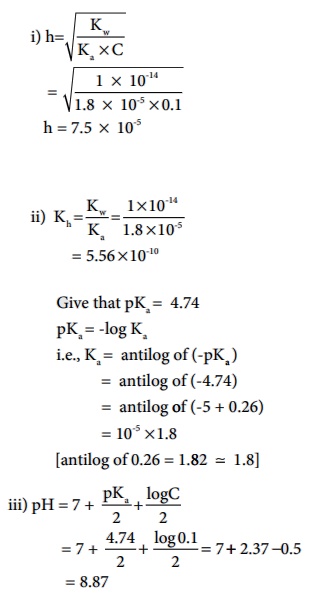
எடுத்துக்காட்டு 8.9
1 mL 0.1M லெட் நைட்ரேட் கரைசல் மற்றும் 0.5 mL 0.2 M NaCl கரைசல் ஆகியவற்றை ஒன்றாக கலக்கும்போது லெட் குளோரைடு வீழ்படிவாகுமா? வீழ்படிவாகாதா? என கண்டறிக. PbC12 இன் Ksp மதிப்பு 1.2 × 10-5
அயனிப்பெருக்கம் = [Pb2+] [Cl-]2
மொத்த கனஅளவு = 1.5 mL
Pb(NO3)2 ↔ Pb2+ + 2NO3-
0.1M 0.1M
Pb2+ ன் மோல் எண்ணிக்கை = மோலாரிட்டி × கரைசலின் கனஅளவு லிட்டரில்
= 0.1×1×10-3 = 10-4
[Pb2+ ] = Pb2+ ன் மோல்களின் எண்ணிக்கை / கரைசலின் கன அளவு
= 10-4 / 1.5 ×10-3 mL = 6.7 × 10-2M
NaCl → Na+ +C1-
0.2M 0.2M 0.2M
Cl -ன் மோல் எண்ணிக்கை = 0.2 × 0.5 × 10-3 = 10-4
[Cl-] = 10-4 moles / 1.5 × 10-3 L = 6.7 × 10-2M
அயனிப்பெருக்க மதிப்பு = (6.7 × 10-2) (6.7× 10-2) 2 = 3.01 × 10-4

அயனிப்பெருக்க மதிப்பு 3.01 × 10-4 ஆனது கரைதிறன் பெருக்க மதிப்பை (1.2 × 10-5) விட அதிகமாக இருப்பதால் PbCl2 வீழ்படிவாகிறது.
எடுத்துக்காட்டு 8.10
பின்வருவனவற்றிற்கு, கரைதிறன் பெருக்கம் மற்றும் மோலார் கரைதிறன் ஆகியவற்றிற்கிடையே உள்ள தொடர்பை நிறுவுக.
a. BaSO4
b.Ag2 (CrO4 )
BaSO4 (s) ←H2O→ Ba2+ (aq) + SO42-(aq)
Ksp =[Ba2+ ][SO42-]
= (s) (s)
Ksp = S2
Ag2 CrO4 (s) ←H2O→ 2Ag + (aq) + CrO42-(aq)
Ksp = [Ag+ ]2[CrO42-]
= (2s)2 (s)
Ksp =4s3
புத்தகவினாக்கள்
8. 0.04 M HNO3 கரைசலின் pH மதிப்பை கண்டுபிடி HNO3 ன் செறிவு = 0.04 M
[H3O+] = நார்மாலிட்டி
= மோலாரிட்டி × காரத்துவம்
= 0.04 × 1 = 0.04 = 4 × 10-2
pH = -log10[H30+]
= -log 4 × 10-2
= -log 4 - log 10-2
= -log 4 + 2 log 10
= 2 - log 4
= 2 - 0.6021
= 1.3979
pH ≈ 1.40
14. 1.5 × 10-3 M Ba(OH)2 கரைசலின் pH மதிப்பை கணக்கிடுக.
Ba(OH)2 ன் அமிலத்துவம் = 2
நார்மாலிட்டி = மோலாரிட்டி × அமிலத்துவம்
= 1.5 × 10-3 × 2
= 3 × 10-3
எனவே [OH-] = நார்மாலிட்டி = 3 × 10-3
pOH = -log [OH-]
= -log 3 × 10-3
= - log 3 - log 10-3
= -log3 + 3 log 10
= 3 - log3
= 3 - 0.4771
pOH = 2.5229
pH + pOH = 14
pH = 14 - pOH
= 14 - 2.5229
= 11.4771
pH ≈ 11.48
15. 50ml கன அளவுடைய 0.025 M KOH கரைசலுடன் 50ml கன அளவுடைய 0.05 M HNO; கரைசல் சேர்க்கப்படுகிறது. இறுதியில் பெறப்பட்ட கரைசலின் pH மதிப்பை கணக்கிடுக.
மில்லிமோல்கள் = Vமிலி × மோலாரிட்டி
HNO3 ன் மில்லி மோல்கள் = 50 × 0.05 = 2.5
KOHன் மில்லிமோல்கள் = 50 × 0.025 = 1.25
இரு கரைசல்களையும் சேர்த்த பின், மீதமுள்ள HNO3 ன் மில்லி மோல்கள் = 2.5 - 1.25 = 1.25 மொத்த கன அளவு = 50 + 50 = 100 மிலி
மோலாரிட்டி = மில்லிமோல்கள் / Vமிலி = 1.25 / 100
மோலாரிட்டி = 1.25 × 10-2
HNO3 ன் காரத்துவம் = 1
ஃ நார்மாலிட்டி = மோலாரிட்டி × காரத்துவம்
= 1.25 × 10-2 × 1
=1.25 × 10-2
ஃ [H3O+] = 1.25 × 10-2
pH = -log[H3O+]
= -log 1.25 × 10-2
= -log 1.25 - log 10-2
= - log 1.25 + 2 log 10
= 2 - log 1.25
= 2 - 0.0969
pH = 1.9031
16. HCN இன் Ka மதிப்பு 10-9 எனில் 0.4 M HCN கரைசலின் pH மதிப்பு என்ன?
Ka = 10-9;C= 0,4 M : pH = ?
HCN ஒரு வலிமை குறைந்த அமிலம்
ஃ [H3O+] = Cɑ = √Ka.C = √10-9 × 0.4
= √4 × 10-9
= 2 × 10-5
pH = -log10[H3O+] = -log2 × 10-5
= -log2 - log10-5
= -log2 + 5 log 10 = 5 - log 2,
= 5 - 0.3010
pH = 4.6990
17. 0.1 M அம்மோனியம் அசிட்டேட் கரைசலின் நீராற் பகுப்பு வீதம் மற்றும் pH மதிப்பை கணக்கிடுக. Ka = Kb = 1.8 × 10-5 என கொடுக்கப்பட்டுள்ளது.
Ka = Kb = 1.8 × 10-5
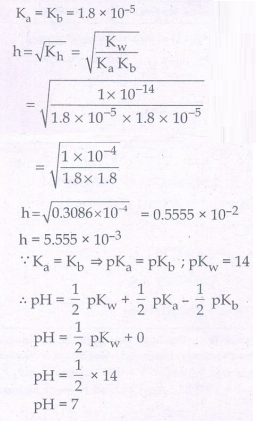
pH = 7
19. Ag2CrO4 ன் கரைதிறன் பெருக்க மதிப்பு 1 × 10-12 ஆகும். 0.01 M AgNO3 கரைசலில் Ag2Cro4 ன் கரைதிறனை கணக்கிடுக.
Ag2CrO4 → 2Ag+ + CrO42-
கரைதிரன்
AgNO3 → Ag+ + NO3-
செறிவு 0.01M 0.01M 0.01M
[Ag+] = 2 S + 0.01
ஃ 0.01>>2S, எனவே2S புறக்கணிக்கத்தக்கது
ஃ [Ag+] = 0.01 = 1 × 10-2 .
[CrO4-] = S; Ksp = 1 × 10-12
ஃ Ksp = [Ag+]2 [Cro42-]
1 × 10-12 = (1 × 10-2)2 × s
ஃS = 1 × 10-12 / 1 × 10-4 ⇒ S = 1 × 10-8M
20. Ca3(PO4)2 இன் கரைதிறன் பெருக்கத்திற்கான சமன்பாட்டை எழுதுக.
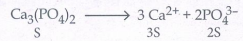
Ksp= [Ca2+]3 [PO43-]2
Ksp= (3s)3 (2s)2
Ksp = 27 S3 4s2
Ksp = 108 S5
21. CaF2(s) ஐ நீரில் கரைத்து ஒரு தெவிட்டிய கரைசல் தயாரிக்கப்படுகிறது. அக்கரைசலில் [Ca2+] = 3.3 × 10-4 M எனில், Caf2 Ksp மதிப்பு என்ன?
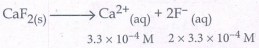
Ksp = [Ca2+] [F-]2
= (3.3 × 10-4) (2 × 3.3 × 10-4)2
= 3.3 × (6.6)2 × 10-4 × 10-8
= 143.748 × 10-12
Ksp = 1.44 × 10-10 M3
22. . AgCl ன் Ksp மதிப்பு 1.8 × 10-10 எனில், 1 M AgNO3 கரைசலில் மோலார் கரைதிறனைக் கணக்கிடுக.
Ksp = 1.8 × 10-10 [AgNO3] =1M
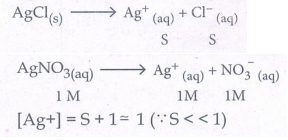
[Ag+] = S+1 = 1 = 1 (S<<1)
[Cl-] = S
Ksp = [Ag+] [Cl-]
1.8 × 10-10 =1 × S
ஃ S = 1.8 × 10-10 M
23. சில்வர் குரோமேட்டின் ஒரு குறிப்பிட்ட தெவிட்டிய கரைசலானது பின்வரும் செறிவுகளை கொண்டு உள்ள து. [Ag+] = 5 × 10-5 மற்றும் [CrO42-] = 4.4 × 10-4 M.. Ag2CrO4ன் Ksp மதிப்பு என்ன?
Ag2CrO4(s) ⇌ 2Ag+(aq) + CrO42−(aq)
[Ag+] = 5 × 10-5M
[CrO42-] = 4.4 × 10-4M
Ksp= ?
Ksp= [Ag+]2 [CrO42-]
= (5 × 10-5)2 (4.4 × 10-4)
Ksp =1.1 × 10-12 M3
24. Hg2Cl2 இன் கரைதிறன் பெருக்கத்திற்கான சமன்பாட்டை எழுதுக.
Hg2Cl2 ⇌ Hg22+ + 2Cl−
s s 2s
Ksp = [Hg22+] [Cl-]2
= S(2S)2
Ksp = 4s3
25. Ag2CrO4 ன் கரைதிறன் பெருக்க மதிப்பு 1.1 × 10-12 ஆகும் 0.1 MK2CrO4 கரைசலில் Ag2CrO4ன் கரைதிறன் என்ன?
Ksp =1.1 × 10-12 [K2CrO4] = 0.1 M
S =?
Ag2CrO4 ⇌ 2Ag+ + CrO42−
x 2x x
K2CrO4 ⇌ 2K+ + CrO42−
0.1 M 0.2 M 0.1 M
[Ag+] = 2S
[CrO42−] = (x + 0.1) ≈ 0.1 ∵ x < < 0.1
Ksp = [Ag+]2 [CrO42−]
1.1 × 10−12 = (2x)2 (0.1)
1.1 × 10−12 = 0.4 x2
x2 = [1.1×10−12] / 0.4 ; x = √[1.1 × 10−12] / [0.4]
x = √(2.75 × 10−12)
x = 1.65 × 10−6 M
26. 0.150L கன அளவுடைய 0.1 M Pb(NO3)2 மற்றும் 0.100 1 கன அளவுடைய 0.2 M NaCl கரைசல் ஆகியவற்றை ஒன்றாக கலக்கும்போது வீழ்படிவு உருவாகுமா? Ksp (PbCl2) = 1.2 × 10-5.
மொத்த கன அளவு = 0.150 + 0.100 = 0.250 L
Pb(NO3)2 ⇌ Pb2+ + 2NO−3
0.1 M 0.1M 0.2 M
Pb2+ன் மோல்கள் = V × M
= 0.150 × 0.1
கரைசல்கள் ஒன்றாக கலந்தபின் [Pb2+]
= Pb2+ ன்மோல்கள் / மொத்த கனஅளவு
= ( 0.150 × 0.1) / (0.250) = 0.06M
Cl-ன்மோல்கள் =V × M
= 0.100 × 0.2
கரைசல்கள் ஒன்றாக கலந்தபின் [Cl-]
= Cl-ன் மோல்கள் / மொத்த கன அளவு
= 0.100 × 0.2 / 0.250 = 0.08M
கரைசல்கள் கலந்த பின் [Pb2+]
= 0.06 M; [Cl-] = 0.08 M
PbCl2 ⇌ Pb2+ + 2Cl-
அயனிப் பெருக்கம் = [Pb2+] [Cl-]2
= (0.06) (0.08)2
= 3.84 × 10-4
Ksp மதிப்பு = 1.2 × 10-5
அயனிப்பெருக்கம் >Ksp
ஃ எனவே PbCl2 வீழ்படிவு உருவாகும்.
27.Al(OH)3 ன் Ksp மதிப்பு 1 × 10-15 M. NH4Cl மற்றும் NH4OH தாங்கல் கரைசலை சேர்க்கும் போது எந்த pH மதிப்பில் 1.0 × 10-3M A13+ வீழ்படிவாகும்?
Al(OH)3 ⇌ Al3+(aq) + 3OH-(aq)
Ksp = [A13+] [OH-]3 அயனிப் பெருக்கம் > Ksp எனில்
Al(OH)3 வீழ்படிவாதல் நிகழ
அதாவது (A13+] [OH-]3 >Ksp
(1 × 10-3) [OH-]3 >1 × 10-15
[OH-]3 > (1 × 10-15) / (1 × 10-3)
[OH-]3 > 1 × 10-12
[OH-] > 1 × 10-4
[OH-] > 1 × 10-4M
ஃpOH = -log[OH-]
= -log 1 × 10-4
pOH = 4
ஃ pH = 14 - pOH = 14 - 4 =10
pH =10 ல் A1(OH)3 வீழ்படிவாகும்.