தயாரித்தல், பண்புகள், பயன்கள் - ஆக்சிஜன் | 12th Chemistry : UNIT 3 : p-Block Elements-II
12 ஆம் வகுப்பு வேதியியல் : அத்தியாயம் 3 : P-தொகுதி தனிமங்கள் -II
ஆக்சிஜன்
ஆக்சிஜன்:
தயாரித்தல் :
வளிமண்டல காற்று மற்றும் நீர் ஆகியன மூறையே 23% மற்றும் 83% நிறைச்சதவீதம் ஆக்ஸிஜனைக் கொண்டுள்ளன. உலகில் காணப்படும் பெரும்பாலான பாறைகள் ஆக்ஸிஜனை சேர்ம நிலையில் கொண்டுள்ளன. தொழிற் முறையில், திரவமாக்கப்பட்ட காற்றை பின்னக் காய்ச்சி வடிப்பதன் மூலம் ஆக்ஸிஜன் பெறப்படுகிறது. ஆய்வகத்தில், ஹைட்ரஜன் பெராக்சைடை வினைவேக மாற்றி (MnO2)முன்னிலையில் சிதைத்தோ அல்லது பொட்டாசியம் பெர்மாங்கனேட் கொண்டு ஆக்ஸிஜனேற்றம் அடையச்செய்தோ ஆக்ஸிஜன் தயாரிக்கப்படுகிறது.
2H2 O2 ↔ 2H2O + O2
5H2O2 + 2MnO4- + 6H+ → 5O2 + 8H2O + 2Mn2+
சில குறிப்பிட்ட உலோக ஆக்சைடுகள் அல்லது ஆக்சோ எதிரயனிகள் வெப்பச்சிதைவடைந்து ஆக்ஸிஜனை வெளியேற்றுகின்றன
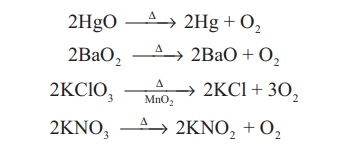
தயாரித்தல்
சாதாரண நிலையில், டை ஆக்ஸிஜன் ஈரணு வாயு மூலக்கூறாக காணப்படுகிறது. ஆக்ஸிஜன் பாரா காந்தத் தன்மை கொண்டது.நைட்ரஜன் மற்றும் புளூரினைப் போலவே ஆக்ஸிஜன் வலிமையான ஹைட்ரஜன் பிணைப்புகளை உருவாக்குகிறது. டை ஆக்ஸிஜன் (O2) மற்றும் ஓசோன் அல்லது ட்ரை ஆக்ஸிஜன் (O3) என இரண்டு புறவேற்றுமை வடிவங்களில் ஆக்ஸிஜன் காணப்படுகிறது. கடல் மட்டத்தில் ஒதுக்கத்தக்க அளவு ஓசோன் காணப்படினும், இது புறஊதாக் கதர்களின் விளைவால் உயர் வளிமண்டலத்தில், உருவாக்கப்படுகிறது. ஆய்வகத்தில், ஆக்ஸிஜன் வாயுவின் வழியே மின்பாய்ச்சலை உருவாக்கி ஓசோன் தயாரிக்கப்படுகிறது. 20,000 V மின்னழுத்தத்தில் ஏறத்தாழ 10% ஆக்ஸிஜன் , ஓசோனாக மாற்றப்படுகிறது, இதனால் ஓசோன் கலந்த ஆக்ஸிஜன் கலவை கிடைக்கிறது. திரவமாக்கப்பட்ட ஓசோன் கலந்த ஆக்ஸிஜனை பின்னக் காய்ச்சிவடித்தலின் போது ஓசோன் தூய நிலையில் வெளிரிய நீல நிற வாயுவாக கிடைக்கிறது.
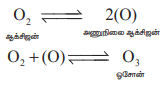
படம் 3.8 ஓசோனின் வடிவமைப்பு
ஓசோன் மூலக்கூறு வளைந்த வடிவத்தையும், ஆக்ஸிஜன் அணுக்களுக்கிடையே சீர்மையான உள்ளடங்கா பிணைப்பையும் பெற்றுள்ளது.
வேதிப் பண்புகள்
ஓசோன் மற்றும் ஆக்சிஜனின் வேதிப்பண்புகள் பெருமளவில் வேறுபடுகின்றன. ஆக்சிஜன் பல்வேறு உலோகங்கள் மற்றும் அலோகங்களுடன் சேர்ந்து ஆக்சைடுகளை உருவாக்குகின்றன. S தொகுதி தனிமங்களை போன்ற சில தனிமங்கள் அறை வெப்பநிலையில் ஆக்சிஜனுடன் வினைபடுகின்றன. வினைத் திறன் குறைந்த சில உலோகங்கள் நன்கு தூள் செய்யப்பட்ட நிலையில் வினைபடுகின்றன. இத்தகைய நன்கு தூள் செய்யப்பட்ட உலோகங்கள் பைரோபோரிக் என அழைக்கப்படுகின்றன. இவைகள் தீப்பற்றி எரியும் போது நிகழும் வினையினால் வெப்பம் வெளியிடப்படுகிறது.
மாறாக, ஓசோனானது ஒரு வலிமையான ஆக்சிஜனேற்றும் காரணியாகும். மேலும், ஆக்சிஜன் வினைபுரியாத பல சேர்மங்களுடன் ஓசோன் அதே நிபந்தனைகளில் வினைபுரிகிறது. எடுத்துக்காட்டாக, இது பொட்டாசியம் அயோடைடை அயோடினாக ஆக்சிஜனேற்றம் அடையச் செய்கிறது. இவ்வினை ஓசோனை அளந்தறியப் பயன்படுகிறது.
O3+2KI + H2O → 2KOH + O2 + I2
வழக்கமாக இது கரிமச் சேர்மங்களை ஆக்சிஜனேற்றம் அடையச் செய்ய பயன்படுகிறது. அமிலக் கரைசலில் இதனுடைய ஆக்சிஜேனேற்ற திறனானது புளூரின் மற்றும் அணுநிலை ஆக்சிஜனை விஞ்சியிருத்தல். காரக் கரைசலில் ஓசோனின் சிதைவடையும் வீதம் குறைகிறது.
பயன்கள்
1. உயிரினங்கள் வாழ்வதற்கு ஆக்சிஜன் மிக இன்றியமையாததாகும்.
2. ஆக்சிஅசிட்டிலீன் பற்றவைப்பானில் பயன்படுகிறது.
3. திரவ ஆக்சிஜன் ராகெட்டுகளில் எரிபொருளாகப் பயன்படுகிறது.