தயாரித்தல், பண்புகள், அமைப்பு, பயன்கள் - பாஸ்பீன் | 12th Chemistry : UNIT 3 : p-Block Elements-II
12 ஆம் வகுப்பு வேதியியல் : அத்தியாயம் 3 : P-தொகுதி தனிமங்கள் -II
பாஸ்பீன்
பாஸ்பீன் (PH3)
பாஸ்பரஸின் ஹைட்ரைடுகளில் மிக முக்கியமானது பாஸ்பீன் ஆகும்.
தயாரித்தல்:
கார்பன் டை ஆக்சைடு அல்லது ஹைட்ரஜன் மந்தச் சூழலில் வெண்பாஸ்பரஸை சோடியம் ஹைட்ராக்சைடுடன் வினைப்படுத்தி பாஸ்பீன் தயாரிக்கப்படுகிறது.
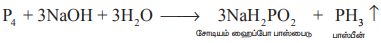
இவ்வினையில் உருவாகும் பாஸ்பீனுடன் கலந்துள்ள பாஸ்பீன் டைஹைட்ரைடை (P2H4) நீக்கும் பொருட்டு, உறைக் கலவையின் வழியாக செலுத்தப்படுகிறது. பாஸ்பீன் டைஹைட்ரைடு சுருக்கமடைகிறது. அவ்வாறு சுருக்கமடையாத பாஸ்பீன் பிரித்தெடுக்கப்படுகிறது.
நீர் அல்லது நீர்த்த கனிம அமிலங்களைக் கொண்டு உலோக பாஸ்பைடுகளை நீராற்பகுப்பதலின் மூலமாகவும் பாஸ்பீனைத் தயாரிக்க இயலும்.
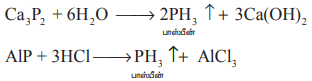
பாஸ்பரஸ் அமிலத்தை வெப்பப்படுத்துவதன் மூலம் பாஸ்பீன் தூய நிலையில் பெறப்படுகிறது.
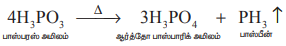
காஸ்டிக் சோடா கரைசலுடன் பாஸ்போனியம் அயோடைடு சேர்த்து வெப்பப்படுத்தி தூய பாஸ்பீன் பெறப்படுகிறது.

இயற் பண்புகள்:
இது நிறமற்ற, விஷத்தன்மை கொண்ட, அழுகிய மீன் நாற்றமுடைய வாயுவாகும். இது நீரில் சிறிதளவே கரைகிறது மேலும் லிட்மஸ் சோதனையில் நடுநிலைத் தன்மையைக் காட்டுகிறது. இது 188 K வெப்பநிலையில் குளிர்ந்து நிறமற்ற திரவமாகிறது. 139.5 K வெப்பநிலையில் உறைந்து திண்மமாகிறது.
வேதிப் பண்புகள்:
வெப்ப நிலைப்புத்தன்மை: காற்றில்லா சூழலில் 317 K வெப்பநிலைக்கு வெப்பப்படுத்தும்போது அல்லது அதன் வழியே மின் பாய்ச்சலை நிகழ்த்தும்போது பாஸ்பீன் வாயுவானது அதன் தனிமங்களாக சிதைவடைகிறது.
4PH3 317K → P4 + 6H2
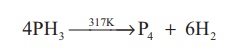
எரித்தல்: பாஸ்பீன் வாயுவை காற்று அல்லது ஆக்சிஜனுடன் வெப்பப்படுத்தும்போது எரிந்து மெட்டா பாஸ்பாரிக் அமிலத்தை தருகிறது.
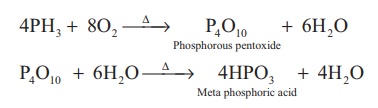
காரப் பண்பு: பாஸ்பீன்ஒரு வலிமை குறைந்த காரமாகும், இது ஹேலஜன் அமிலங்களுடன் வினைப்பட்டு பாஸ்போனியம் உப்புக்களை உருவாக்குகிறது.
PH3 + HI → PH4I
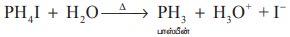
இது, ஹேலஜன்களுடன் வினைப்பட்டு பாஸ்பரஸ் பென்டா ஹேலைடுகளைத் தருகிறது.
PH3 + 4C12 → PC15 + 3HCI
ஒடுக்கும் பண்பு : பாஸ்பீன், சில உலோகங்களை அவற்றின் உப்புக் கரைசல்களிலிருந்து வீழ்படிவாக்குகிறது.
3AgNO3 + PH3 → Ag3P + 3HNO3
இது, போரான் ட்ரைகுளோரைடு போன்ற லூயி அமிலங்களுடன் இணைந்து அணைவுச் சேர்மங்களை உருவாக்குகிறது.
BC13 + PH3 → [C13B ← PH3]
அனைவுச் சேர்மம்
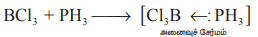
வடிவமைப்பு:
பாஸ்பீனில், பாஸ்பீன் அணு sp3 இனக்கலப்பிலுள்ளது. மூன்று ஆர்பிட்டால்கள் பிணைப்பு எலக்ட்ரான் இரட்டைகளால் நிரப்பப்பட்டுள்ளது. மேலும், நான்முகியின் நான்காம் மூலை தனித்த எலக்ட்ரான் இரட்டையால் நிரப்பப்பட்டுள்ளது. எனவே பிணைப்புக் கோணம் 93.5o க்கு குறைக்கப்பட்டுள்ளது. பாஸ்பீன் பிரமிடு வடிவத்தைப் பெற்றுள்ளது.
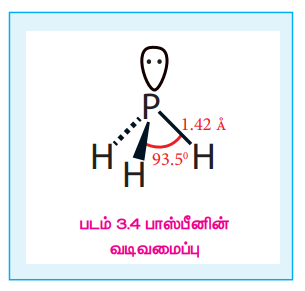
படம் 3.4 பாஸ்பீனின் வடிவமைப்பு
பாஸ்பீனின் பயன்கள்:
பாஸ்பீன் அதிகளவில் புகையை உருவாக்குவதால் புகைத்திரையை உருவாக்க பயன்படுகிறது. கப்பல்களில், கால்சியம் கார்பைடு மற்றும் கால்சியம் பாஸ்பைடுகலவைவைக்கப்பட்டுள்ள, துளையிடப்பட்ட கலனை கடலில் வீசியெறியும்போது அது பாஸ்பீன் மற்றும் அசிட்டிலீன் வாயு கலவையை வெளியேற்றுகிறது. வெளியேற்றப்பட்ட பாஸ்பீன் வாயு தீப்பற்றி எரிந்து அசிட்டிலீனையும் எரியவைக்கிறது. இவ்வாறு எரியும் வாயுக்கள் தொடர்ந்து வரும் கப்பல்களுக்கு சமிக்ஞையாக செயல்படுகின்றன. இது ஹோல்ம் முன்னறிவிப்பான் என அறியப்படுகிறது.