வேதியியல் - இடைநிலை மற்றும் உள் இடைநிலைத் தனிமங்கள் : பின்வரும் வினாக்களுக்கு விடையளிக்க | 12th Chemistry : UNIT 4 : Transition and Inner Transition Elements
12 ஆம் வகுப்பு வேதியியல் : அத்தியாயம் 4 : இடைநிலை மற்றும் உள் இடைநிலைத் தனிமங்கள்
இடைநிலை மற்றும் உள் இடைநிலைத் தனிமங்கள் : பின்வரும் வினாக்களுக்கு விடையளிக்க
வேதியியல் : இடைநிலை மற்றும் உள் இடைநிலைத் தனிமங்கள்
II. பின்வரும் வினாக்களுக்கு விடையளிக்க
1. இடைநிலைத் தனிமங்கள் என்பன எவை? உதாரணம் தருக.
ஒரு தனிமத்தின் அணுவானது முழுவதும் நிரப்பப்படாத d உட்கூட்டினை பெற்றிருந் தாலோ அல்லது அத்தனிமம் உருவாக்கும் நேர் அயனியானது முழுவதும் நிரப்பப்படாத d உட்கூட்டினை பெற்றிருந்தாலோ அது ஒரு இடைநிலை உலோகமாகும்.
(எ.கா) தாமிரம், இரும்பு, கோபால்ட், நிக்கல்
2. 4d வரிசை தனிமங்களின் ஆக்சிஜனேற்ற நிலை களை விளக்குக.
• 4d மற்றும் 5d உலோகங்களின் ஆக்சிஜனேற்ற நிலை இட்ரியம் மற்றும் லாந்தனத்தின் +3 முதல் ருத்தீனியம் மற்றும் ஆஸ்மியத்தின் +8 வரை மாறுபடுகிறது.
• 4d மற்றும் 5d தனிமங்கள், ஆக்சிஜன், புளூரின் மற்றும் குளோரின் ஆகிய அதிக எலக்ட்ரான் கவர் தன்மை உடைய தனிமங்களுடன் உருவாக்கும் சேர் மங்களில் அதிகபட்ச ஆக்சிஜனேற்ற நிலைகளில் காணப்படுகிறது.
(எ.கா) RuO4 என்ற சேர்மத்தில் ருத்தீனியத்தின் ஆக்சிஜனேற்ற நிலை +8 ஆகும்.
3. உள் இடைநிலை தனிமங்கள் என்றால் என்ன?
• (n-2)f ஆர்பிட்டால்களில் இறுதி எலக்ட்ரான்கள் வந்து சேரும் தனிமங்கள் f-தொகுதி தனிமங்கள் எனப்படும். இந்த (n-2)f ஆர்பிட்டால்கள் இணைதிறன் கூட்டிலிருந்து இரண்டாவது உட்கூட்டில் அமைந்துள்ளதால் இவை உள் இடைநிலை தனிமங்கள் எனப்படுகின்றன.
• அவை இருவகைப்படும்.
• 4f வரிசைத் தனிமங்கள் அல்லது லாந்தனைடுகள்
• 5f வரிசைத் தனிமங்கள் அல்லது ஆக்டினைடுகள்
4. லாந்தனாய்டுகள் மற்றும் ஆக்டினாய்டுகள் தனிம வரிசை அட்டவணையில் பெற்றுள்ள இடத்தினை நிறுவுக.
லாந்தனாய்டுகள்
• நவீன தனிம வரிசை அட்டவணையில் தொகுதி 3 வரிசை 6ல்லாந்தனைடுகள் இடம் பெற்றிருக்க வேண்டும்.
• எனினும் ஆறாவது தொடரில் லாந்தனத்திற்கு பிறகு எலக்ட்ரான்கள் 4f உட்கூட்டில் சேர்கின்றன.
• மேலும் லாந்தனத்தைத் தொடர்ந்து வரும் 14 தனிமங்களும் ஒத்த வேதிப் பண்புகளைக் கொண்டுள்ளன.
• எனவே இத் தனிமங்கள் அனைத்தும் ஒருங்கே ஒரே தொகுதியாக தனிம வரிசை அட்ட வணையின் கீழ்புறம் தனியே இடம் பெற்றுள்ளன. பின்வருவன இதனை நியாயப் படுத்துகின்றன
1. பொதுவான எலக்ட்ரான் அமைப்பு : [Xe]4f1-14 5d0,16S2
2.பொதுவான ஆக்சிஜனேற்ற நிலை : +3
3.இத்தனிமங்கள் அனைத்தும் ஒத்த இயற் மற்றும் வேதிப்பண்புகளைக் கொண்டுள்ளன.
ஆக்டினாய்டுகள்
• நவீன தனிம வரிசை அட்டவணையில் தொகுதி 3, வரிசை 7ல ஆக்டினைடுகள் இடம் பெற்றிருக்கவேண்டும்.
• எனினும் ஏழாவது தொடரில் ஆக்டினியத்திற்கு பிறகு எலக்ட்ரான்கள் 5f உட் கூட்டில் சேர்கின்றன.
• மேலும் ஆக்டினியத்தைத் தொடர்ந்து வரும் 14 தனிமங்களும் ஒத்த வேதிப்பண்புகளைக் கொண்டுள்ளன.
• எனவே இத்தனிமங்கள் அனைத்தும் ஒருங்கே ஒரே தொகுதியாக தனிம வரிசை அட்டவணையின் கீழ்புறம் தனியே இடம் பெற்றுள்ளன.
பின்வருவன இதனை நியாயப்படுத்துகின்றன.
1. பொதுவான எலக்ட்ரான் அமைப்பு : [Rn] 5F2-14 6d0-27S2
2. பொதுவான ஆக்ஸிஜனேற்ற நிலை : +3
3. இத்தனிமங்கள் அனைத்தும் ஒத்த இயற் மற்றும் வேதிப்பண்புகளைக் கொண்டுள்ளன.
5. ஆக்டினாய்டுகள் என்றால் என்ன? மூன்று உதாரணங்கள் தருக.
• ஆக்டினியத்தைத் தொடர்ந்து வரும் 14 தனிமங்கள் அதாவது தோரியம் முதல் லாரன்சீயம் வரையிலான தனிமங்கள் ஆக்டினாய்டுகள் எனப்படுகின்றன. (எ.கா) தோரியம், யுரேனியம், நெப்ட்யூனியம்
6. Gd3+ அயனியானது நிறமற்றது. ஏன்?
• Gd: [Xe]4f75d16s2 Gd3+ : [Xe] 4f75d°6s0
• Gd3+ அயனி கூடுதல் நிலைப்புத்தன்மையைப் பெற்றுள்ளது.
• Gd3+ ல் தனித்த 'd' எலக்ட்ரான்கள் d-d இடப் பெயர்ச்சி நிகழ்வதில்லை . எனவே Gd3+ அயனி நிறமற்றது.
7. Cu2+ ன் சேர்மங்கள் நிறமுடையவை ஆனால் Zn2+ன் சேர்மங்கள் நிறமற்றவை. ஏன்?

Cu2+ன் சேர்மங்கள்
1. Cu+ன் எலக்ட்ரான் அமைப்பு 3d94s0
2. தனித்த எலக்ட்ரானின் எண்ணிக்கை ஒன்று
3. தனித்த எலக்ட்ரான் ஒளியை உறிஞ்சி d-d பரிமாற்றத்திற்கு உட்படுகிறது.
4. d- d எலக்ட்ரான் பரிமாற்றத்தினால் Cu2+ன் சேர்மங்கள் நிறமுடையவை.
Zn2+ன் சேர்மங்கள்
1. Zn + ன் எலக்ட்ரான் அமைப்பு 3d104s0
2. தனித்த எலக்ட்ரான்கள் இல்லை
3. d-d பரிமாற்றம் இல்லை
4. d-d எலக்ட்ரான் பரிமாற்றம் இல்லாத காரணத்தினால் Zn2+ சேர்மங்கள் நிறமற்றவை.
8. பொட்டாசியம் டை குரோமேட் தயாரித்தலை விளக்குக.
• தாது: குரோமைட் தாது
• அடர்ப்பித்தல்: புவிஈர்ப்பு முறை
• அடர்ப்பிக்கப்பட்ட தாது அதிகளவு சோடியம் கார்பனேட் மற்றும் சுண்ணாம்பு சேர்க்கப்பட்டு எதிர் அனல் உலையில் வறுக்கப்படுகிறது.
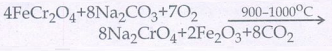
• வறுக்கப்பட்ட தாது நீர் சேர்க்கப்பட்டு கரையாத இரும்ப ஆக்சைடிலிருந்து கரையக் கூடிய குரோமேட்டாக பிரிக்கப்படுகிறது.
• மஞ்சள் நிற சோடியம் குரோமேட் கரைசல் அடர் கந்தக அமிலத்துடன் வினைபடுத்தும் போது சோடியம் டை குரோமேட்டாக மாறுகிறது.
2Na2CrO4+ H2SO4 →
Na2Cr2O7 + Na2SO4+H2O
• மேற்கண்ட கரைசலை அடர்ப்பிக்கும் போது குறைந்த கரைதிறன் உடைய சோடியம் சல்பேட் நீக்கப்படுகிறது. எஞ்சியுள்ள கரைசல் வடிகட்டப் பட்டு பின் அடர்ப்பிக்கப்படுகிறது. இதனை குளிர் வித்து Na2s04.2H20 படிகங்கள் நீக்கப்படுகின்றன.
• சோடியம் டை குரோமேட்டின் நிறைவுற்ற நீர்க்கரைசலுடன் KC1 கரைசல் கலக்கப்பட்டு,பின் அடர்ப்பிக்கும் போது NaCl படிகங்கள் நீக்கப்படுகின்றன.
• இக்கரைசல் சூடான நிலையில் வடிகட்டப்பட்டு, வடிநீரைக் குளிர்விப்பதன் மூலம் K2Cr2O7 படிகங்கள் பெறப்படுகின்றன.
Na2Cr2O7 + 2KCl → K2Cr2O7+ 2NaCl
9. லாந்தனாய்டு குறுக்கம் என்றால் என்ன? அதன் விளைவுகள் யாவை?
லாந்தனாய்டு குறுக்கம்:
• 4f தொடரில் சீரியம் முதல் லுட்டீசியம் வரை செல்லும் போது அணு எண் அதிகரிக்க அதிகரிக்க லாந்தனாய்டுகளின் அணு மற்றும் அயனி ஆரங்கள் சீராகக் குறைந்து வருகின்றன. இவ்வாறு அயனி ஆரம் குறைவது லாந்தனாய்டு குறுக்கம் எனப்படும்.
காரணம்:
• 4f உட்கூடின் விரவிய வடிவம்
• 4f எலக்ட்ரான்களின் திரை மறைப்பு விளைவு குறைவு.
• உட்கரு சுமை அதிகரிப்பதால் 4fஎலக்ட்ரான்களின் மீதான அணுக்கருவின் செயலுறு மின் சுமை அதிகரிக்கிறது.
விளைவுகள்:
1. காரத்தன்மை குறைதல் :
Ln3+ அயனிகளின் உருவளவு குறைவதாலும்,Ln-OH பிணைப்பின் அயனித் தன்மை குறைவதாலும், Ce3+ லிருந்து Lu3+ நோக்கிச் செல்லும்போது Ln3+ அயனிகளின் காரத் தன்மை குறைகிறது.
2. லாந்தனாய்டுகளுக்கிடையேயான ஒற்றுமைகள் :
• லாந்தனாய்டுகளில் அயனி ஆரங்களில் மிகச் சிறிதளவே வேறுபாடுகள் காணப்படுவதால் அவைகளின் வேதிப் பண்புகள் ஏறத்தாழ ஒத்துள்ளன.
3. முதல் மற்றும் இரண்டாம் வரிசை இடைநிலைத் தனிமங்களைக் காட்டிலும்
• இரண்டாம் மற்றும் மூன்றாம் இடைநிலைத் தனிம வரிசைத் தனிமங்கள் அதிகளவில் ஒன்றுக்கொன்று ஒத்துள்ளன.
10. பின்வரும் வினைகளைப் பூர்த்தி செய்க.
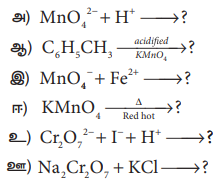
விடை :
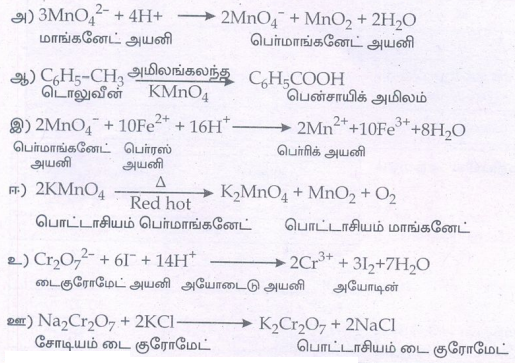
11. இடைச்செருகல் சேர்மங்கள் என்றால் என்ன?
• ஒரு உலோக அணிக்கோவைத் தளத்தில் உள்ள இடைச் செருகல் துளைகளில் ஹைட்ரஜன், போரான், கார்பன், அல்லது நைட்ரஜன் போன்ற சிறிய அணுக்கள் இடம் பெறுவதால் ஏற்படும் சேர்மங்கள் இடைச்செருகல் சேர்மங்கள் அல்லது உலோகக் கலவைகள் எனப்படுகின்றன.
• வேதி வினைக்கூறு விகித அடிப்படையில் அமையாத சேர்மங்களாகும். (எ.கா) TiC, ZrH1.92, Mn4N
12. Ti3+, Mn2+ அயனியில் காணப்படும் இணையாகாத எலக்ட்ரான்களின் எண்ணிக்கையைக் கண்டறிக. மேலும் அவைகளின் காந்ததிருப்பு திறன் மதிப்புகளைக் (µs) கண்டறிக.
விடை :

13. Ce4+ மற்றும் Co2+ன் எலக்ட்ரான் அமைப்புகளைத் தருக.
விடை :

அயனி : Ce4+ : CO2+
எலக்ட்ரான் அமைப்பு : [Xe] 4f05d06s0 : [Ar] 3d7 4s0
14. அணு எண் அதிகரிக்கும் போது முதல் இடைநிலைத் தனிம வரிசையில் முதல் பாதி தனிமங் களில் +2 ஆக்சிஜனேற்ற நிலை எவ்வாறு அதிக நிலைப்புத் தன்மை பெறுகிறது என விளக்குக.
• முதல் இடைநிலைத் தனிம வரிசையில் முதல் பாதி தனிமங்களில் +2 அயனிகள் உருவாக 4s ஆர்பிட்டாலில் உள்ள இரு எலக்ட்ரான்களை நீக்கினால் போதுமானது.
• இவ்வாறு நடைபெறும்போது 3d ஆர்பிட்டால்களில் சீராக எலக்ட்ரான்கள் நிரப்பப்பட்டு, காலி 3d ஆர்பிட்டால்களின் எண்ணிக்கை குறைகிறது. எனவே +2 அயனிகள் நிலைப்புத் தன்மை அதிகரிக்கிறது.
• இதனால் அணு எண் அதிகரிக்கும்போது முதல் இடைநிலைத் தனிம வரிசையில் முதல் பாதி தனிமங்களில் +2 ஆக்சிஜனேற்ற நிலை அதிக நிலைப்புத் தன்மை பெறுகிறது.
15. Fe3+ மற்றும் Fe2+ ல் எது அதிக நிலைப்புத் தன்மை உடையது. ஏன்?
விடை :

அயனி
எலக்ட்ரான் அமைப்பு
ஆர்பிட்டால்களின் தன்மை
நிலைப்புத் தன்மை
Fe3+
[Ar] 3d54s0
சரிபாதி நிரம்பிய dஆர்பிட்டால்கள்
நிலைப்புத் தன்மை அதிகம்
Fe2+
[Ar] 3d64s0
பகுதியளவு நிரம்பிய d-ஆர்பிட்டால்கள்
நிலைப்புத் தன்மை குறைவு
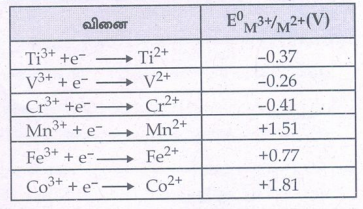
16. 3d வரிசையில் E°M3+/M2+ மதிப்பில் ஏற்படும் மாற்றங்களை விவரி.
• E0M3+/M2+ மதிப்புகள் M3+ மற்றும் M2+ அயனிகளுக்கிடையேயான ஒப்பீட்டு நிலைப்புத் தன்மையைத் தருகிறது.
• திட்ட ஒடுக்க மின்னழுத்த மதிப்புகள் கீழே அட்ட வணைப்படுத்தப்பட்டுள்ளன.
• டைட்டேனியம், வெனேடியம் மற்றும் குரோமியம் ஆகியவற்றின் எதிர்க்குறி ஒடுக்க மின்னழுத்த மதிப்புகளிலிருந்து, அவைகளில் உயர் ஆக்சிஜனேற்ற நிலையானது முன்னுரிமை பெற்றுள்ளதை அறியலாம்.
• நிலைப்புத் தன்மையுடைய Cr3+ அயனியை ஒடுக்கமடையச் செய்ய அதிக எதிர்க்குறி திட்ட ஒடுக்க மின்னழுத்த மதிப்பினை உடைய துத்தநாக உலோகம் (E0 = -0.76V) போன்ற வலிமை மிக்க ஒடுக்க காரணியை பயன்படுத்த வேண்டும்.
• Mn3+ / Mn2+ ன் அதிக E° மதிப்பிலிருந்து Mn2+ அயனியானது Mn3+ அயனியைக் காட்டிலும் அதிக நிலைப்புத் தன்மை உடையது என அறியலாம்.
• Fe3+ / Fe2+ன் குறைவான E° (+0.77V) மதிப்பிலிருந்து, வழக்கமான நிபந்தனைகளில், Fe3+ மற்றும் Fe2+ ஆகிய இரண்டும் நடைமுறையில் இருப்பதற்கான சாத்தியத்தை அறியலாம்.
• Mn லிருந்து Fe க்கு செல்லும் போது E° மதிப்பில் திடீர் குறைவு ஏற்படுகிறது. Mn3+ அயனி 3d4, எலக்ட்ரான் அமைப்பும் Mn2+ அயனி 3d5 எலக்ட்ரான் அமைப்பும் பெற்றுள்ளதே இதற்கு காரணம். சரிபாதி நிரம்பிய d- ஆர்பிட்டால் அதிக நிலைப்புத் தன்மையைப் பெறுவதால் Mn3+ன் ஒடுக்கம் மிகவும் சாத்தியமான ஒன்றாகும். (E0= +1.51V)
17. லாந்தனாய்டுகளையும், ஆக்டினாய்டுகளையும் ஒப்பிடுக.
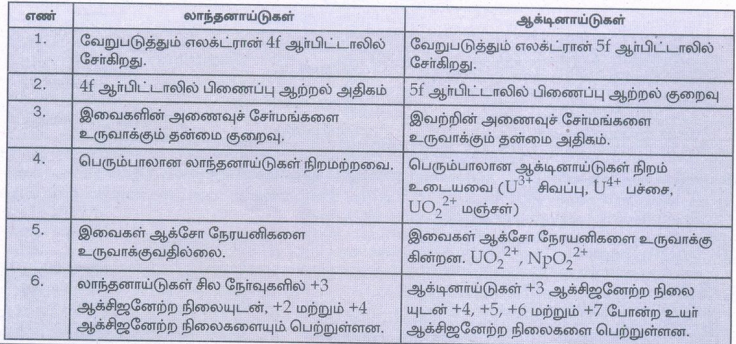
லாந்தனாய்டுகள்
1. வேறுபடுத்தும் எலக்ட்ரான் 4f ஆர்பிட்டாலில் சேர்கிறது
2. 4f ஆர்பிட்டாலில் பிணைப்பு ஆற்றல் அதிகம்
3. இவைகளின் அணைவுச் சேர்மங்களை உருவாக்கும் தன்மை குறைவு.
4. பெரும்பாலான லாந்தனாய்டுகள் நிறமற்றவை.
5. இவைகள் ஆக்சோ நேரயனிகளை உருவாக்குவதில்லை.
6. லாந்தனாய்டுகள் சில நேர்வுகளில் +3 ஆக்சிஜனேற்ற நிலையுடன், +2 மற்றும் +4 ஆக்சிஜனேற்ற நிலைகளையும் பெற்றுள்ளன.
ஆக்டினாய்டுகள்
1. வேறுபடுத்தும் எலக்ட்ரான் 5f ஆர்பிட்டாலில் சேர்கிறது.
2. 5f ஆர்பிட்டாலில் பிணைப்பு ஆற்றல் குறைவு
3. இவற்றின் அணைவுச் சேர்மங்களை உருவாக்கும் தன்மை அதிகம்.
4. பெரும்பாலான ஆக்டினாய்டுகள் நிறம் உடையவை (U3+ சிவப்பு, U4+பச்சை, UO2 2+மஞ்சள்)
5. இவைகள் ஆக்சோ நேரயனிகளை உருவாக்கு கின்றன. UO22+ ,Npo22+
6. ஆக்டினாய்டுகள் +3 ஆக்சிஜனேற்ற நிலை யுடன் +4, +5, +6 மற்றும் +7 போன்ற உயர் ஆக்சிஜனேற்ற நிலைகளை பெற்றுள்ளன.
18. Cr2+ ஆனது வலிமையான ஆக்சிஜனொடுக்கி ஆனால் Mn3+ ஆனது வலிமையான ஆக்சிஜனேற்றி விளக்குக.
• Cr3+/Cr2+ E° மதிப்பு =-0.41V
E° மதிப்பு எதிர்க்குறி ஆனதால் Cr2+ அயனி எளிதில் ஒரு எலக்ட்ரானை இழந்து ஆக்சிஜனேற்றத்திற்கு உட்பட்டு Cr'+ அயனியை வழங்கும். எனவே Cr3+ ஆனது வலிமையான ஆக்சிஜனொடுக்கி.
• Mn3+/Mn2+ E° மதிப்பு = +1.57V
E° மதிப்பு நேர்க்குறி ஆனதால் Mn3+ அயனி ஒரு எலக்ட்ரானை ஏற்று ஆக்சிஜன் ஒடுக்கத்திற்கு உட்பட்டு Mn2+ அயனியை வழங்கும். எனவே Mn3+ ஆனது வலிமையான ஆக்சிஜனேற்றி
19. முதல் இடைநிலை வரிசை தனிமங்களின் அயனியாக்கும் ஆற்றல் மதிப்புகளை ஒப்பிடுக.
• இடைநிலைத் தனிமங்கள் S மற்றும் p தொகுதித் தனிமங்களுக்கு இடைப்பட்ட அயனியாக்கும் ஆற்றலைப் பெற்றுள்ளன.
• இடைநிலை தனிம வரிசையில் இடமிருந்து வலமாகச் செல்லும் போது அயனியாக்கும் ஆற்றல் அதிகரிக்கின்றது.
• d ஆர்பிட்டாலில் எலக்ட்ரான்கள் நிரப்பப் படும்போது, அணுக்கருவின் மின்சுமையும் அதிகரிக்கிறது.
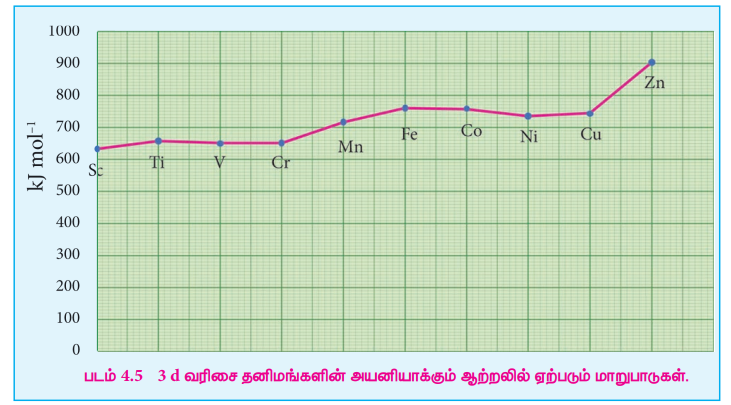
முதல் இடைநிலை வரிசை தனிமங்களின் அயனியாக்கும் ஆற்றலில் ஏற்படும் மாறுபாடுகள்
3d வரிசை தனிமங்கள் : அயனியாக்கும் ஆற்றல்
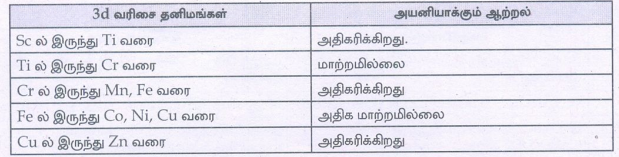
Sc ல் இருந்து Ti வரை - அதிகரிக்கிறது
Ti ல் இருந்து Cr வரை - மாற்றமில்லை
Cr ல் இருந்து Mn, Fe வரை - அதிகரிக்கிறது
Fe ல் இருந்து Co, Ni, Cu வரை - அதிக மாற்றமில்லை
Cu ல் இருந்து Zn வரை - அதிகரிக்கிறது
20. லாந்தனாய்டு குறுக்கத்தைவிட, ஆக்டினாய்டு வரிசையில், ஆக்டினாய்டு குறுக்கம் அதிகமாக உள்ளது. ஏன்?
4f-எலக்ட்ரான்களை விட 5f-எலக்ட்ரான்களின் திரை மறைப்பு குறைவு. எனவே லாந்தனாய்டு குறுக்கத்தைவிட ஆக்டினாய்டு குறுக்கம் அதிகமாக உள்ளது.
21. Lu(OH), மற்றும் La(OH)3 ல் அதிக காரத்தன்மை உடையது எது? ஏன்?

La(OH)3
1. La3+அயனியின் உருவளவு பெரியது
2. La-OH பிணைப்பின் அயனித்தன்மை அதிகம்
3. La-OH பிணைப்பின் சகப்பிணைப்புத் தன்மை குறைவு
4. எனவே La(OH)3 அதிக காரத்தன்மை உடையது.
Lu(OH)3
1. Lu3+அயனியின் உருவளவு சிறியது.
2. Lu-OH பிணைப்பின் அயனித்தன்மை குறைவு
3. Lu-OH பிணைப்பின் சகப்பிணைப்புத் தன்மை குறைவு
4. எனவே Lu(OH)3 குறைந்த காரத்தன்மை உடையது.
22. சீரியம் (II) ஐக் காட்டிலும் யுரோப்பியம் (II) அதிக நிலைப்புத் தன்மை உடையது. ஏன்?

அயனி
1. எலக்ட்ரான் அமைப்பு
2. ஆர்பிட்டால்களின் தன்மை
3. நிலைப்புத் தன்மை
சீரியம் (II)
1. [Xe] 4f15d16s0
2. பகுதியளவு நிரம்பிய நிலையற்ற d மற்றும் f ஆர்பிட்டால்கள்
3. நிலைப்புத் தன்மை குறைவு.
யுரோப்பியம் (II)
1. [Xe] 4f75d06s0
2. சரிபாதி நிரம்பிய நிலைத்த f - ஆர்பிட்டால்கள்
3. நிலைப்புத் தன்மை அதிகம்
23. சிர்கோனியம் மற்றும் ஹாப்னியம் ஒத்தப் பண்புகளைப் பெற்றுள்ளன. ஏன்?
லாந்தனாய்டு குறுக்கத்தின் காரணமாக சிர்கோனியம் மற்றும் ஹாப்னியம் ஏறத்தாழ ஒரே அணு ஆர மதிப்புகளை பெற்று ஒத்தப்பண்புகளைப் பெற்றுள்ளன.
24. Cr2+ அல்லது Fe2+ இவற்றுள் எது வலிமையான ஆக்சிஜனொடுக்கி?
• ஒரு உலோகத்தின் திட்ட மின் முனை மின்னழுத்த மதிப்பானது அதிக எதிர்க்குறி மதிப்பைப் பெற்றிருந்தால், அந்த உலோகமானது ஒரு வலிமையான ஒடுக்கும் காரணியாகும்.
• ஏனெனில் இவைகள் எலக்ட்ரான்களை எளிதில் இழக்கின்றன.
வினை : திட்ட ஒடுக்க மின்னழுத்தம் (E0) (V)
Cr2+ + 2e- → cr : -0.91
Fe2+ 2e- → Fe : -0.44
Cr2+ன் E0 மதிப்பு அதிக எதிர்க்குறி மதிப்பானதால், Cr2+ஒரு வலிமையான ஆக்சிஜன் ஒடுக்கி ஆகும்.
25. தாமிரத்தின் ‘E°M2+/M மதிப்பு நேர்க்குறி மதிப்புடையது. இதற்கான தகுந்த சாத்தியமான காரணத்தை கூறக.
E°M2+/M மதிப்பு ஒரு உலோகத்திற்கு பின்வரும் என்தால்பி மதிப்புகளைச் சார்ந்தது.
M(s) + ∆H(atom) → M(g) ( ∆H(atom) = பதங்கமாதல் என்தால்பி)
Mg + ∆HIE → M2+ (g) + 2e- (∆HIE = அயனியாக்கும் என்தால்பி)
M2+ (g) + H2O → M2+ (aq) + ∆H(Hyd) ( ∆H(Hyd) = நீரேற்ற என்தால்பி)
காப்பரின் பதங்கமாதல் என்தால்பி அதிகம் ஆனால் நீரேற்ற என்தால்பி குறைவு. எனவே E° Cu2+/Cu நேர்க்குறி மதிப்புடையது.
26. Ti2+, V3+, Ti4+, Cu+, Sc3+, Fe3+, Ni2+, மற்றும் Co3+, ஆகியனவற்றின் நீர்க்கரைசல்களில் நிறமுடையவை எவை?
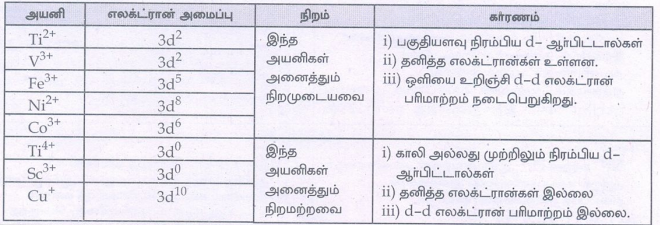
அயனி
Ti2+
V3+
Fe3+
Ni2+
CO3+
Ti4+
SC3+
CU+
எலக்ட்ரான் அமைப்பு
3d2
3d2
3d5
3d8
3d6
3d0
3d0
3d0
3d0
நிறம்
இந்த அயனிகள் அனைத்தும் நிறமுடையவை
காரணம்
1. பகுதியளவு நிரம்பிய d- ஆர்பிட்டால்கள்
2. தனித்த எலக்ட்ரான்கள் உள்ளன.
3. ஒளியை உறிஞ்சி d – d எலக்ட்ரான் பரிமாற்றம் நடைபெறுகிறது.
இந்த அயனிகள் அனைத்தும் நிறமற்றவை
காரணம்
1. காலி அல்லது முற்றிலும் நிரம்பிய d- ஆர்பிட்டால்கள்
2. தனித்த எலக்ட்ரான்கள் இல்லை
3. d-d எலக்ட்ரான் பரிமாற்றம் இல்லை .
27. 3d வரிசை தனிமங்களின் மாறுபடும் ஆக்சிஜனேற்ற நிலைகளை விளக்குக.
• முதல் இடைநிலை உலோகமான ஸ்காண்டியம் +3 ஆக்சிஜனேற்ற நிலையை மட்டுமே பெற்றுள்ளன.
• ஆனால், மற்ற இடைநிலைத் தனிமங்கள் மாறு படும் ஆக்சிஜனேற்ற நிலைகளைப் பெற்று உள்ளன.
• காரணம், இவைகளின் (n-1)d மற்றும் ns ஆர்பிட்டால்களுக்கு இடையே உள்ள ஆற்றல் வேறுபாடு மிகக் குறைவு.
• எனவே இவ்விரு ஆர்பிட்டால்களில் உள்ள எலக்ட்ரான்களை இழந்து அவை மாறுபடும் ஆக்சிஜனேற்ற நிலைகளைப் பெறுகின்றன. (எ.கா) Fe எலக்ட்ரான் அமைப்பு 3d64s2
Fe2+ எலக்ட்ரான் அமைப்பு 3d64s0
Fe3+ எலக்ட்ரான் அமைப்பு 3d54so
• d-வரிசைத் தொடரின் துவக்கத்தில் +3 ஆக்சிஜனேற்ற நிலையானது நிலைப்புத் தன்மையுடன் உள்ளது.
• ஆனால், தொடரின் இறுதியில் +2 ஆக்சிஜனேற்ற நிலையானது நிலைப்புத் தன்மையைப் பெறுகிறது.
• எலக்ட்ரான்களின் எண்ணிக்கை அதிகரிக்கும் போது, ஆக்சிஜனேற்ற நிலைகளின் எண்ணிக்கையும் அதிகரிக்கிறது.
• இணையாகும் எலக்ட்ரான்களின் எண்ணிக்கை அதிகரிக்கும்போது, ஆக்சிஜனேற்ற நிலைகளின் எண்ணிக்கை குறைகிறது.
• எனவே முதல் மற்றும் கடைசி தனிமங்கள் குறைவான ஆக்சிஜனேற்ற நிலைகளையும், மையப்பகுதியின் அருகிலுள்ள தனிமங்கள் அதிக எண்ணிக்கையிலான ஆக்சிஜனேற்ற நிலைகளையும் பெற்றுள்ளன.

எ.கா :
ஸ்காண்டியம் - +3
மாங்கனிஸ் - +2 முதல் +7 வரை
தாமிரம் - +1, +2
• 3d வரிசை உலோகங்களின் பல்வேறு ஆக்சிஜனேற்ற நிலைகளின் ஒப்பீட்டு நிலைப்புத் தன்மையை அவற்றின் சரி பாதியளவு மற்றும் முழுவதும் நிரம்பிய d ஆர்பிட்டால் களின் நிலைப்புத் தன்மையோடு தொடர்புபடுத்தி விளக்கலாம்.
• (எ.கா) Mn2+ சரிபாதி நிரம்பிய (3d5) ஆர்பிட்டால் களைக் கொண்டுள்ளதால் நிலைப்புத்தன்மை அதிகம். Mn4+ பகுதியளவு நிரம்பிய (3d3) ஆர் பிட்டால் களைக் கொண்டுள்ளதால் நிலைப்புத் தன்மை குறைவு.
28. 3d வரிசையில் எத்தனிமம் +1 ஆக்சிஜனேற்ற நிலையைக் கொண்டுள்ளது. ஏன்?
• 3d-வரிசையில் தாமிரம் +1 ஆக்சிஜனேற்ற நிலையைக் கொண்டுள்ளது.
• Cu+ அயனியின் எலக்ட்ரான் அமைப்பு 3104s0
• Cu+ அயனி முற்றிலும் நிரம்பிய நிலைத்த d ஆர்பிட்டால்களை பெற்றுள்ளதால், தாமிரம் +1 ஆக்சிஜனேற்ற நிலையைக் கொண்டுள்ளது.
29. துத்தநாகத்தைக் காட்டிலும், குரோமியத்தின் முதல் அயனியாக்கும் ஆற்றல் மதிப்பு குறைவு. ஏன்?
• குரோமியம் அணுவின் எலக்ட்ரான் அமைப்பு [Ar]3d54s1. ஒரு எலக்ட்ரானை இழப்பதன் மூலம் குரோமியம் சரிபாதி நிரம்பிய நிலைத்த எலக்ட்ரான் அமைப்பினை பெறுகிறது.
• எனவே குரோமியம் எளிதில் ஒரு எலக்ட்ரானை இழக்கிறது. அதனால் குரோமியத்தின் அயனியாக்கும் ஆற்றல் குறைவு.
• துத்தநாகம் அணுவின் எலக்ட்ரான் அமைப்பு [Ar]3d104s2. இது நிலைத்த எலக்ட்ரான் அமைப்பாகும்.
• முழுவதும் நிரம்பிய S ஆர்பிட்டாலில் இருந்து எளிதில் ஒரு எலக்ட்ரானை துத்தநாகம் இழக்காது.
• எனவே S எலக்ட்ரானை நீக்க அதிக ஆற்றல் தேவை. அதனால் துத்தநாகத்தின் அயனியாக்கும் ஆற்றல் அதிகம்.
30. இடைநிலை தனிமங்கள் அதிக உருகு நிலையைக் கொண்டுள்ளன. ஏன்?
உலோகப்பிணைப்பிற்கு தேவையான தனித்த d-எலக்ட்ரான்களைப் பெற்றிருப்பதால், இடைநிலைத் தனிமங்கள் அதிக உருகு நிலையைக் கொண்டுள்ளன.
III. தன் மதிப்பீடு
1. Ni4+ மற்றும் Pt4+ ஆகியனவற்றின் அயனியாக்கும் ஆற்றல் மதிப்புகளிலிருந்து அவைகளின் நிலைப்புத் தன்மையினை ஒப்பிடுக.
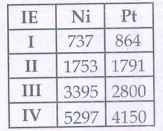
அயனியாக்கும் ஆற்றல் மதிப்புகளிலிருந்து வெப்ப இயக்கவியல் நிலைப்புத் தன்மையைத் தீர்மானிக்க இயலும்.
Ni4+ - IE3+ IE4 = (3395 + 5297)
= 8692 kJ mol-1
Pt4+- IE3 + IE4 = (2800 + 4150)
= 6950 kJ mol-1
எனவே Pt4+ உடன் ஒப்பிடும் போது Ni4+ உருவாக அதிக ஆற்றல் தேவைப்படுகிறது. இதனால் Pt (IV) சேர்மங்களை காட்டிலும் Ni(IV) சேர்மங்கள் அதிக வெப்ப இயக்கவியல் நிலைப்புத் தன்மையினை பெற்றுள்ளன.
2. இரும்பினைப் பொருத்த வரையில் +3 ஆக்சிஜனேற்ற நிலையானது +2 ஆக்சிஜனேற்ற நிலையை விட அதிக நிலைப்புத் தன்மை உடையது. ஆனால், மாங்கனீசைப் பொருத்த வரையில் இதன் மறுதலை யானது உண்மை . ஏன்?
இரும்பின் அணு எண் = 26
Fe-ன் எலக்ட்ரான் அமைப்பு = [Ar] 3d6 4s2
இரண்டு எலக்ட்ரான்கள் இழந்த நிலையில் (Fe2+) = [Ar] 3d6
மூன்று எலக்ட்ரான்கள் இழந்த நிலையில் (Fe3+) = [Ar] 3d6
இரும்பின் +3 ஆக்ஸிஜனேற்ற நிலையில் பாதி நிரம்பிய d ஆர்பிட்டால் எலக்ட்ரான் அமைப்பைப் பெறுவதால் இது +2 நிலையை விட +3 அதிக நிலைப்புத்தன்மை உடையது.
• Mn- ன் அணு எண் = 25
Mn-ன் எலக்ட்ரான் அமைப்பு = [Ar] 3d5 4s2
இரண்டு எலக்ட்ரான்கள் இழந்த நிலையில் = [Ar] 3d5
மூன்று எலக்ட்ரான்கள் இழந்த நிலையில் = [Ar] 3d4
மாங்கனீசின் +2 நிலையானது பாதி நிரம்பிய d ஆர்பிட்டால் எலக்ட்ரான் அமைப்பைப் பெறுவதால் மாங்கனீஸ் +3 நிலையை விட +2 நிலை அதிக நிலைப்புத்தன்மை உடையது.