புத்தக வினாக்கள் மற்றும் முக்கிய கேள்வி பதில்கள் | வேதியியல் - p தொகுதி தனிமங்கள் - I : பின்வருவனவற்றிற்கு விடையளி | 12th Chemistry : UNIT 2 : p-Block Elements-I
12 ஆம் வகுப்பு வேதியியல் : அத்தியாயம் 2 : p தொகுதி தனிமங்கள் - I
p தொகுதி தனிமங்கள் - I : பின்வருவனவற்றிற்கு விடையளி
வேதியியல் : p தொகுதி தனிமங்கள் - I
II. பின்வருவனவற்றிற்கு விடையளி
1. ρ தொகுதி தனிமங்களில் முதல் தனிமத்தின் முரண்பட்ட பண்புகள் பற்றி சிறுகுறிப்பு வரைக.
ρ-தொகுதி தனிமங்களில், ஒவ்வொரு தொகுதியிலும் உள்ள முதல் தனிமமானது, அத்தொகுதியின் மற்ற தனிமங்களிலிருந்து வேறுபடுகின்றன. காரணம் முதல் தனிமத்தின்
1. சிறிய உருவளவு
2. அதிக அயனியாக்கும் என்தால்பி மற்றும் எலக்ட்ரான் கவர்திறன்
3. இணைதிறன் கூட்டில் d ஆர்பிட்டால்கள் இல்லாதிருத்தல்.
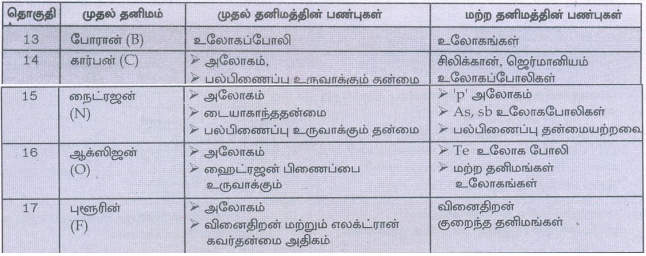
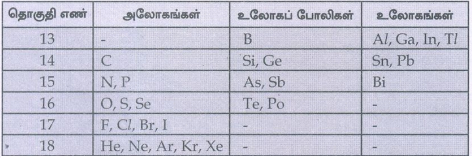
தொகுதி - 13
முதல் தனிமம் : போரான் (B)
முதல் தனிமத்தின் பண்புகள் : உலோகப்போலி
மற்ற தனிமத்தின் பண்புகள் : உலோகங்கள்
தொகுதி - 14
முதல் தனிமம் : கார்பன் (C)
முதல் தனிமத்தின் பண்புகள் : அலோகம், பல்பிணைப்பு உருவாக்கும்
மற்ற தனிமத்தின் பண்புகள் : சிலிக்கான், ஜெர்மானியம் உலோகப்போலிகள்
தொகுதி - 15
முதல் தனிமம் : நைட்ரஜன் (N)
முதல் தனிமத்தின் பண்புகள் : • அலோகம் • டையாகாந்ததன்மை • பல்பிணைப்பு உருவாக்கும் தன்மை
மற்ற தனிமத்தின் பண்புகள் : • ' ρ' அலோகம் • As, sb உலோகபோலிகள் • பல்பிணைப்பு தன்மையற்றவை
தொகுதி – 16
முதல் தனிமம் : ஆக்ஸிஜன் (O)
முதல் தனிமத்தின் பண்புகள் : • அலோகம் • ஹைட்ரஜன் பிணைப்பை உருவாக்கும்
மற்ற தனிமத்தின் பண்புகள் : • Te உலோக போலி • மற்ற தனிமங்கள் உலோகங்கள்
தொகுதி – 17
முதல் தனிமம் : புளூரின் (F)
முதல் தனிமத்தின் பண்புகள் : • அலோகம் வினைதிறன் மற்றும் • எலக்ட்ரான் கவர்தன்மை அதிகம்
மற்ற தனிமத்தின் பண்புகள் : • வினைதிறன் குறைந்த தனிமங்கள்
2. கார்பனை உதாரணமாகக் கொண்டு p தொகுதி தனிமங்களில் காணப்படும் புறவேற்றுமை வடிவங் களை விளக்குக.
• சில தனிமங்கள் ஒரே இயற் நிலைமையில், ஒன்றுக்கு மேற்பட்ட படிக அல்லது மூலக்கூறு வடிவங்களில் காணப்படுகின்றன.
• இந்நிகழ்வு புறவேற்றுமை வடிவத்துவம் அல்லது அல்லோட்ரோபிசம் எனப்படுகிறது.
• இத்தகைய வெவ்வேறு வடிவங்கள் பற வேற்றுமை வடிவங்கள் எனப்படுகின்றன. எ.கா: கார்பனின் புறவேற்றுமை வடிவங்கள் - வைரம், கிராஃபைட், கிராஃபின், ஃபுல்லரீன், கார்பன் நுண் குழாய்கள்.
3. போரான் ஹைட்ரஜனுடன் நேரடியாக வினை புரிவதில்லை. BF3 யிலிருந்து டைபோரேன்னைத் தயாரிக்கும் ஏதேனும் ஒரு முறையினைத் தருக.
• போரான் ட்ரை புளுரைடு வாயுவை 450 K வெப்பநிலையில் சோடியம் ஹைட்ரைடுடன் வினைபடுத்தும் போது டைபோரேன் உருவாகிறது.
• வெப்பச் சிதைவைத் தடுக்க டைபோரேன் உடனடியாக நீக்கப்படுகிறது.
2BF3 + 6NaH __ 450 K→ B2H6 + 6NaF
4. போராக்ஸின் பயன்களைத் தருக.
1. நிறமுள்ள உலோக அயனிகளைக் கண்டறிவதில் போராக்ஸ் பயன்படுகிறது. (போராக்ஸ் மணி சோதனை)
2. கண் கண்ணாடி, போரோ சிலிகேட் கண்ணாடி, எனாமல் மற்றும் பளபளப்பான மண் பாண்டங்கள் தயாரிக்க பயன்படுகிறது.
3. உலோகவியலில் இளக்கியாக பயன்படுகிறது.
4. உணவு பதப்படுத்தியாக செயலாற்றும் தன்மையுடையது.
5. சங்கிலித் தொடராக்கம் என்றால் என்ன? கார்பனின் சங்கிலித் தொடராக்கப் பண்பினைப் பற்றி குறிப்பு எழுதுக.
• சங்கிலித் தொடராக்கம் என்பது, ஒரு தனிமத்தின் அணுச் சங்கிலி உருவாக்கும் திறன் ஆகும்.
• சங்கிலித் தொடராக்கத்திற்கு நிபந்தனைகள்:
i. தனிமத்தின் இணைதிறன் இரண்டு அல்லது அதற்கு அதிகமாக இருக்க வேண்டும்.
ii. தனிமம் அதன் அணுவுடனே சுய பிணைப்பை ஏற்படுத்தும் திறனைக் கொண்டிருக்க வேண்டும்.
iii. சுய பிணைப்பின் வலிமை, மற்ற தனிமங்களுடன் ஏற்படும் பிணைப்புகளைப் போல வலிமையாக இருக்க வேண்டும்.
iv. மற்ற மூலக்கூறுகளுடன், சங்கிலித் தொடர் மூலக் கூறுகள் வேதிவினை மந்தத் தன்மை கொண்டிருத்தல் வேண்டும்.
• மேற்கண்ட அனைத்து பண்ப,களையம் பெற்றுள்ளதால் கார்பன் சங்கிலித் தொடராக்கும் திறனைப் பெற்றுள்ளது.
• கார்பன் தங்களுக்குள் பிணைப்பை ஏற்படுத்தும் தன்மையையும் மற்றும் H, O, N, S, ஹேலஜன் போன்ற பிற அணுக்களுடன் இணைந்து பல சேர்மங்களை உருவாக்கும் இயல்பினையும் பெற்றுள்ளது.
6. ஃபிஷ்ஷர்-ட்ரோப்ஷ் முறை பற்றி சிறுகுறிப்பு வரைக.
பிஷ்ஷர்-ட்ரோப்ஷ் தொகுப்பு:
வினைபடுபொருள் : கார்பன் மோனாக்சைடு, ஹைட்ரஜன்
அழுத்தம் : 50 atm க்கு குறைவு
வெப்பநிலை : 500-700 K
வினைவேகமாற்றி : உலோகம்
வினை விளை பொருள் : நிறைவுற்ற மற்றும் நிறைவுறா ஹைட்ரோ கார்பன்கள்
nCo + (2n+1) H2 →CnH2n+2 +nH2O
nCO+ 2n H2 →CnH2n + nH2O
7. CO மற்றும் CO2 ன் வடிவங்களைத் தருக.CO வின் வடிவமைப்பு:
CO, வின் வடிவமைப்பு: -
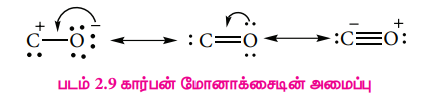
CO2 வின் வடிவமைப்பு:
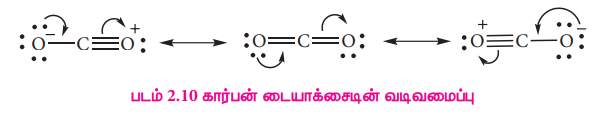
8. சிலிக்கோன்களின் பயன்களைத் தருக.
சிலிக்கோன்கள்,
1. குறைந்த வெப்பநிலை உயவுப் பொருளாக பயன்படுகின்றன.
2. வெற்றிட பம்புகள், உயர் வெப்பநிலை எண்ணெய்த் தொட்டியில் பயன்படுகின்றன.
3. நீர் வெறுக்கும் ஆடைகள் தயாரித்தலில் பயன்படுகின்றன.
4. மின் மோட்டார்கள் மற்றும் வீட்டு உபயோக பொருட்களில் மின்காப்பு பொருளாக பயன்படு கின்றன.
5. சிலிக்கோன்கள் சேர்க்கப்பட்ட பெயிண்ட் மற்றும் எனாமல் அதிக வெப்பநிலை, சூரிய ஒளி, ஈரப்பதம் மற்றும் வேதிப் பொருட்கள் தாக்குதல் ஆகியவற்றை தாக்குப்பிடிக்கின்றன.
9. AlCl3 ஆனது லூயி அமிலமாக செயல்படுகிறது. இக்கூற்றினை நிறுவுக.
• அலுமினியம் வெளிக்கூட்டில் மூன்று எலக்ட்ரான் களை மட்டுமே பெற்றுள்ளது.
• AlCl3உருவாகும் போது இம்மூன்று எலக்ட்ரான் களும் குளோரினுடன் இணைந்து மூன்று சகப் பிணைப்புகளை உருவாக்குகின்றன.
• எனவே AlCl3 மூலக்கூறில் அலுமினியத்தின் வெளிக்கூட்டில் மொத்தம் ஆறு எலக்ட்ரான்கள் மட்டுமே உள்ளன.
• எண்ம விதிப்படி அலுமினியத்தின் வெளிக் கூட்டில் இரண்டு எலக்ட்ரான்கள் குறைவாக உள்ளதால், AlCl3 ஒரு எலக்ட்ரான் குறை சேர்மமாகும்.
• எனவே, AlCl3 மற்ற சேர்மங்களிலிருந்து ஒரு ஜோடி எலக்ட்ரானை ஏற்கும் தன்மையைக் கொண்டுள்ளது.
• ஆகவே, AlCl3 ஆனது லூயி அமிலமாக செயல் படுகிறது. அம்மோனியா, பாஸ்பின் கார்பனைல் குளோரைடு சேர்க்கை சேர்மங்களை உருவாக்குகின்றன.
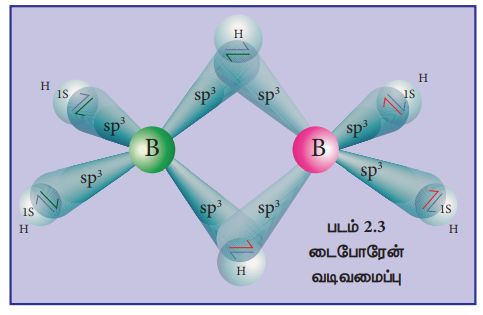
10. டைபோரேனின் வடிவமைப்பினை விவரிக்க.
• டை போரேனில் இரண்டு BH2 அலகுகள் இரண்டு ஹைட்ரஜன் பாலங்களால் பிணைக்கப் பட்டுள்ளன. எனவே இது எட்டு B-H பிணைப்புகளைக் கொண்டுள்ளது.
• டைபோரேன் 12 இணைதிற எலக்ட்ரான்களை மட்டுமே கொண்டுள்ளது. இவை இயல்பான சகப்பிணைப்பிற்கு போதுமானதாக இல்லை.
• நான்கு முனைய (terminal) B-H பிணைப்புகள் இயல்பான சகப்பிணைப்புகளாகும். (2c - 2e பிணைப்பு) (மொத்தம் 8 எலக்ட்ரான்கள்)
• மீதமுள்ள நான்கு எலக்ட்ரான்கள் பால பிணைப்புகளுக்கு (bridged bonds) பயன்பட வேண்டும். அதாவது இரண்டு 3 மைய B-H-B பிணைப்பகள் ஒவ்வொன்றும் இரண்டு எலக்ட்ரான்களை பயன்படுத்திக் கொள்கின்றன.
• எனவே இவை 3c - 28 பிணைப்புகளாகும்.
• பிணைப்பு பாலங்களிலுள்ள ஹைட்ரஜன் அணுக்கள் ஒரே தளத்தில் அமைந்துள்ளன.
• டை போரேனில் போரான் அணு sp3 இனக் கலப்பில் உள்ளது.
• நான்கு sp3 இனக்கலப்பு ஆர்பிட்டால்களில் மூன்றில் ஒற்றை எலக்ட்ரானும், நான்காம் ஆர்பிட்டால் காலியாகவும் உள்ளன.
• ஒவ்வொரு போரான் அணுவிலிருந்தும், இரண்டு பாதி நிரம்பிய இனக்கலப்பு ஆர்பிட்டால்கள், இரண்டு ஹைட்ரஜன் அணுக்களுடன் மேற் பொருத்தி நான்கு 2c - 2e முனைய பிணைப்புகளை உருவாக்குகின்றன.
• இந்நிலையில் ஒவ்வொரு போரான் அணுவிலும் ஒரு காலி ஆர்பிட்டாலும், ஒரு பாதி நிரம்பிய இனக்கலப்பு ஆர்பிட்டாலும் காணப்படுகின்றன.
• ஒரு போரான் அணு வின் பாதி நிரம்பிய இனக்கலப்பு ஆர்பிட்டாலும், மற்றொரு போரான் அணுவின் காலியாக உள்ள இனக்கலப்பு ஆர்பிட்டாலும், ஹைட்ரஜன் அணுவின் பாதி நிரம்பிய 1s ஆர்பிட்டாலும் ஒன்றோடொன்று மேற்பொருந்தி B-H-B பிணைப்பு (3c - 2e பிணைப்பு) உருவாகிறது
11. டைபோரேன் வடிவமைப்பு ஹைட்ரோ போரோ ஏற்ற வினை பற்றி குறிப்பு வரைக.
• அறை வெப்பநிலையில், ஈதர் ஊடகத்தில் போரேன் ஆல்கீன்கள் மற்றும் ஆல்கைன் களுடன் சேர்க்கை வினைக்கு உட்படுகிறது.
• இவ்வினை ஹைட்ரோ போரோனேற்றம் எனப்படுகிறது
• இது தொகுப்பு கரிம வேதியியலில், குறிப்பாக எதிர் மார்கோனிகாவ் சேர்க்கை வினைகளில் அதிகம் பயன்படுகிறது.
B2H6 + 6 RCH = CHR → 2B (RCH-CH2R)3
12. பின்வருவனவற்றிற்கு ஒரு உதாரணம் தருக.
அ) ஐகோசோஜன்
ஆ) டெட்ராஜன்.
இ) நிக்டோஜன்
ஈ) சால்கோஜன்
தொகுதி பெயர் : உதாரணம்
i. ஐகோசோஜன் - போரான்
ii. டெட்ராஜன் - கார்பன்
iii. நிக்டோஜன் - நைட்ரஜன்
iv. சால்கோஜன் - ஆக்சிஜன்
13. p-தொகுதி தனிமங்களின் உலோகப் பண்பினைப் பற்றி குறிப்பு வரைக.
• ஒரு தனிமம் எலக்ட்ரான்களை இழந்து அதன் நேர்மின் அயனிகளை உருவாக்கும் திறன், நேர்மின் தன்மை அல்லது உலோகத் தன்மை எனப்படும்.
• இப்பண்பு அயனியாக்கும் ஆற்றலைப் பொறுத்தது.
• பொதுவாக ஒரு தொகுதியில் மேலிருந்து கீழாக செல்லும் போது அயனியாக்கும் ஆற்றல் மதிப்பு குறைகிறது. எனவே உலோகப் பண்பு அதிகரிக்கிறது.
• ρ -தொகுதியில் இடது புறம் கீழ்பகுதியில் உள்ள தனிமங்கள் உலோகங்கள் ஆகும்.
• ρ -தொகுதியில் வலது புறம் மேல் பகுதியில் உள்ள தனிமங்கள் அலோகங்கள் ஆகும்,
14. பின்வரும் வினைகளை பூர்த்தி செய்க.
அ) B(OH)3 + NH3 →
ஆ) Na2B407 + H2SO4 + H2O →
இ) B2H6+ 2NaOH +-2H2O →
ஈ) B2H6 + CH3O →
உ) BF3 + 9H2O →
ஊ) HCOOH + H2SO4 →
எ) SiCI4 + NH3 →
ஏ) SiCl4 + C2H5OH →
ஐ) B + NaOH →
ஒ) 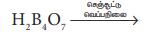
விடைகள் :
அ) B(OH)3 + NH3 800-1200K, BN + 3H,O போரான் நைட்ரைடு

ஆ) Na2B407 + H2SO4 + 5H2O → Na2SO4 + 4H3BO3
ஆர்த்தோ போரிக் அமிலம்
இ) B2H6+ 2NaOH + 2H2O → 2NaBO2+ 6H2
சோடியம் மெட்டா போரேட்
ஈ) B2H6 + 6CH3OH → 2B(OCH3)3 + 6H2
மெத்தில் போரேட்
உ) 4BF3+ 3H2O→H2BO3 + 3HBF4
ஹைட்ரோ ப்ளுரோ போரிக் அமிலம்
ஊ) HCOOH + H2SO4 → CO+ H2O + H2SO4
எ) 
'ஏ) SiC14 + 4C2H5OH → Si(OC2H5)4 + 4HCI
டெட்ரா ஈத்தாக்சி சிலேன்
ஐ) 2B + 6NaOH →2Na3BO3 + 3H2
சோடியம் போரேட்
ஒ) 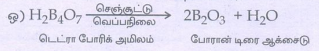
15. போரேட் உப்பை எவ்வாறு கண்டறிவாய்?
• அடர் கந்தக அமிலத்தின் முன்னிலையில், போரிக் அமிலம் அல்லது போரேட் உப்பை எத்தில் ஆல்கஹாலுடன் வெப்பப்படுத்தும்போது ட்ரைல் எத்தில் போரேட் எனும் எஸ்டர் உருவாகிறது.
• இந்த எஸ்டரின் ஆவி பச்சை நிறச் சுடருடன் எரிகிறது.
• இது போரேட்டை கண்டறிய உதவும் வினையாகும்.
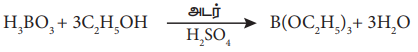
16. ஜியோலைட்டுகள் பற்றி குறிப்பு வரைக.
• ஜியோலைட்டுகள் என்பவை அலுமினியம், சிலிக்கான் மற்றும் ஆக்ஸிஜன் ஆகியவற்றை ஒழுங்கான முப்பரிமாண கட்டுமான அமைப்பில் கொண்டுள்ள முப்பரிமாண படிகத் திண்மங்களாகும்.
• இவை நீரேறிய சோடியம் அலுமினோ சிலிக் கேட்டுகளாகும்.
• பொதுவான வாய்ப்பாடு
Na2O.(Al2O3).x(SiO2).y(H2O) (x=2 முதல் 10; y = 2 முதல் 6 வரை)
• ஜியோலைட்டுகள் நுண்துளை அமைப்பைக் கொண்டுள்ளன.
• இத்துளைகளில் ஒற்றை நேர்மின் சுமை கொண்ட சோடியம் அயனிகளும், நீர் மூலக்கூறுகளும் தளர்வாக இருத்தி வைக்கப்பட்டுள்ளன.
• பங்கிடப்பட்ட ஆக்சிஜன் அணுக்களின் மூலம் Si மற்றும் A1 அணுக்கள் நான்முகி அமைப்பில் ஒன்றுடன் ஒன்று ஒருங்கிணைக்கப்பட்டுள்ளன.
• ஜியோலைட்டுகள், களிமண் கனிமத்தை ஒத்து உள்ளன, ஆனால் அவற்றின் படிக அமைப்பில் வேறுபடுகின்றன.
• ஒன்றுடன் ஒன்று இணைக்கப்பட்ட தடங்கள் மற்றும் கூடுகளைக் கொண்ட, தேன்கூட்டு அமைப்பை ஒத்த முப்பரிமாண படிக அமைப்பை ஜியோலைட்டுகள் பெற்றுள்ளன.
• ஜியோலைட்டு கட்டமைப்ப, நகராமல் இறுக்கமாக உள்ளபோதும், நுண் துளைகளின் வழியாக நீர் மூலக்கூறுகள் உள்ளேயும், வெளி யேயும் மிக எளிதாக நகர்கின்றன.
• ஏறத்தாழ ஒரே சீராக அமைந்திருக்கும் நுண்துளைகளின் உருவளவு இக்கட்டமைப்பின் மற்றொரு சிறப்பம்சமாகும். இது இப்படிகத்தை மூலக்கூறு சல்லடை போல் செயல்பட அனுமதிக்கிறது.
• ஜியோலைட்டுகள் நீரின் நிரந்தரக் கடினத் தன்மையை நீக்க பயன்படுகின்றன.
17. போரிக் அமிலத்தை எவ்வாறு போரான் நைட்ரைடு ஆக மாற்றுவாய்?
800 - 1200 K வெப்பநிலையில் அம்மோனியா முன்னிலையில் யூரியாவுடன் போரிக் அமிலத்தை உருக்கும் போது போரான் நைட்ரைடு உருவாகிறது.

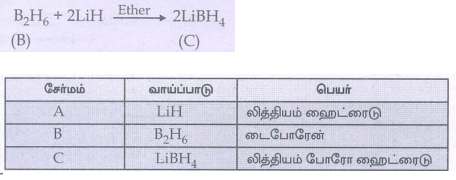
18. இரண்டாம் வரிசை கார உலோகம் (A) ஆனது (B) என்ற போரானின் சேர்மத்துடன் வினைபுரிந்து (C) என்ற ஒடுக்கும் காரணியினைத் தருகிறது. (A),(B) மற்றும் (C)ஐக் கண்டறிக.
• இரண்டாம் வரிசை கார உலோகத்தின் ஹைட்ரைடு (A) என்பது LiH ஆகம்.
• (A) லித்தியம் ஹைட்ரைடு, போரானின் சேர்மம் டைபோரேனுடன் (B) வினைபுரிந்து ஒடுக்கும் காரணி லித்தியம் போரோ ஹைட்ரைடைத் தருகிறது.
எனவே சேர்மம் (B) ஆனது டைபோரேன் மற்றும் சேர்மம் (C) ஆனது லித்தியம் போரோ ஹைட்ரைடு ஆகும்.
19. நான்காவது வரிசை கார உலோகத்தைக் கொண்டுள்ள (A) என்ற இரட்டை உப்பை 500 K வெப்பநிலைக்கு வெப்பப்படுத்த (B) கிடைக்கிறது. (B) ன் நீர்க்கரைசல் Bacl2 உடன் வெண்மை நிற வீழ்படிவைத் தருகிறது. மேலும் அலிசரினுடன் சிவப்பு நிற சேர்மத்தைத் தருகிறது. (A) மற்றும் (B) ஐக் கண்டறிக.
• நான்காவது வரிசை கார உலோகத்தைக் கொண்டுள்ள இரட்டை உப்பு (A) என்பது பொட்டாஷ் படிகாரம் ஆகும். (A) என்பது K2SO4.Al2 (SO4)3.24H2O
• பொட்டாஷ் படிகாரத்தை (A) 500 K வெப்பநிலைக்கு சூடுபடுத்தும் போது படிக நீரை இழந்து எரிக்கப்பட்ட படிகாரம் (B) ஆக உருப்பெருக்கம் அடைகிறது.
ஃ(B) என்பது எரிக்கப்பட்ட படிகாரம் K2SO4.Al2(SO4)3

20. CO ஒரு ஒடுக்கும் காரணி. ஒரு எடுத்துக்காட்டுடன் இக்கூற்றை நிறுவுக.
• CO ஒரு வலிமை மிகுந்த ஒடுக்கும் காரணி.
• அது உலோக ஆக்சைடுகளை, உலோகமாக ஒடுக்குகிறது.
3CO+ Fe2O3 → 2Fe + 3CO2
தன்மதிப்பீடு
1. 18 வது தொகுதி தனிமங்கள் மந்த வாயுக்கள் என அழைக்கப்படுகின்றன. ஏன்? 18 வது தொகுதி தனிமங்களின் பொதுவான எலக்ட்ரான் அமைப்பை எழுதுக,
• 18 வது தொகுதி தனிமங்கள் அனைத்தும் வாயுக்கள். பொதுவான எலக்ட்ரான் அமைப்பு ns2-np6.
• முற்றிலும் நிரம்பிய நிலைத்த எலக்ட்ரான் அமைப்பினைப் பெற்றுள்ளதால் இவற்றின் நிலைப்புத் தன்மை அதிகம், வினைத்திறன் மிகக் குறைவு.
• எனவே இவை மந்த வாயுக்கள் என அழைக்கப்படுகின்றன.