புத்தக வினாக்கள் மற்றும் முக்கிய கேள்வி பதில்கள் | வேதியியல் - p தொகுதி தனிமங்கள் - II : பின்வரும் வினாக்களுக்கு விடையளிக்க | 12th Chemistry : UNIT 3 : p-Block Elements-II
12 ஆம் வகுப்பு வேதியியல் : அத்தியாயம் 3 : p தொகுதி தனிமங்கள் - II
p தொகுதி தனிமங்கள் - II : பின்வரும் வினாக்களுக்கு விடையளிக்க
வேதியியல் : p தொகுதி தனிமங்கள் - II
II. பின்வரும் வினாக்களுக்கு விடையளிக்க
1. மந்த இணை விளைவு என்றால் என்ன?
• p-தொகுதியில் மேலிருந்து கீழாகச் செல்லும் போது ns2 எலக்ட்ரான் மந்தத் தன்மை அடைந்து, வேதிப்பிணைப்பில் ஈடுவடுவதில்லை.
• np எலக்ட்ரான்கள் மட்டுமே வேதிப்பிணைப்பில் ஈடுபடுகின்றன.
• இதுவே மந்த இணை விளைவு எனப்படும்.
2. சால்கோஜன்கள் p-தொகுதி தனிமங்களாகும் காரணம் தருக.
• சால்கோஜன்கள் p-தொகுதி தனிமங்களாகும். காரணம் இத்தனிமங்களின் கடைசி எலக்ட்ரான் p- ஆர்பிட்டாலில் நிரப்பப்படுகின்றன.
• இத்தனிமங்களின் பொதுவான எலக்ட்ரான் அமைப்பு ns2 np4.
3. ஏன் ஃபுளுரின் எப்போதும் -1 ஆக்சிஜனேற்ற நிலையினைப் பெற்றுள்ளது? விளக்குக.
• ஃப்ளூரின் அதிக எலக்ட்ரான் கவர் திறன் கொண்ட தனிமம், எனவே ஃப்ளுரின் எப்போதும்-1 ஆக்சிஜனேற்ற நிலையினைப் பெற்றுள்ளது.
• d - ஆர்பிட்டால்கள் இல்லாத காரணத்தால் ஃப்ளுரின் நேர் ஆக்சிஜனேற்ற நிலையை பெறுவதில்லை .
4. பின் வரும் சேர்மங்களில் ஹாலஜன்களின் ஆக்சிஜனேற்ற நிலையினைக் குறிப்பிடுக.
அ) OF2
ஆ) O2F2
இ) Cl2O3
ஈ) I2O4
ஃப்ளுரின் – 1 ஆக்சிஜனேற்ற நிலையை மட்டுமே பெற்றுள்ளது. எனவே ஃப்ளுரின் ஆக்சிஜனேற்ற நிலை
அ) OF2 ல் -1
ஆ) O2F2ல் -1
இ) Cl2O3
2x + 3(-2) = 0
2x – 6 = 0
2x = + 6 Cl203 ல் CI ன் ஆக்சிஜனேற்ற நிலை +3
x = + 3
ஈ) 12O4
2x + 4 (-2) =0
2x =8 = 0
2x = +8 I2O4ல் I ன் ஆக்சிஜனேற்ற நிலை +4
x = + 4
சேர்மம் ஆக்ஸிஜனேற்ற நிலை
OF2 : -1
O2F2 : -1
Cl2O3 : +3
I2,O4 : +4
5. ஹாலஜனிடைச் சேர்மங்கள் என்றால் என்ன? எடுத்துக்காட்டுடன் தருக.
ஒவ்வொரு ஹேலஜனும் மற்ற ஹேலஜன்களுடன் வினைபட்டு ஹேலஜன் இடைச் சேர்மங்களை உருவாக்குகின்றன.
எ: கா: ClF, BrF3, IF5, If7
6. பிற ஹாலஜன்களைக் காட்டிலும் ஃபுளுரின் அதிக வினைத் திறனுடையது ஏன்?
ஃப்ளூரினின் F - F பிணைப்பு பிளவு ஆற்றல் மிகக்குறைவு. எனவே பிற ஹாலஜன்களைக் காட்டிலும் ஃப்ளூரின் அதிக வினைத் திறன் உடையது.
7. ஹீலியத்தின் பயன்களைத் தருக.
• ஹீலியம் மற்றும் ஆக்சிஜன் கலவையானது காற்று மற்றும் ஆக்சிஜன் கலவைக்கு மாற்றாக நீர்மூழ்குபவர்களால் பயன்படுத்தப்படுகிறது. இது வளைவு என்று அழைக்கப்படும் ஆபத்தான வலி ஏற்படுத்தும் நிகழ்வினை தடுக்கிறது.
• மின்வில் முறையில் உலோகங்களை ஒட்டும் செயல்முறையில் மந்த வினைபுரியா சூழலை ஏற்படுத்த ஹீலியம் பயன்படுகிறது.
• ஹீலியமானது குறைவான கொதிநிலையைக் கொண்டிருப்பதால் கிரையோஜெனிக் நுட்பங் களில் பயன்படுகிறது.
• காற்றை விட லேசானது என்பதால் காற்றில் மிதக்கும் பலூன்களில் நிரப்பப் பயன்படுகிறது.
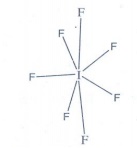
8. IF7 ல் அயோடினின் இனக்கலப்பு யாது? அதன் வடிவமைப்பினைத் தருக.
ஹாலஜன் இடைச் சேர்மம்
IF7
இனக்கலப்பு
Sp3d3
வடிவமைப்பு
ஐங்கோண இரு பிரமிடு
அமைப்பு :
9. குளோரின், குளிர்ந்த NaOH மற்றும் சூடான NaOH உடன் புரியும் வினைகளுக்கான சமன்படுத்தப்பட்ட சமன்பாடுகளைத் தருக. –
• குளோரின் குளிர்ந்த NaOH உடன் வினைபட்டு சோடியம் ஹைப்போ குளோரைட்டைத் தருகிறது.
Cl2 + 2NaOH → NaOCl + NaCl + H2O(சோடியம் ஹைப்போ குளோரைட்)
• குளோரின் சூடான NaOH உடன் வினைபட்டு சோடியம் குளோரேட்டைத் தருகிறது.
3Cl2 + 6NaOH → NaClO3 + 5NaCl + 3H2O(சோடியம் குளோரேட்)
10. ஆய்வகத்தில் எவ்வாறு குளோரினைத் தயாரிப்பாய்?
ஆய்வகத்தில் ஹைட்ரோகுளோரிக் அமிலத்தை பொட்டாசியம் பெர்மாங்கனேட் கொண்டு ஆக்சிஜனேற்றம் அடையச் செய்யும் போது குளோரின் வாயு உருவாகிறது.
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 8H2O + 5Cl ↑
11. கந்தக அமிலத்தின் பயன்களைத் தருக.
• அம்மோனியம் சல்பேட் மற்றும் சூப்பர் பாஸ்பேட் போன்ற உரங்களை பெருமளவில் தயாரிக்கும் தொழிற்சாலைகளில் பயன்படுகிறது.
• ஹைட்ரோகுளோரிக் அமிலம், நைட்ரிக் அமிலம் போன்ற வேதிப்பொருட்கள் தயாரிக்கப் பயன்படுகிறது.
• உலர்த்தும் காரணியாக பயன்படுகிறது.
• நிறமிபொருட்கள், வெடிப்பெருட்கள் தயாரிக்க பயன்படுகிறது.
12. கந்தக அமிலம் ஒரு நீர் நீக்கும் காரணி-என்பதனைத் தகுந்த எடுத்துக்காட்டுகளுடன் விளக்குக.
• கந்தக அமிலம் நீரில் அதிகம் கரைகிறது.
• கந்தக அமிலம் நீரின் மீது அதிக நாட்டத்தினைப் பெற்றுள்ளது.
• எனவே இதனை நீர் நீக்கும் வினைப்பொருளாக பயன்படுத்தலாம்.
• நீரில் கரைக்கும் போது மோனோ (H2SO4.H2O) மற்றும் டை ஹைட்ரேட்டுகளை (H2SO4.2H2O) தருகின்றது. இவ்வினையானது ஒரு வெப்ப உமிழ் வினையாகும்.
(எ.கா)
C12,H22O11+H2SO4 → 12C+H2SO4.11H2O
HCOOH + H2SO4 → CO + H2SO4.H2O
13. நைட்ரஜனின் முரண்பட்ட பண்பிற்கு காரணம் தருக.
நைட்ரஜனின் முரண்பட்ட பண்பிற்கு காரணம் அதன்
• சிறிய உருவளவு
• அதிக எலக்ட்ரான் கவர்திறன்
• அதிக அயனியாக்கும் என்தால்பி
• இணைதிறன் கூட்டில் d - ஆர்பிட்டால்கள் இல்லாதிருத்தல்
• அதிக பிணைப்பு ஆற்றல் காரணமாக மந்தத் தன்மை
14. பின்வரும் மூலக்கூறுகளுக்கு அவற்றின் மூலக்கூறு வாய்ப்பாடு மற்றும் அமைப்பு வாய்ப்பாடுகளைத் தருக.
அ) நைட்ரிக் அமிலம்
ஆ)டைநைட்ரஜன் பென்டாக்ஸைடு
இ) பாஸ்பாரிக் அமிலம்
ஈ) பாஸ்பைன்

சேர்மம்
அ) நைட்ரிக் அமிலம்
ஆ) டைநைட்ரஜன் பென்டாக்ஸைடு
இ) பாஸ்பாரிக் அமிலம்
ஈ) பாஸ்பைன்
மூலக்கூறு வாய்ப்பாடு
HNO3
N205
H3PO4
PH3
அமைப்பு வாய்பாடு
15. ஆர்கானின் பயன்களைத் தருக.
• சூடான மின்னிழைகளில் ஆக்சிஜனேற்றம் ஏற்படுவதை ஆர்கான் தடுக்கிறது. இதனால் பல்புகளில் காணப்படும் மின்னிழைகளின் ஆயுள் நீட்டிக்கப்படுகிறது.
• ஆர்கான் ரேடியோ வால்வுகளில் பயன்பட்டது.
16. 15 -ம் தொகுதி தனிமங்களின் இணை திற கூட்டு எலக்ட்ரான் அமைப்பினை எழுதுக.
15 ம் தொகுதி தனிமங்களின் இணைதிற கூட்டு எலக்ட்ரான் அமைப்பு ns2np3
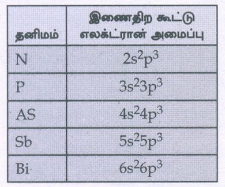
தனிமம் : இணைதிற கூட்டு எலக்ட்ரான் அமைப்பு
N - 2s2p3
P - 3s23p3
AS - 4s24p3
Sb - 5s25p3
Bi - 6s26p3
17. பாஸ்பைனின் வேதிப் பண்புகளை விளக்கும் இரு சமன்பாடுகளைத் தருக.
காரப் பண்பு:
பாஸ்பைன் ஒரு வலிமை குறைந்த காரமாகும். ஹேலஜன் அமிலங்களுடன் வினைபட்டு பாஸ்போனியம் உப்புகளைத் தருகிறது.
PH3 + HI → PH4I
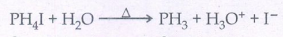
இது ஹாலஜன்களுடன் வினைப்பட்டு பாஸ்பரஸ் பென்டா ஹேலைடுகளை தருகிறது.
PH3 + 4Cl2 → PCl5 + 3HCl
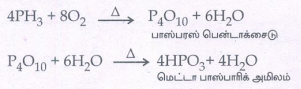
எரிதல் வினை :
பாஸ்பைன் காற்று அல்லது ஆக்சிஜனுடன் எரிந்து மெட்டா பாஸ்பாரிக் அமிலத்தைத் தருகிறது.
18. நைட்ரிக் அமிலம் மற்றும் ஒரு கார ஆக்ஸைடு ஆகியவற்றிற்கிடையேயான வினையினைத் தருக.
நைட்ரிக் அமிலம் ஒரு கார ஆக்சைடுடன் வினை புரிந்து உப்பு மற்றும் நீரினைத் தருகிறது.
3 FeO + 10 HNO3 → 3 Fe (NO3) 3+ NO + 5H2O
பொரிக் நைட்ரேட்
19. PCI5 ஐ வெப்பப்படுத்தும் போது நிகழ்வது யாது?
PCl5, ஐ வெப்பப்படுத்தும் போது சிதைவடைந்து பாஸ்பரஸ் டிரை குளோரைடு மற்றும் குளோரின் உருவாகிறது.

20. HF ஆனது ஒரு வலிமை குறைந்த அமிலம் ஆனால் பிற ஹாலஜன்களின் இருமை அமிலங்கள் வலிமை மிக்கதாக உள்ளன ஏன் என்பதற்கான காரணம் தருக.
• ஹாலஜன்களின் இருமை அமிலங்களில் HF அமிலத்தில் H மற்றும் F க்கு இடையேயான எலக்ட்ரான் கவர்திறன் வேறுபாடு அதிகம் (1.9)
• எனவே H-F பிணைப்பு வலிமையானது, அதனால் HF அமிலம் வலிமை குறைந்த அமிலம்.
• HF அமிலம் சிறிதளவே அயனியுறுகிறது, எனவே அது ஒரு வலிமை குறைந்த அமிலம்.
• ஆனால் மற்ற ஹாலஜன் அமிலங்கள் ஏறக்குறைய முழுமையாக அயனியுறுகின்றன, எனவே அவை வலிமை மிக்க அமிலங்கள் ஆகும்.
21. ஹைப்போ ஃபுளுரஸ் அமிலத்தில் (HOF) ஆக்சிஜனின் ஆக்சிஜனேற்ற எண்ணைக் கண்டறிக.
F ன் ஆக்சிஜனேற்ற எண் = -1
H ன் ஆக்சிஜனேற்ற எண் = +1
HOF ல் Oன் ஆக்சிஜனேற்ற எண் = x
1 + x-1= 0
x = 0
எனவே HOF ல் Oன் ஆக்சிஜனேற்ற எண் = 0
22. பின்வரும் சேர்மங்களில் காணப்படும் இனக்கலப்பாதலைக் கண்டறிக.
அ) BrF5
ஆ) BrF3
ஹாலஜன் இடைச் சேர்மங்கள்
BrF5
BrF3
இனக்கலப்பாதல்
Sp3d2
Sp3d
23. பின்வரும் வினைகளை பூர்த்தி செய்க.
1. NaCl + MnO2 + H2SO4 →
2. NaNO2 + HCl →
3. IO3- + I- + H+ →
4. I2, + S2O32- →
5. P4 + NaOH + H2O →
6. AgNO3 + PH3 →
7. Mg + HNO3 →
8. 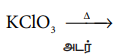
9. Cu + H2SO4 →
10. Sb + Cl2 →
11. HBr + H2SO4 →
12. XeF6 + H2O →
13. XeO64-+ Mn2+ + H+ →
14. XeOF4 + SiO2 →
15. 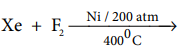
விடைகள் :
1. 4NaCl + MnO2 + 4H2SO4 → Cl2 + MnCl2 + 4NaHSO4 + 2H2O
2. NaNO2 + HCl →NaCl + HNO2
3. IO3-+ 5I- + 6H+ →3l2 + 3H2O
4. I2 + 2S2O32-→ 2l- + S4O62-
5. P4 + 3NaOH + 3H2O →3NaH2PO2 + PH3
சோடியம் ஹைப்போ பாஸ்பைட் பாஸ்பீன்
6. 6AgNO3 + PH3 + 3H2O → 6Ag + 6HNO3 + H3PO3
7. 4Mg + 10HNO3 → 4Mg(NO3)2 + NH4NO3 + 3H2O
4Mg + 10HNO3→ 4Mg(NO3)2 + N2O + 5H2O
8. 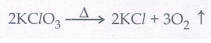
9. Cu + 2H2SO4 → CusO4 + 2H2O + 2SO2
(சூடான, அடர்)
10. 2Sb + 3Cl2 → 2SbCl3
11. 2HBr + H2SO4 → 2H2O + Br2 + SO2
12. XeF6 + 3H2O →XeO3 + 6HF
13. 5 XeO6 4- + 2Mn2+ + 14H+ → 2MnO4- + 5XeO3 + 7H2O
14. 2XeOF4 + SiO2 →2XeO2F2 + SiF4
15. 
III. தன்மதிப்பீடு
1. ஜிங்க் உடன் நைட்ரிக் அமிலம் (நீர்த்த மற்றும் அடர்) வினைபடும்போது உருவாகும் விளைபொருட்களை எழுதுக.
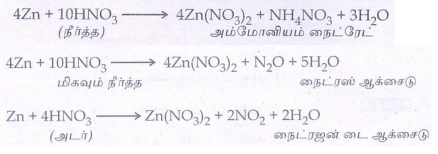
4Zn + 10HNO3 → 4Zn(NO3) 2+ NH4NO3+ 3H2O
(நீர்த்த ) அம்மோனியம் நைட்ரேட்
4Zn + 10HNO3 → 4Zn(NO3) 2 + N2O + 5H2O
மிகவும் நீர்த்த நைட்ரஸ் ஆக்சைடு
Zn + 4HNO3) → Zn(NO3)2 + 2NO2 + 2H2O
(அடர் ) நைட்ரஜன் டை ஆக்சைடு