9 ஆம் வகுப்பு அறிவியல் : அலகு 13 : வேதிப்பிணைப்பு
வேதிப்பிணைப்பு பற்றிய கோசல்-லூயிஸ் கொள்கை
வேதிப்பிணைப்பு பற்றிய கோசல்-லூயிஸ் கொள்கை
1. எட்டு எலக்ட்ரான் விதி
பலதரப்பட்ட தனிமங்களின் அணுக்கள் பல்வேறு வகையில் இணைந்து வேதிச்சேர்மங்களை உருவாக்குகின்றன. இந்நிகழ்வு பல வினாக்களை எழுப்பியது.
● ஏன் அணுக்கள் இணைகின்றன?
● அணுக்கள் எவ்வாறு இணைகின்றன?
● ஏன் ஒரு சில அணுக்கள் இணைகின்றன;
மற்றவை இணைவதில்லை?
இது போன்ற வினாக்களுக்கு விடையளிக்கும் வகையில் பல்வேறு கொள்கைகள் முன் மொழியப்பட்டன. அவற்றுள் முக்கியமான ஒன்று மூலக்கூறுகள் எவ்வாறு உருவாகின்றன என்பதை விளக்கும் கோசல்-லூயிஸ் கொள்கை ஆகும்.
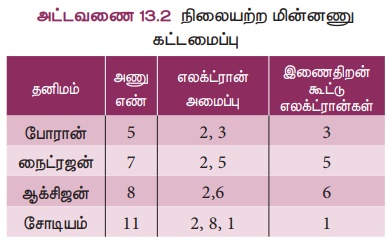
மந்தவாயு எலக்ட்ரான் அமைப்பு என்ற கருத்தை அடிப்படையாகக் கொண்டு ஏன் அணுக்கள் இணைந்து மூலக்கூறுகளை உருவாக்குகின்றன என்பதனை கோசல் மற்றும் லூயிஸ் விளக்கினர். மந்த வாயு அணுக்கள் தங்களுக்கிடையிலோ அல்லது மற்ற அணுக்களுடனோ எளிதில் இணைவதில்லை அல்லது அரிதாக இணைகின்றன. அவை ஒரு நிலையான எலக்ட்ரான் அமைப்பைப் பெற்றிருப்பதையே இது காட்டுகிறது. அட்டவணை 13.1 ல் மந்த வாயுக்களின் எலக்ட்ரான் அமைப்புகள் கொடுக்கப்பட்டுள்ளன.
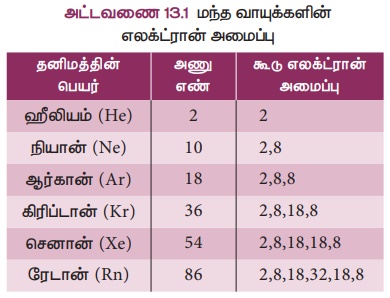
ஹீலியத்தைத் தவிர, மற்ற மந்த வாயுக்கள் அனைத்தும் அவற்றின் இணைதிறன் கூட்டில் எட்டு எலக்ட்ரான்களைப் பெற்றிருக்கின்றன. ஹீலியம் அணுவும் முழுவதும் நிரம்பிய இணைதிறன் கூட்டைப் பெற்றிருப்பதால்,
அதில் மேலும் எலக்ட்ரான்களைச் சேர்க்க இயலாது. இவ்வாறாக,
மந்த வாயு அணுக்கள் இணைதிறன் கூட்டில் நிலையான எலக்ட்ரான் அமைப்பைப் பெற்றிருப்பதால் அவை எலக்ட்ரான்களை இழக்கும் அல்லது ஏற்கும் தன்மையைப் பெற்றிருப்பதில்லை. எனவே,
அவற்றின் இணைதிறன் பூச்சியமாகும். மிகவும் மந்தத் தன்மையைக் கொண்டிருப்பதால், அவை ஈரணு மூலக்கூறுகளைக் கூட உருவாக்குதில்லை. ஆகவே அவை ஓரணு வாயுக்களாகவே காணப்படுகின்றன.
மேலும் அறிந்துகொள்வோம்
ஒரு உலோகத்தின் இணைதிறன் என்பது அந்த உலோகம் இழக்கும் எலக்ட்ரான்களின் எண்ணிக்கை ஆகும்.
ஒரு அலோகத்தின் இணைதிறன் என்பது அது ஏற்கும் எலக்ட்ரான்களின் எண்ணிக்கை ஆகும்.
மந்த வாயு எலக்ட்ரான் அமைப்பை அடிப்படையாகக் கொண்டு, 1916 ஆம் ஆண்டில் கோசல் மற்றும் லூயிஸ் என்பார் அணுக்களின் வேதிச்சேர்க்கைகளுக்கான கொள்கையை முன்மொழிந்தனர். இதுவே இணைதிறன் எலக்ட்ரான் கொள்கை அல்லது எட்டு எலக்ட்ரான் விதி எனப்படுகிறது. இக்கொள்கைப்படி,
மந்த வாயுக்கள் தவிர, மற்ற தனிமங்களின் அணுக்கள் முழுவதும் நிரப்பப்படாத இணைதிறன் கூட்டைப் பெற்றிருக்கின்றன. எனவே, மந்த வாயுக்கள் போன்று நிலையான எலக்ட்ரான் அமைப்பைப் பெறுவதற்காக அவை மற்ற அணுக்களுடன் இணைந்து மூலக்கூறுகளை உருவாக்குகின்றன. ஒரு அணு அதன் இணைதிறன் கூட்டில் உள்ள எலக்ட்ரான்களை மற்றொரு அணுவிடம் இழந்தோ அல்லது பங்கீடு செய்தோ இணைவதன் மூலம் நிலையான மந்த வாயு எலக்ட்ரான் அமைப்பைப் பெறுகிறது.
ஒரு அணுவானது மற்றொரு அணுவிடம் அதன் இணைதிறன் கூடு எலக்ட்ரான்களை இழந்தோ அல்லது பங்கீடு செய்கோ இணைதிறன் கூட்டில் எட்டு எலக்ட்ரான்களைப் பெற்றிருக்கும் விளைவு எட்டு எலக்ட்ரான்விதி"அல்லது"எண்மவிதி" எனப்படுகிறது.
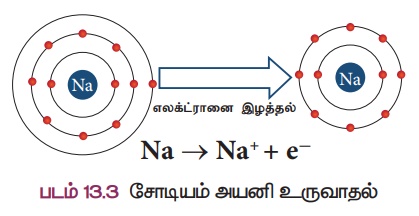
உதாரணமாக, சோடியத்தின் அணு எண் 11.
சோடியம் அதன் இணைதிறன் கூட்டிலிருந்து ஒரு எலக்ட்ரானை எளிதில் இழந்து நியான் அணுவின் எலக்ட்ரான் அமைப்பைப் பெறுகிறது (படம் 13.3).
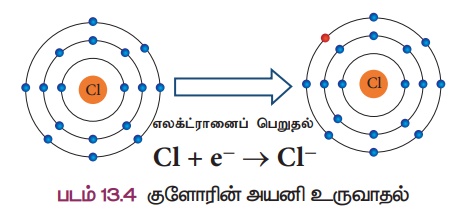
அதைப்போலவே, குளோரின் அணுவின் எலக்ட்ரான் அமைப்பு 2,8,7.
இதற்கு நெருக்கமான மந்த வாயுவான ஆர்கானின் எலக்ட்ரான் அமைப்பைப் பெற குளோரினுக்கு மேலும் ஓர் எலக்ட்ரான் தேவைப்படுகிறது. எனவே, குளோரின் அணுமற்றொரு அணுவிடமிருந்து ஓர் எலக்ட்ரானை எளிதில் பெற்று நிலையான ஆர்கான் எலக்ட்ரான் அமைப்பைப் பெறுகிறது (படம் 13.4).
இவ்வாறாக, தனிமங்கள் எலக்ட்ரான்களை இழந்தோ அல்லது ஏற்றோ நிலையான இணைதிறன் கூட்டினைப் (எட்டு எலக்ட்ரான்கள்) பெறுகின்றன.
எவ்வகை அணுக்கள் எலக்ட்ரான்களை இழக்க வல்லவை? எவ்வகை அணுக்கள் எலக்ட்ரான்களை ஏற்க வல்லவை? இணைதிறன் கூட்டில் தலா 1,2,3 எலக்ட்ரான்களைப் பெற்றிருக்கும் அணுக்கள் எலக்ட்ரான்களை இழக்க வல்லவை. மாறாக,
இணைதிறன் கூட்டில் தலா 5,6,7 எலக்ட்ரான்களைக் கொண்ட அணுக்கள் எலக்ட்ரான்களை ஏற்கும் தன்மையுடையவை.