9 Я«єЯ««Я»Ї Я«хЯ«ЋЯ»ЂЯ«фЯ»ЇЯ«фЯ»Ђ Я«ЁЯ«▒Я«┐Я«хЯ«┐Я«»Я«▓Я»Ї : Я«ЁЯ«▓Я«ЋЯ»Ђ 13 : Я«хЯ»ЄЯ«цЯ«┐Я«фЯ»ЇЯ«фЯ«┐Я«БЯ»ѕЯ«фЯ»ЇЯ«фЯ»Ђ
Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я««Я»Ї, Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ««Я»Ї Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«Ћ Я«хЯ«┐Я«ЕЯ»ѕЯ«ЋЯ«│Я»Ї
Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я««Я»Ї, Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ««Я»Ї Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«Ћ Я«хЯ«┐Я«ЕЯ»ѕЯ«ЋЯ«│Я»Ї
Я«њЯ«░Я»Ђ Я«єЯ«фЯ»ЇЯ«фЯ«┐Я«│Я»Ї Я«фЯ«┤Я«цЯ»ЇЯ«цЯ»ѕ Я«хЯ»єЯ«ЪЯ»ЇЯ«ЪЯ«┐ Я«џЯ«┐Я«▒Я«┐Я«цЯ»Ђ Я«еЯ»ЄЯ«░Я««Я»Ї Я«хЯ»ѕЯ«цЯ»ЇЯ«цЯ«┐Я«░Я»ЂЯ«еЯ»ЇЯ«цЯ«ЙЯ«▓Я»Ї Я«ЁЯ«цЯ«ЕЯ»Ї Я«хЯ»єЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ«фЯ»ЇЯ«фЯ«░Я«фЯ»ЇЯ«фЯ»Ђ Я«фЯ«┤Я»ЂЯ«фЯ»ЇЯ«фЯ»Ђ Я«еЯ«┐Я«▒Я««Я«ЙЯ«Ћ Я««Я«ЙЯ«▒Я»ЂЯ«хЯ«цЯ»ѕЯ«ЋЯ»Ї Я«ЋЯ«ЙЯ«БЯ«▓Я«ЙЯ««Я»Ї. Я«ЁЯ«цЯ»ѕЯ«фЯ»ЇЯ«фЯ»ІЯ«▓Я«хЯ»Є Я«ЄЯ«░Я»ЂЯ««Я»ЇЯ«фЯ»ЂЯ«фЯ»Ї Я«фЯ»іЯ«░Я»ЂЯ«│Я»ЇЯ«ЋЯ«│Я«┐Я«▓Я»Ї Я«цЯ»ЂЯ«░Я»ЂЯ«фЯ»ЇЯ«фЯ«┐Я«ЪЯ«┐Я«цЯ»ЇЯ«цЯ«▓Я»ѕ Я«ЁЯ«ЕЯ»ЇЯ«▒Я«ЙЯ«Ъ Я«хЯ«ЙЯ«┤Я»ЇЯ«хЯ«┐Я«▓Я»Ї Я«ЋЯ«ЙЯ«БЯ»ЇЯ«ЋЯ«┐Я«▒Я»ІЯ««Я»Ї. Я«ЄЯ«цЯ»ЇЯ«цЯ«ЋЯ»ѕЯ«» Я«еЯ«┐Я«ЋЯ«┤Я»ЇЯ«хЯ»ЂЯ«ЋЯ«│Я»Ї Я«ЈЯ«ЕЯ»Ї Я«еЯ«┐Я«ЋЯ«┤Я»ЇЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е Я«јЯ«ЕЯ«цЯ»ЇЯ«цЯ»єЯ«░Я«┐Я«»Я»ЂЯ««Я«Й?
Я«ЄЯ«хЯ»ѕ Я«еЯ«┐Я«ЋЯ«┤Я«ЋЯ»ЇЯ«ЋЯ«ЙЯ«░Я«БЯ««Я»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я««Я»Ї Я«јЯ«ЕЯ»ЂЯ««Я»Ї Я«хЯ«┐Я«ЕЯ»ѕ Я«єЯ«ЋЯ»ЂЯ««Я»Ї.

Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я««Я»Ї: Я«њЯ«░Я»Ђ Я«хЯ»ЄЯ«цЯ«┐Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я«┐Я«▓Я»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»Ї Я«џЯ»ЄЯ«░Я»ЇЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ«▓Я»І, Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я«юЯ«ЕЯ»Ї Я«еЯ»ђЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ«▓Я»І Я«ЁЯ«▓Я»ЇЯ«▓Я«цЯ»Ђ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»Ї Я«еЯ»ђЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ«▓Я»І Я«еЯ«┐Я«ЋЯ«┤Я»ЂЯ««Я»Ї Я«фЯ»ІЯ«цЯ»Ђ Я«ЁЯ«еЯ»ЇЯ«ц Я«хЯ«┐Я«ЕЯ»ѕ Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я««Я»Ї Я«јЯ«ЕЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
2
Mg + O2 + 2 Mgo (Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»Ї Я«џЯ»ЄЯ«░Я»ЇЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ«▓Я»Ї)
CaH2
Рєњ Ca + H2 (Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я«юЯ«ЕЯ»Ї Я«еЯ»ђЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ«▓Я»Ї)
Fe2+
Рєњ Fe3+ + e- (Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»Ї Я«еЯ»ђЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ«▓Я»Ї)
Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ««Я»Ї: Я«њЯ«░Я»Ђ Я«хЯ»ЄЯ«цЯ«┐Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я«┐Я«▓Я»Ї Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я«юЯ«ЕЯ»Ї Я«џЯ»ЄЯ«░Я»ЇЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ«▓Я»І, Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»Ї Я«еЯ»ђЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ«▓Я»І Я«ЁЯ«▓Я»ЇЯ«▓Я«цЯ»Ђ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»Ї Я«ЈЯ«▒Я»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ«▓Я»І Я«еЯ«┐Я«ЋЯ«┤Я»ЂЯ««Я»Ї Я«фЯ»ІЯ«цЯ»Ђ Я«ЁЯ«еЯ»ЇЯ«ц Я«хЯ«┐Я«ЕЯ»ѕ Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ««Я»Ї Я«јЯ«ЕЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
2
Na + H2 Рєњ 2 NaH (Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я«юЯ«ЕЯ»Ї Я«џЯ»ЄЯ«░Я»ЇЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ«▓Я»Ї)
CuO
+ H2 + Cu +H2O (Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»Ї Я«еЯ»ђЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ«▓Я»Ї)
Fe3+
+ e- Рєњ Fe2+ (Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»Ї Я«џЯ»ЄЯ«░Я»ЇЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ«▓Я»Ї)
Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«Ћ Я«хЯ«┐Я«ЕЯ»ѕЯ«ЋЯ«│Я»Ї: Я«фЯ»іЯ«цЯ»ЂЯ«хЯ«ЙЯ«Ћ, Я«њЯ«░Я»Ђ Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я«┐Я«▓Я»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я««Я»ЂЯ««Я»Ї Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ««Я»ЂЯ««Я»Ї Я«њЯ«░Я»Є Я«еЯ»ЄЯ«░Я«цЯ»ЇЯ«цЯ«┐Я«▓Я»Ї Я«еЯ«┐Я«ЋЯ«┤Я»ЇЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е. Я«њЯ«░Я»Ђ Я«хЯ«┐Я«ЕЯ»ѕЯ«фЯ«ЪЯ»Ђ Я«фЯ»іЯ«░Я»ЂЯ«│Я»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я««Я»Ї Я«ЁЯ«ЪЯ»ѕЯ«»Я»ЂЯ««Я»Ї Я«фЯ»ІЯ«цЯ»Ђ Я««Я«▒Я»ЇЯ«▒Я»іЯ«ЕЯ»ЇЯ«▒Я»Ђ Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ««Я«ЪЯ»ѕЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«јЯ«ЕЯ«хЯ»Є,
Я«ЄЯ«хЯ»ЇЯ«хЯ«ЋЯ»ѕЯ«»Я«ЙЯ«Е Я«хЯ«┐Я«ЕЯ»ѕЯ«ЋЯ«│Я»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ -
Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«Ћ Я«хЯ«┐Я«ЕЯ»ѕЯ«ЋЯ«│Я»Ї Я«јЯ«ЕЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е.
2
PbO + C Рєњ 2 Pb + CO2
Zn
+ CusO4 Рєњ Cu + ZnSO4
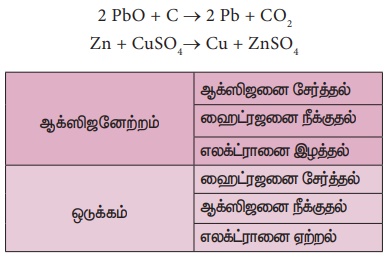
Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я«┐ Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«ЋЯ«│Я»Ї
Я««Я«▒Я»ЇЯ«▒ Я«фЯ»іЯ«░Я»ЂЯ«│Я»ЇЯ«ЋЯ«│Я»ѕ Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я««Я»Ї Я«ЁЯ«ЪЯ»ѕЯ«»Я«џЯ»Ї Я«џЯ»єЯ«»Я»ЇЯ«»Я»ЂЯ««Я»Ї Я«фЯ»іЯ«░Я»ЂЯ«│Я»ЇЯ«ЋЯ«│Я»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я«┐Я«ЋЯ«│Я»Ї Я«јЯ«ЕЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї. Я«ЄЯ«хЯ»ѕ Я««Я«▒Я»ЇЯ«▒Я«хЯ«▒Я»ЇЯ«▒Я«┐Я«ЪЯ««Я«┐Я«░Я»ЂЯ«еЯ»ЇЯ«цЯ»Ђ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ѕ Я«хЯ«ЙЯ«ЎЯ»ЇЯ«ЋЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»іЯ«│Я»ЇЯ«хЯ«цЯ«ЙЯ«▓Я»Ї Я«ЄЯ«хЯ«▒Я»ЇЯ«▒Я»ѕ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»Ї Я«ЈЯ«▒Я»ЇЯ«фЯ«┐Я«ЋЯ«│Я»Ї Я«јЯ«ЕЯ«хЯ»ЂЯ««Я»Ї Я«ЁЯ«┤Я»ѕЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«▒Я»ІЯ««Я»Ї.
Я«ј.Я«ЋЯ«Й: H2O2
MnO-4 CrO3
Cr2O2-
Я««Я«▒Я»ЇЯ«▒ Я«фЯ»іЯ«░Я»ЂЯ«│Я»ЇЯ«ЋЯ«│Я»ѕ Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ««Я»Ї Я«ЁЯ«ЪЯ»ѕЯ«»Я«џЯ»Ї Я«џЯ»єЯ«»Я»ЇЯ«»Я»ЂЯ««Я»Ї Я«фЯ»іЯ«░Я»ЂЯ«│Я»ЇЯ«ЋЯ«│Я»Ї Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«ЋЯ«│Я»Ї Я«јЯ«ЕЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї. Я«ЄЯ«хЯ»ѕ Я««Я«▒Я»ЇЯ«▒Я«хЯ«▒Я»ЇЯ«▒Я«┐Я«▒Я»ЇЯ«ЋЯ»Ђ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ѕ Я«хЯ«┤Я«ЎЯ»ЇЯ«ЋЯ»ЂЯ«хЯ«цЯ«ЙЯ«▓Я»Ї Я«ЄЯ«хЯ«▒Я»ЇЯ«▒Я»ѕ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»Ї Я«ѕЯ«ЕЯ«┐Я«ЋЯ«│Я»Ї Я«јЯ«ЕЯ«хЯ»ЂЯ««Я»Ї Я«ЁЯ«┤Я»ѕЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«▒Я»ІЯ««Я»Ї.
Я«ј.Я«ЋЯ«Й :
NaBH4,
LiAIH4 Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«фЯ«▓Я»ЇЯ«▓Я»ЄЯ«ЪЯ«┐Я«»Я««Я»Ї,
Я«фЯ«┐Я«│Я«ЙЯ«ЪЯ»ЇЯ«ЪЯ«┐Я«ЕЯ««Я»Ї Я«фЯ»ІЯ«ЕЯ»ЇЯ«▒ Я«ЅЯ«▓Я»ІЯ«ЋЯ«ЎЯ»ЇЯ«ЋЯ«│Я»Ї
Я«ЁЯ«ЕЯ»ЇЯ«▒Я«ЙЯ«Ъ Я«хЯ«ЙЯ«┤Я»ЇЯ«хЯ«┐Я«▓Я»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«хЯ«┐Я«ЕЯ»ѕЯ«ЋЯ«│Я»Ї
Я«ЄЯ«»Я«▒Я»ЇЯ«ЋЯ»ѕЯ«»Я«┐Я«▓Я»Ї Я«ЋЯ«ЙЯ«▒Я»ЇЯ«▒Я«┐Я«▓Я»Ї Я«ЋЯ«ЙЯ«БЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ«ЙЯ«ЕЯ«цЯ»Ђ, Я«ЅЯ«▓Я»ІЯ«ЋЯ«ЎЯ»ЇЯ«ЋЯ«│Я»Ї Я««Я»ЂЯ«цЯ«▓Я»Ї Я«ЅЯ«»Я«┐Я«░Я»ЂЯ«│Я»ЇЯ«│ Я«цЯ«┐Я«џЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«│Я»Ї Я«хЯ«░Я»ѕ Я«фЯ«▓Я«хЯ«▒Я»ЇЯ«▒Я»ѕ Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я««Я»Ї Я«ЁЯ«ЪЯ»ѕЯ«»Я«џЯ»Ї Я«џЯ»єЯ«»Я»ЇЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
РЌЈ Я«фЯ«│Я«фЯ«│Я«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«ЅЯ«▓Я»ІЯ«ЋЯ«ЎЯ»ЇЯ«ЋЯ«│Я»Ї,
Я«ЋЯ«ЙЯ«▒Я»ЇЯ«▒Я«┐Я«▓Я»ЂЯ«│Я»ЇЯ«│ Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЂЯ«ЪЯ«ЕЯ»Ї Я«хЯ«┐Я«ЕЯ»ѕЯ«фЯ»ЂЯ«░Я«┐Я«еЯ»ЇЯ«цЯ»Ђ Я«ЅЯ«▓Я»ІЯ«Ћ Я«єЯ«ЋЯ»ЇЯ«ИЯ»ѕЯ«ЪЯ»ЂЯ«ЋЯ«│Я«ЙЯ«Ћ Я««Я«ЙЯ«▒Я»ЂЯ«хЯ«цЯ«ЙЯ«▓Я»Ї Я«цЯ«ЎЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«фЯ«│Я«фЯ«│Я«фЯ»ЇЯ«фЯ»ѕ Я«ЄЯ«┤Я«ЋЯ»ЇЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е. Я«ЄЯ«цЯ«▒Я»ЇЯ«ЋЯ»Ђ Я«ЅЯ«▓Я»ІЯ«ЋЯ«ЎЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«ЁЯ«░Я«┐Я««Я«ЙЯ«ЕЯ««Я»Ї (Corrosion)
Я«јЯ«ЕЯ»ЇЯ«▒Я»Ђ Я«фЯ»єЯ«»Я«░Я»Ї.
РЌЈ Я«фЯ»ЂЯ«цЯ«┐Я«цЯ«ЙЯ«Ћ Я«хЯ»єЯ«ЪЯ»ЇЯ«ЪЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«Ъ Я«ЋЯ«ЙЯ«»Я»ЇЯ«ЋЯ«▒Я«┐Я«ЋЯ«│Я»ЂЯ««Я»Ї,
Я«фЯ«┤Я«ЎЯ»ЇЯ«ЋЯ«│Я»ЂЯ««Я»Ї Я«џЯ«┐Я«▒Я«┐Я«цЯ»Ђ Я«еЯ»ЄЯ«░Я«цЯ»ЇЯ«цЯ«┐Я«▓Я»Ї Я«еЯ«┐Я«▒Я««Я»Ї Я««Я«ЙЯ«▒Я»ЂЯ«хЯ«цЯ»Ђ, Я«ЁЯ«хЯ«▒Я»ЇЯ«▒Я«┐Я«▓Я»ЂЯ«│Я»ЇЯ«│ Я«еЯ»іЯ«цЯ«┐Я«ЋЯ«│Я»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я««Я»Ї Я«ЁЯ«ЪЯ»ѕЯ«хЯ«цЯ«ЙЯ«▓Я»Ї Я«ЅЯ«БЯ»ЇЯ«ЪЯ«ЙЯ«хЯ«цЯ«ЙЯ«ЋЯ»ЂЯ««Я»Ї.
РЌЈ Я«цЯ«┐Я«▒Я«еЯ»ЇЯ«цЯ»Ђ Я«хЯ»ѕЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«Ъ Я«ЅЯ«БЯ«хЯ»ЂЯ«фЯ»ЇЯ«фЯ»іЯ«░Я»ЂЯ«│Я»ЇЯ«ЋЯ«│Я»Ї Я«ЋЯ»єЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ«фЯ»ЇЯ«фЯ»ІЯ«хЯ«цЯ«▒Я»ЇЯ«ЋЯ»Ђ (Rancidity) Я«ЁЯ«фЯ»ЇЯ«фЯ»іЯ«░Я»ЂЯ«│Я»ЇЯ«ЋЯ«│Я»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я««Я»Ї Я«ЁЯ«ЪЯ»ѕЯ«цЯ«▓Я»Є Я«ЋЯ«ЙЯ«░Я«БЯ««Я«ЙЯ«ЋЯ»ЂЯ««Я»Ї.
Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«јЯ«БЯ»Ї
Я«њЯ«░Я»Ђ Я«хЯ»ЄЯ«цЯ«┐Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я«┐Я«ЕЯ»Ї Я«фЯ»ІЯ«цЯ»Ђ Я«њЯ«░Я»Ђ Я«цЯ«ЕЯ«┐Я««Я«цЯ»ЇЯ«цЯ«┐Я«▓Я»ЂЯ«│Я»ЇЯ«│ Я«ЁЯ«БЯ»ЂЯ«хЯ«ЙЯ«ЕЯ«цЯ»Ђ Я«ЄЯ«┤Я«ЋЯ»ЇЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒ Я«ЁЯ«▓Я»ЇЯ«▓Я«цЯ»Ђ Я«ЈЯ«▒Я»ЇЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«јЯ«БЯ»ЇЯ«БЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»ѕЯ«»Я»Є Я«ЁЯ«хЯ»ЇЯ«хЯ«БЯ»ЂЯ«хЯ«┐Я«ЕЯ»Ї Я«єЯ«ЋЯ»ЇЯ«џЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«јЯ«БЯ»Ї Я«јЯ«ЕЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї. Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«јЯ«БЯ»Ї Я«јЯ«ЕЯ»ЇЯ«фЯ«цЯ»ѕ Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«еЯ«┐Я«▓Я»ѕ Я«јЯ«ЕЯ«хЯ»ЂЯ««Я»Ї Я«ЁЯ«┤Я»ѕЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«▒Я»ІЯ««Я»Ї. Я«њЯ«░Я»Ђ Я«ЁЯ«БЯ»ЂЯ«хЯ«ЙЯ«ЕЯ«цЯ»Ђ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ѕ Я«ЄЯ«┤Я«фЯ»ЇЯ«фЯ«цЯ«ЙЯ«▓Я»Ї Я«еЯ»ЄЯ«░Я»Ї Я«єЯ«ЋЯ»ЇЯ«џЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«јЯ«БЯ»ЇЯ«БЯ»ѕЯ«»Я»ЂЯ««Я»Ї,
Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ѕ Я«ЈЯ«▒Я»ЇЯ«фЯ«цЯ«ЙЯ«▓Я»Ї Я«јЯ«цЯ«┐Я«░Я»Ї Я«єЯ«ЋЯ»ЇЯ«џЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«јЯ«БЯ»ЇЯ«БЯ»ѕЯ«»Я»ЂЯ««Я»Ї Я«фЯ»єЯ«▒Я»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«ЁЯ«цЯ»Ђ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ѕ Я«ЈЯ«▒Я»ЇЯ«ЋЯ«хЯ»І Я«ЁЯ«▓Я»ЇЯ«▓Я«цЯ»Ђ Я«ЄЯ«┤Я«ЋЯ»ЇЯ«ЋЯ«хЯ»І Я«ЄЯ«▓Я»ЇЯ«▓Я»ѕЯ«»Я»єЯ«ЕЯ«┐Я«▓Я»Ї Я«ЁЯ«цЯ«ЕЯ»Ї Я«єЯ«ЋЯ»ЇЯ«џЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«јЯ«БЯ»Ї Я«фЯ»ѓЯ«юЯ»ЇЯ«»Я««Я»Ї. Я«њЯ«░Я»Ђ Я««Я»ѓЯ«▓Я«ЋЯ»ЇЯ«ЋЯ»ѓЯ«▒Я«┐Я«▓Я»Ї Я«ЅЯ«│Я»ЇЯ«│ Я«ЁЯ«ЕЯ»ѕЯ«цЯ»ЇЯ«цЯ»Ђ Я«ЁЯ«БЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«јЯ«БЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«ЋЯ»ѓЯ«ЪЯ»ЂЯ«цЯ«▓Я»Ї Я«фЯ»ѓЯ«юЯ»ЇЯ«»Я««Я«ЙЯ«ЋЯ»ЂЯ««Я»Ї. Я«ЁЯ«»Я«ЕЯ«┐Я«ЋЯ«│Я»ѕЯ«фЯ»Ї Я«фЯ»іЯ«▒Я»ЂЯ«цЯ»ЇЯ«ц Я«хЯ«░Я»ѕЯ«»Я«┐Я«▓Я»Ї Я«ЄЯ«ЋЯ»ЇЯ«ЋЯ»ѓЯ«ЪЯ»ЂЯ«цЯ«▓Я»Ї Я««Я«цЯ«┐Я«фЯ»ЇЯ«фЯ»Ђ Я«ЁЯ«»Я«ЕЯ«┐Я«ЋЯ«│Я«┐Я«ЕЯ»Ї Я««Я»ђЯ«цЯ»ЂЯ«│Я»ЇЯ«│ Я«еЯ«┐Я«ЋЯ«░ Я««Я«┐Я«ЕЯ»ЇЯ«џЯ»ЂЯ««Я»ѕЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ«џЯ»Ї Я«џЯ««Я««Я»Ї. Я«џЯ»ЄЯ«░Я»ЇЯ««Я«ЎЯ»ЇЯ«ЋЯ«│Я«┐Я«▓Я»Ї Я«ЁЯ«цЯ«┐Я«Ћ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»Ї Я«ЋЯ«хЯ«░Я»Ї Я«цЯ«ЕЯ»ЇЯ««Я»ѕ Я«ЅЯ«│Я»ЇЯ«│ Я«ЁЯ«БЯ»Ђ Я«јЯ«цЯ«┐Я«░Я»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«јЯ«БЯ»ЇЯ«БЯ»ѕЯ«»Я»ЂЯ««Я»Ї, Я«ЋЯ»ЂЯ«▒Я»ѕЯ«еЯ»ЇЯ«ц Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»Ї Я«ЋЯ«хЯ«░Я»Ї Я«цЯ«ЕЯ»ЇЯ««Я»ѕ Я«ЋЯ»іЯ«БЯ»ЇЯ«Ъ Я«ЁЯ«БЯ»Ђ Я«еЯ»ЄЯ«░Я»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«јЯ«БЯ»ЇЯ«БЯ»ѕЯ«»Я»ЂЯ««Я»Ї Я«фЯ»єЯ«▒Я»ЂЯ««Я»Ї.
Я«јЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«ЙЯ«ЪЯ»ЇЯ«ЪЯ»Ђ:
РЌЈ
KBr Я««Я»ѓЯ«▓Я«ЋЯ»ЇЯ«ЋЯ»ѓЯ«▒Я«┐Я«▓Я»Ї Я«ЅЯ«│Я»ЇЯ«│ K Я«ЁЯ«БЯ»Ђ +1 Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«јЯ«БЯ»ЇЯ«БЯ»ѕЯ«»Я»ЂЯ««Я»Ї,
Br Я«ЁЯ«БЯ»Ђ -1 Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«јЯ«БЯ»ЇЯ«БЯ»ѕЯ«»Я»ЂЯ««Я»Ї Я«фЯ»єЯ«▒Я»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
РЌЈ
NH3 Я««Я»ѓЯ«▓Я«ЋЯ»ЇЯ«ЋЯ»ѓЯ«▒Я«┐Я«▓Я»Ї Я«ЅЯ«│Я»ЇЯ«│ N Я«ЕЯ»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«јЯ«БЯ»Ї -3
РЌЈ H Я«ЕЯ»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«јЯ«БЯ»Ї +1
(Я«ЅЯ«▓Я»ІЯ«Ћ Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я»ѕЯ«ЪЯ»ЂЯ«ЋЯ«│Я»Ї Я«цЯ«хЯ«┐Я«░)
РЌЈ Я«фЯ»єЯ«░Я»ЂЯ««Я»ЇЯ«фЯ«ЙЯ«▓Я«ЙЯ«Е Я«џЯ»ЄЯ«░Я»ЇЯ««Я«ЎЯ»ЇЯ«ЋЯ«│Я«┐Я«▓Я»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ«┐Я«ЕЯ»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«јЯ«БЯ»Ї -2
Я««Я»ЄЯ«▓Я»ЂЯ««Я»Ї Я«ЁЯ«▒Я«┐Я«еЯ»ЇЯ«цЯ»ЂЯ«ЋЯ»іЯ«│Я»ЇЯ«хЯ»ІЯ««Я»Ї
Я«фЯ«┐Я«БЯ»ѕЯ«фЯ»ЇЯ«фЯ«┐Я«▓Я»Ї Я«ЅЯ«│Я»ЇЯ«│ Я«ЄЯ«БЯ»ѕ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»ѕ Я«цЯ«ЕЯ»ЇЯ«ЕЯ»ѕ Я«еЯ»ІЯ«ЋЯ»ЇЯ«ЋЯ«┐ Я«ЋЯ«хЯ«░Я»ЇЯ«еЯ»ЇЯ«цЯ«┐Я«┤Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«цЯ«ЕЯ»ЇЯ««Я»ѕ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»Ї Я«ЋЯ«хЯ«░Я»Ї Я«цЯ«ЕЯ»ЇЯ««Я»ѕ Я«јЯ«ЕЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї.
Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«јЯ«БЯ»ЇЯ«БЯ»ѕ Я«еЯ«┐Я«░Я»ЇЯ«БЯ«»Я«┐Я«цЯ»ЇЯ«цЯ«▓Я»Ї РђЊ Я«ЋЯ«БЯ«ЋЯ»ЇЯ«ЋЯ»ђЯ«ЪЯ»ЂЯ«ЋЯ«│Я»Ї:
Я«њЯ«░Я»Ђ Я«еЯ«ЪЯ»ЂЯ«еЯ«┐Я«▓Я»ѕЯ«»Я«ЙЯ«Е Я««Я«┐Я«ЕЯ»ЇЯ«џЯ»ЂЯ««Я»ѕЯ«»Я«▒Я»ЇЯ«▒ Я««Я»ѓЯ«▓Я«ЋЯ»ЇЯ«ЋЯ»ѓЯ«▒Я«┐Я«ЕЯ»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«јЯ«БЯ»Ї Я«фЯ»ѓЯ«юЯ»ЇЯ«юЯ«┐Я«»Я««Я«ЙЯ«ЋЯ»ЂЯ««Я»Ї.
Я«хЯ«┐Я«│Я«ЋЯ»ЇЯ«ЋЯ««Я»Ї t:
H2OЯ«▓Я»Ї Я«ЅЯ«│Я»ЇЯ«│ H
Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї OЯ«ЕЯ»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«јЯ«БЯ»Ї
H
РђЊ Я«ЕЯ»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«јЯ«БЯ»Ї = +1 Я«јЯ«ЕЯ«хЯ»ЂЯ««Я»Ї,
O РђЊ Я«ЕЯ»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«јЯ«БЯ»Ї = РђЊ 2 Я«јЯ«ЕЯ«хЯ»ЂЯ««Я»Ї Я«ЋЯ»іЯ«│Я»ЇЯ«хЯ»ІЯ««Я»Ї.
H2O Я«▓Я»Ї 2
├Ќ (+1) + 1 ├Ќ (РђЊ2) = 0
2 РђЊ 2 = 0
Я«јЯ«ЕЯ»ЄЯ«х, H Я«ЕЯ»Ї Я«є.Я«јЯ«БЯ»Ї:
+1,
O Я«ЕЯ»Ї Я«є.Я«јЯ«БЯ»Ї: РђЊ2
Я«хЯ«┐Я«│Я«ЋЯ»ЇЯ«ЋЯ««Я»Ї 2:
H2SO4 Я«▓Я»Ї Я«ЅЯ«│Я»ЇЯ«│ S Я«ЕЯ»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«јЯ«БЯ»Ї
H
РђЊ Я«ЕЯ»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«јЯ«БЯ»Ї = +1
O РђЊ Я«ЕЯ»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«јЯ«БЯ»Ї =
РђЊ2
S
РђЊ Я«ЕЯ»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«јЯ«БЯ»Ї = x Я«јЯ«ЕЯ»ЇЯ«Ћ
Я«јЯ«ЕЯ«хЯ»Є, H2SO4 РђЊ Я«▓Я»Ї
2
├Ќ (+1) + (+1) + x
+ 4x(РђЊ2) = 0
(+2)
+x + (РђЊ8) = 0
x
= +6
Я«Ѓ S
Я«ЕЯ»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«јЯ«БЯ»Ї =
+6
Я«хЯ«┐Я«│Я«ЋЯ»ЇЯ«ЋЯ««Я»Ї 3:
K2
Cr2 O7 - Я«▓Я»Ї Я«ЅЯ«│Я»ЇЯ«│ Cr
Я«ЕЯ»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«јЯ«БЯ»Ї
K
РђЊ Я«ЕЯ»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«јЯ«БЯ»Ї = +1
O
РђЊ Я«ЕЯ»Ї Я«єЯ«ЋЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«јЯ«БЯ»Ї = РђЊ2
Cr
РђЊ Я«ЕЯ»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«јЯ«БЯ»Ї = x Я«јЯ«ЕЯ»ЇЯ«Ћ
Я«јЯ«ЕЯ«хЯ»Є, K2 Cr2 O7
РђЊ Я«▓Я»Ї
2
├Ќ (+1) + 2 ├Ќ (x) + 7 ├Ќ (-2) = 0
(+2)
+ 2x + (-14) = 0
2x
= 12
x
= 6
Я«Ѓ Cr
Я«ЕЯ»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«јЯ«БЯ»Ї =
+6
Я«хЯ«┐Я«│Я«ЋЯ»ЇЯ«ЋЯ««Я»Ї 4:
FeSO4
- Я«▓Я»Ї Я«ЅЯ«│Я»ЇЯ«│ Fe Я«ЕЯ»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«јЯ«БЯ»Ї
O
- Я«ЕЯ»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«јЯ«БЯ»Ї = -2
S - Я«ЕЯ»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«јЯ«БЯ»Ї =
+6
Fe
- Я«ЕЯ»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«јЯ«БЯ»Ї = x Я«јЯ«ЕЯ»ЇЯ«Ћ.
Я«јЯ«ЕЯ«хЯ»Є, FeSO4 - Я«▓Я»Ї
x
+ (+6) + 4 ├Ќ (-2) = 0
x
+ 6 РђЊ 8 = 0
x
= +2
Я«ЃFe Я«ЕЯ»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«јЯ«БЯ»Ї =
+2
Я«ЋЯ«БЯ«ЋЯ»ЇЯ«ЋЯ»ђЯ«ЪЯ»ЂЯ«ЋЯ«│Я»Ї
1. KMnO4Я«▓Я»Ї Я«ЅЯ«│Я»ЇЯ«│ Mn
Я«ЕЯ»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«јЯ«БЯ»ЇЯ«БЯ»ѕЯ«ЋЯ»Ї Я«ЋЯ«ЙЯ«БЯ»ЇЯ«Ћ.
2.
Na2Cr2O7 Я«▓Я»Ї Я«ЅЯ«│Я»ЇЯ«│ Cr Я«ЕЯ»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«јЯ«БЯ»ЇЯ«БЯ»ѕЯ«ЋЯ»Ї Я«ЋЯ«ЙЯ«БЯ»ЇЯ«Ћ.
3.
CuSO4 Я«▓Я»Ї Я«ЅЯ«│Я»ЇЯ«│ Cu
Я«ЕЯ»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«јЯ«БЯ»ЇЯ«БЯ»ѕЯ«ЋЯ»Ї Я«ЋЯ«ЙЯ«БЯ»ЇЯ«Ћ.
4. FeO Я«▓Я»Ї Я«ЅЯ«│Я»ЇЯ«│ Fe Я«ЕЯ»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«јЯ«БЯ»ЇЯ«БЯ»ѕЯ«ЋЯ»Ї Я«ЋЯ«ЙЯ«БЯ»ЇЯ«Ћ.
Я«еЯ«┐Я«ЕЯ»ѕЯ«хЯ«┐Я«▓Я»Ї Я«ЋЯ»іЯ«│Я»ЇЯ«Ћ
РЮќ Я«еЯ«┐Я«▓Я»ѕЯ«цЯ»ЇЯ«ц Я«хЯ»єЯ«│Я«┐Я«ЋЯ»ЇЯ«ЋЯ»ѓЯ«ЪЯ»ЇЯ«ЪЯ»Ђ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»Ї Я«ЁЯ««Я»ѕЯ«фЯ»ЇЯ«фЯ»ѕЯ«фЯ»Ї Я«фЯ»єЯ«▒Я»ЇЯ«▒Я»ЂЯ«│Я»ЇЯ«│Я«цЯ«ЙЯ«▓Я»Ї Я««Я«еЯ»ЇЯ«ц Я«хЯ«ЙЯ«»Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ«│Я»Ї Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»ѕ Я«ЈЯ«▒Я»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«ЁЯ«▓Я»ЇЯ«▓Я«цЯ»Ђ Я«ЄЯ«┤Я«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«цЯ«ЕЯ»ЇЯ««Я»ѕЯ«»Я»ѕЯ«фЯ»Ї Я«фЯ»єЯ«▒Я»ЇЯ«▒Я«┐Я«░Я»ЂЯ«фЯ»ЇЯ«фЯ«цЯ«┐Я«▓Я»ЇЯ«▓Я»ѕ.
РЮќ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»Ї Я«фЯ»ЂЯ«│Я»ЇЯ«│Я«┐ Я«ЁЯ««Я»ѕЯ«фЯ»ЇЯ«фЯ»Ђ Я«ЁЯ«▓Я»ЇЯ«▓Я«цЯ»Ђ Я«▓Я»ѓЯ«»Я«┐Я«ИЯ»Ї Я«фЯ»ЂЯ«│Я»ЇЯ«│Я«┐ Я«ЁЯ««Я»ѕЯ«фЯ»ЇЯ«фЯ»Ђ Я«јЯ«ЕЯ»ЇЯ«фЯ«цЯ»Ђ Я«цЯ«ЕЯ«┐Я««Я«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»Ї Я«ЋЯ»ЂЯ«▒Я«┐Я«»Я»ђЯ«ЪЯ»ЇЯ«ЪЯ»ѕ Я«јЯ«┤Я»ЂЯ«цЯ«┐, Я«ЁЯ«цЯ«ЕЯ»ѕЯ«џЯ»Ї Я«џЯ»ЂЯ«▒Я»ЇЯ«▒Я«┐ Я«ЁЯ«цЯ»ЇЯ«цЯ«ЕЯ«┐Я«« Я«ЁЯ«БЯ»ЂЯ«хЯ«┐Я«ЕЯ»Ї Я«ЄЯ«БЯ»ѕЯ«цЯ«┐Я«▒Я«ЕЯ»Ї Я«єЯ«▒Я»ЇЯ«▒Я«▓Я»Ї Я««Я«ЪЯ»ЇЯ«ЪЯ«цЯ»ЇЯ«цЯ«┐Я«▓Я»Ї Я«ЅЯ«│Я»ЇЯ«│ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»ѕ Я«фЯ»ЂЯ«│Я»ЇЯ«│Я«┐Я«ЋЯ«│Я«ЙЯ«ЋЯ«ЋЯ»Ї Я«ЋЯ»ЂЯ«▒Я«┐Я«фЯ»ЇЯ«фЯ«┐Я«ЪЯ»ЂЯ«хЯ«цЯ«ЙЯ«ЋЯ»ЂЯ««Я»Ї.
РЮќ Я«ЁЯ«БЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«│Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«ЪЯ»ѕЯ«»Я»Є Я«фЯ«▓Я«хЯ«┐Я«цЯ««Я«ЙЯ«Е Я«хЯ»ЄЯ«цЯ«┐Я«фЯ»Ї Я«фЯ«┐Я«БЯ»ѕЯ«фЯ»ЇЯ«фЯ»ЂЯ«ЋЯ«│Я»Ї Я««Я»ѓЯ«▓Я««Я»Ї Я««Я»ѓЯ«▓Я«ЋЯ»ЇЯ«ЋЯ»ѓЯ«▒Я»ЂЯ«ЋЯ«│Я»Ї Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«хЯ«цЯ«ЙЯ«▓Я»Ї Я«ЁЯ««Я»ЇЯ««Я»ѓЯ«▓Я«ЋЯ»ЇЯ«ЋЯ»ѓЯ«▒Я»ЂЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«фЯ«БЯ»ЇЯ«фЯ»ЂЯ«ЋЯ«│Я»Ї Я«хЯ»ЄЯ«цЯ«┐Я«фЯ»Ї Я«фЯ«┐Я«БЯ»ѕЯ«фЯ»ЇЯ«фЯ«┐Я«ЕЯ»Ї Я«хЯ«ЋЯ»ѕЯ«»Я»ѕЯ«фЯ»Ї Я«фЯ»іЯ«▒Я»ЂЯ«цЯ»ЇЯ«цЯ»Ђ Я«ЁЯ««Я»ѕЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е.
РЮќ Я«еЯ»ЄЯ«░Я»Ї Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«јЯ«цЯ«┐Я«░Я»Ї Я«ЁЯ«»Я«ЕЯ«┐Я«ЋЯ«│Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«ЪЯ»ѕЯ«»Я«┐Я«▓Я«ЙЯ«Е Я«еЯ«┐Я«▓Я»ѕЯ««Я«┐Я«ЕЯ»Ї Я«ЋЯ«хЯ«░Я»ЇЯ«џЯ»ЇЯ«џЯ«┐ Я«хЯ«┐Я«џЯ»ѕЯ«»Я«ЙЯ«▓Я»Ї Я«ЁЯ«»Я«ЕЯ«┐Я«фЯ»ЇЯ«фЯ«┐Я«БЯ»ѕЯ«фЯ»ЇЯ«фЯ»Ђ Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«ЄЯ«фЯ»ЇЯ«фЯ«┐Я«БЯ»ѕЯ«фЯ»ЇЯ«фЯ»Ђ Я«еЯ«┐Я«▓Я»ѕЯ««Я«┐Я«ЕЯ»Ї Я«фЯ«┐Я«БЯ»ѕЯ«фЯ»ЇЯ«фЯ»Ђ Я«јЯ«ЕЯ«хЯ»ЂЯ««Я»Ї Я«ЁЯ«┤Я»ѕЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
РЮќ Я«ЁЯ«БЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«│Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«ЪЯ»ѕЯ«»Я»Є Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»Ї Я«џЯ««Я««Я«ЙЯ«Ћ Я«фЯ«ЎЯ»ЇЯ«ЋЯ«┐Я«ЪЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«хЯ«цЯ«ЙЯ«▓Я»Ї Я«џЯ«ЋЯ«фЯ»ЇЯ«фЯ«┐Я«БЯ»ѕЯ«фЯ»ЇЯ«фЯ»Ђ Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«ЄЯ«хЯ»ЇЯ«хЯ«ЙЯ«▒Я»Ђ Я«фЯ«ЎЯ»ЇЯ«ЋЯ«┐Я«ЪЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«Ъ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»Ї Я«ЄЯ«░Я»Ђ Я«ЁЯ«БЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«│Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«фЯ»іЯ«цЯ»ЂЯ«хЯ«ЙЯ«ЋЯ«ЋЯ»Ї Я«ЋЯ«░Я»ЂЯ«цЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї. Я«ЄЯ«хЯ»ЇЯ«хЯ«ЙЯ«▒Я»Ђ Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ»ЂЯ««Я»Ї Я«фЯ«┐Я«БЯ»ѕЯ«фЯ»ЇЯ«фЯ»Ђ Я«ЁЯ«БЯ»ЂЯ«фЯ»ЇЯ«фЯ«┐Я«БЯ»ѕЯ«фЯ»ЇЯ«фЯ»Ђ Я«јЯ«ЕЯ«хЯ»ЂЯ««Я»Ї Я«ЁЯ«┤Я»ѕЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
РЮќ Я«фЯ«┐Я«БЯ»ѕЯ«фЯ»ЇЯ«фЯ«┐Я«▒Я»ЇЯ«ЋЯ»ЂЯ«цЯ»Ї Я«цЯ»ЄЯ«хЯ»ѕЯ«»Я«ЙЯ«Е Я«ЄЯ«░Я«БЯ»ЇЯ«ЪЯ»Ђ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»ѕЯ«»Я»ЂЯ««Я»Ї, Я«фЯ«┐Я«БЯ»ѕЯ«фЯ»ЇЯ«фЯ«┐Я«▓Я»Ї Я«ѕЯ«ЪЯ»ЂЯ«фЯ«ЪЯ»ЂЯ««Я»Ї Я«ЄЯ«░Я«БЯ»ЇЯ«ЪЯ»Ђ Я«ЁЯ«БЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«│Я«┐Я«▓Я»Ї Я«ЈЯ«цЯ»ЄЯ«ЕЯ»ЂЯ««Я»Ї Я«њЯ«░Я»Ђ Я«ЁЯ«БЯ»Ђ Я«хЯ«┤Я«ЎЯ»ЇЯ«ЋЯ«┐ Я«ЈЯ«▒Я»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ»ЂЯ««Я»Ї Я«фЯ«┐Я«БЯ»ѕЯ«фЯ»ЇЯ«фЯ»Ђ Я«ѕЯ«цЯ«▓Я»Ї Я«џЯ«ЋЯ«фЯ»Ї Я«фЯ«┐Я«БЯ»ѕЯ«фЯ»ЇЯ«фЯ»Ђ Я«ЁЯ«▓Я»ЇЯ«▓Я«цЯ»Ђ Я«ѕЯ«цЯ«▓Я»Ї Я«фЯ«┐Я«БЯ»ѕЯ«фЯ»ЇЯ«фЯ»Ђ Я«јЯ«ЕЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї.
РЮќ Я««Я«▒Я»ЇЯ«▒Я«хЯ«▒Я»ЇЯ«▒Я»ѕ Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я««Я»Ї Я«ЁЯ«ЪЯ»ѕЯ«»Я«џЯ»Ї Я«џЯ»єЯ«»Я»ЇЯ«фЯ«хЯ»ѕ Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я«┐Я«ЋЯ«│Я»Ї Я«јЯ«ЕЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї. Я«ЄЯ«хЯ«▒Я»ЇЯ«▒Я»ѕ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»Ї Я«ЈЯ«▒Я»ЇЯ«фЯ«┐Я«ЋЯ«│Я»Ї Я«јЯ«ЕЯ«хЯ»ЂЯ««Я»Ї Я«ЁЯ«┤Я»ѕЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«▒Я»ІЯ««Я»Ї.
РЮќ Я««Я«▒Я»ЇЯ«▒Я«хЯ«▒Я»ЇЯ«▒Я»ѕ Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ««Я»Ї Я«ЁЯ«ЪЯ»ѕЯ«»Я«џЯ»Ї Я«џЯ»єЯ«»Я»ЇЯ«фЯ«хЯ»ѕ Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«ЋЯ«│Я»Ї Я«јЯ«ЕЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї Я«ЄЯ«хЯ«▒Я»ЇЯ«▒Я»ѕ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»Ї Я«ѕЯ«ЕЯ«┐Я«ЋЯ«│Я»Ї Я«јЯ«ЕЯ«хЯ»ЂЯ««Я»Ї Я«ЁЯ«┤Я»ѕЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«▒Я»ІЯ««Я»Ї.
РЮќ Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«јЯ«БЯ»Ї Я«јЯ«ЕЯ»ЇЯ«фЯ«цЯ»Ђ Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«еЯ«┐Я«▓Я»ѕ Я«јЯ«ЕЯ«хЯ»ЂЯ««Я»Ї Я«ЁЯ«┤Я»ѕЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
A-Z Я«џЯ»іЯ«▓Я»ЇЯ«▓Я«ЪЯ»ѕЯ«хЯ»Ђ
Я«хЯ»ЄЯ«цЯ«┐Я«фЯ»Ї Я«фЯ«┐Я«БЯ»ѕЯ«фЯ»ЇЯ«фЯ»Ђ : Я«ЁЯ«БЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«│Я»Ї Я«њЯ«░Я»ЂЯ«ЎЯ»ЇЯ«ЋЯ«┐Я«БЯ»ѕЯ«еЯ»ЇЯ«цЯ»Ђ Я««Я»ѓЯ«▓Я«ЋЯ»ЇЯ«ЋЯ»ѓЯ«▒Я»Ђ Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ«ЋЯ»Ї Я«ЋЯ«ЙЯ«░Я«БЯ««Я«ЙЯ«Е Я«ЋЯ«хЯ«░Я»ЇЯ«џЯ»ЇЯ«џЯ«┐ Я«хЯ«┐Я«џЯ»ѕ.
Я«ЁЯ«»Я«ЕЯ«┐Я«фЯ»Ї Я«фЯ«┐Я«БЯ»ѕЯ«фЯ»ЇЯ«фЯ»Ђ : Я«еЯ»ЄЯ«░Я»Ї Я«ЁЯ«»Я«ЕЯ«┐ Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«јЯ«цЯ«┐Я«░Я»Ї Я«ЁЯ«»Я«ЕЯ«┐Я«ЋЯ«│Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«ЪЯ»ѕЯ«»Я»Є Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»Ї Я«фЯ«░Я«┐Я««Я«ЙЯ«▒Я»ЇЯ«▒Я«цЯ»ЇЯ«цЯ«ЙЯ«▓Я»Ї Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«хЯ«цЯ»Ђ.
Я«џЯ«ЋЯ«фЯ»ЇЯ«фЯ«┐Я«БЯ»ѕЯ«фЯ»ЇЯ«фЯ»Ђ : Я«ЁЯ«БЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«│Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«ЪЯ»ѕЯ«»Я»Є Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»Ї Я«џЯ««Я««Я«ЙЯ«Ћ Я«фЯ«ЋЯ«┐Я«░Я»ЇЯ«еЯ»ЇЯ«цЯ»Ђ Я«ЋЯ»іЯ«│Я»ЇЯ«│Я«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«хЯ«цЯ«ЙЯ«▓Я»Ї Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«хЯ«цЯ»Ђ.
Я«ѕЯ«цЯ«▓Я»Ї Я«џЯ«ЋЯ«фЯ»ЇЯ«фЯ«┐Я«БЯ»ѕЯ«фЯ»ЇЯ«фЯ»Ђ : Я«фЯ«┐Я«БЯ»ѕЯ«фЯ»ЇЯ«фЯ«┐Я«▒Я»ЇЯ«ЋЯ»ЂЯ«цЯ»Ї Я«цЯ»ЄЯ«хЯ»ѕЯ«»Я«ЙЯ«Е Я«ЄЯ«░Я«БЯ»ЇЯ«ЪЯ»Ђ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»ѕЯ«»Я»ЂЯ««Я»Ї Я«њЯ«░Я»Є Я«ЁЯ«БЯ»Ђ Я«цЯ«еЯ»ЇЯ«цЯ»Ђ Я«фЯ«┐Я«БЯ»ѕЯ«фЯ»ЇЯ«фЯ»ѕ Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ«хЯ«цЯ»Ђ.
Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я««Я»Ї : Я«њЯ«░Я»Ђ Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я«┐Я«▓Я»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ѕ Я«џЯ»ЄЯ«░Я»ЇЯ«цЯ»ЇЯ«цЯ«▓Я»Ї Я«ЁЯ«▓Я»ЇЯ«▓Я«цЯ»Ђ Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я«юЯ«ЕЯ»ѕ Я«еЯ»ђЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ«цЯ«▓Я»Ї Я«ЁЯ«▓Я»ЇЯ«▓Я«цЯ»Ђ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ѕ Я«ЄЯ«┤Я«цЯ»ЇЯ«цЯ«▓Я»Ї.
Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ««Я»Ї : Я«њЯ«░Я»Ђ Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я«┐Я«▓Я»Ї Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я«юЯ«ЕЯ»ѕ Я«џЯ»ЄЯ«░Я»ЇЯ«цЯ»ЇЯ«цЯ«▓Я»Ї Я«ЁЯ«▓Я»ЇЯ«▓Я«цЯ»Ђ Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ѕ Я«еЯ»ђЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ«цЯ«▓Я»Ї Я«ЁЯ«▓Я»ЇЯ«▓Я«цЯ»Ђ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ѕ Я«ЈЯ«▒Я»ЇЯ«▒Я«▓Я»Ї.
Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«Ћ Я«хЯ«┐Я«ЕЯ»ѕ : Я«њЯ«░Я»Є Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я«┐Я«▓Я»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я««Я»ЂЯ««Я»Ї Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ««Я»ЂЯ««Я»Ї Я«њЯ«░Я»Є Я«еЯ»ЄЯ«░Я«цЯ»ЇЯ«цЯ«┐Я«▓Я»Ї Я«еЯ«ЪЯ»ѕЯ«фЯ»єЯ«▒Я»ЂЯ«хЯ«цЯ»Ђ.
Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я«┐Я«ЋЯ«│Я»Ї : Я««Я«▒Я»ЇЯ«▒ Я«фЯ»іЯ«░Я»ЂЯ«│Я»ЇЯ«ЋЯ«│Я»ѕ Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я««Я»Ї Я«ЁЯ«ЪЯ»ѕЯ«»Я«џЯ»Ї Я«џЯ»єЯ«»Я»ЇЯ«»Я»ЂЯ««Я»Ї Я«фЯ»іЯ«░Я»ЂЯ«│Я»ЇЯ«ЋЯ«│Я»Ї.
Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«ЋЯ«│Я»Ї :
Я««Я«▒Я»ЇЯ«▒ Я«фЯ»іЯ«░Я»ЂЯ«│Я»ЇЯ«ЋЯ«│Я»ѕ Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ««Я»Ї Я«ЁЯ«ЪЯ»ѕЯ«»Я«џЯ»Ї Я«џЯ»єЯ«»Я»ЇЯ«»Я»ЂЯ««Я»Ї Я«фЯ»іЯ«░Я»ЂЯ«│Я»ЇЯ«ЋЯ«│Я»Ї.
Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«јЯ«БЯ»Ї : Я«њЯ«░Я»Ђ Я«цЯ«ЕЯ«┐Я««Я«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»Ї Я«ЁЯ«БЯ»ЂЯ«хЯ«┐Я«ЕЯ»Ї Я«ЁЯ«ЕЯ»ѕЯ«цЯ»ЇЯ«цЯ»Ђ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»ЂЯ««Я»Ї Я«ЋЯ«БЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«▓Я»Ї Я«ЋЯ»іЯ«│Я»ЇЯ«│Я«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»ЇЯ«фЯ»ІЯ«цЯ»Ђ Я«јЯ«ъЯ»ЇЯ«џЯ«┐Я«» Я««Я«┐Я«ЕЯ»ЇЯ«џЯ»ЂЯ««Я»ѕ.