பண்புகள், விளக்கம் - வேதிப்பிணைப்பின் வகைகள் | 9th Science : Chemical bonding
9 ஆம் வகுப்பு அறிவியல் : அலகு 13 : வேதிப்பிணைப்பு
வேதிப்பிணைப்பின் வகைகள்
வேதிப்பிணைப்பின் வகைகள்
அனைத்தும் தனிமங்களும் அவற்றின் இணைதிறன் எலக்ட்ரான் அமைப்பைப் பொறுத்து வேறுபடுகின்றன. எனவே அவை ஒன்றுடன் ஒன்று இணைந்து சேர்மங்களை உருவாக்கும் விதமும் வேறுபடுகின்றது. இவ்வாறாக, அணுக்கள் இணைந்து மூலக்கூறாக மாறும்போது அவற்றிற்கிடையே பல்வேறு வகையான வேதிப்பிணைப்புகள் உருவாக வாய்ப்பு உள்ளது. ஒரு மூலக்கூறில் உள்ள அவ்வகையான பிணைப்புகள் கீழ்க்கண்டவாறு வகைப்படுத்தப்படுகின்றன (படம் 13.5).
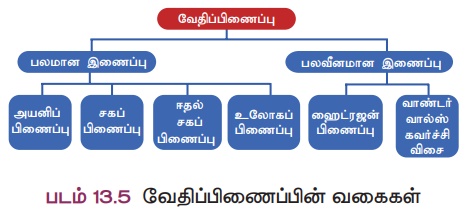
மேற்கண்டவற்றில், அயனிப்பிணைப்பு, சகப்பிணைப்பு மற்றும் ஈதல் சகப்பிணைப்பு பற்றி இப்பாடத்தில் காண்போம். மற்ற பிணைப்புகள் பற்றி உயர் வகுப்பில் காணலாம்.
1. அயனிப்பிணைப்பு
அயனிப்பிணைப்பு என்பது ஒரு நேர்மின் அயனிக்கும், எதிர்மின் அயனிக்கும் இடையே நிலைமின் ஈர்ப்பு விசையால் ஏற்படும் பிணைப்பு ஆகும். ஒரு அணுவின் இணைதிறன் கூட்டிலிருந்து ஒன்றோ அல்லது அதற்கு மேற்பட்ட எலக்ட்ரான்களோ மற்றொரு அணுவின் இணைதிறன் கூட்டிற்கு மாற்றப்படும் போது இப்பிணைப்பானது உருவாகிறது. இதில் எலக்ட்ரானை இழக்கும் அணு நேர்மின் அயனியையும், எலக்ட்ரானை ஏற்கும் அணு எதிர்மின் அயனியையும் உருவாக்குகின்றன. எதிரெதிர் மின்சுமையுள்ள இந்த இரண்டு அயனிகளும் ஒன்றையொன்று நெருங்கும்போது நிலைமின் கவர்ச்சிவிசைக்குட்பட்டு அயனிப் பிணைப்பை உருவாக்குகின்றன. இப்பிணைப்பு இரு அயனிகளுக்கிடையே உருவாவதால் அயனிப் பிணைப்பு எனவும்,
அயனிகள் நிலைமின் ஈர்ப்பு விசையால் இணைக்கப்படுவதால் நிலை மின் பிணைப்பு எனவும் அழைக்கப்படுகிறது. மேலும்,
இணைதிறன் கொள்கை எலக்ட்ரான்களை அடிப்படையாகக் கொண்டு விளக்கப்படுவதால் இது எலக்ட்ரான் இணைதிறன் பிணைப்பு எனவும் அழைக்கப்படுகிறது.
மேலும் அறிந்துகொள்வோம்
ஒரு தனிமத்தின் அணு எலக்ட்ரானிய இணைதிறன் பிணைப்பை உருவாக்கும்போது அவ்வணு இழக்கும் அல்லது ஏற்கும் எலக்ட்ரான்களின் எண்ணிக்கை அதன் எலக்ட்ரான் இணைதிறன் எனப்படுகிறது.
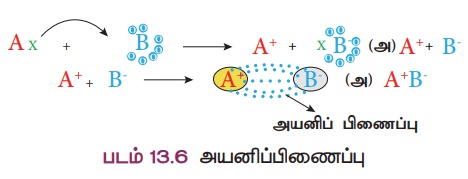
அயனிப்பிணைப்பு உருவாதல்
A
மற்றும் B
என்ற இரு அணுக்களைக் கருதுவோம். நிலையான எட்டு எலக்ட்ரான் அமைப்பை விட A
அணுவில் ஒரு எலக்ட்ரான் கூடுதலாகவும், B அணுவில் ஒரு எலக்ட்ரான் குறைவாகவும் இருப்பதாகக் கொள்வோம். அணு A
ஒரு எலக்ட்ரானை அணு B
க்கு பரிமாறும் போது இரு அணுக்களும் நிலையான
"எட்டு எலக்ட்ரான்" அமைப்பைப் பெறுகின்றன. இந்த எலக்ட்ரான் பரிமாற்றத்தால்,
அணு A
நேர்மின் அயனியாகவும், அணு B
எதிர்மின் அயனியாகவும் மாறுகின்றன. எதிரெதிர் மின்சுமை உள்ள இவ்விரு அயனிகளுக்கிடையே உருவாகும் நிலைமின் கவர்ச்சிவிசையானது அயனிகளைப்பிணைக்கிறது. இதுவே அயனிப்பிணைப்பு எனப்படுகிறது.
பொதுவாக, அயனிப்பிணைப்பு ஒரு உலோகத்திற்கும் அலோகத்திற்கும் இடையே உருவாகிறது. இவ்வாறு அயனிப்பிணைப்பைக் கொண்ட சேர்மங்கள் அயனிச்சேர்மங்கள் எனப்படுகின்றன. தனிம அட்டவணையில் முதல் தொகுதி தனிமங்கள்,
அதாவது, கார உலோகங்கள் அலோகங்களுடன் வினை புரிந்து அயனிச்சேர்மங்களை உருவாக்குகின்றன.
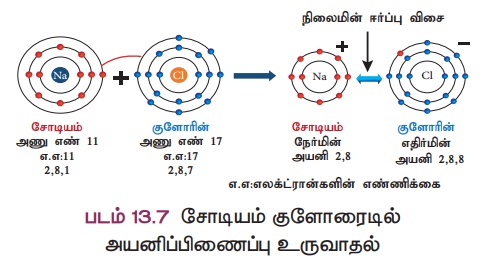
விளக்கம் 1: சோடியம் குளோரைடு (NaCl) உருவாதல்
சோடியத்தின் அணுஎண் 11 மற்றும் அதன் எலக்ட்ரான் அமைப்பு 2,8,1 ஆகும். சோடியம் அதற்கு நெருக்கமான மந்த வாயுவான நியானை விட ஒரு எலக்ட்ரான் கூடுதலாகப் பெற்றிருக்கிறது. எனவே சோடியம் ஒரு எலக்ட்ரானை இழந்து நிலையான எலக்ட்ரான் அமைப்பைக் கொண்ட சோடியம் அயனியாக (Na+) மாறவல்லது.
குளோரினின் அணுஎண் 17 மற்றும் அதன் எலக்ட்ரான் அமைப்பு 2,8,7 ஆகும். குளோரின் அதற்கு அருகே உள்ள (தனிம அட்டவணையில்) மந்த வாயுவான ஆர்கானை விட ஒரு எலக்ட்ரான் குறைவாகப் பெற்றுள்ளது. எனவே குளோரின் நிலையான எலக்ட்ரான் அமைப்பைப் பெறும் வகையில் ஒரு எலக்ட்ரானை ஏற்று குளோரைடு அயனியாக (CI) மாற வல்லது.
எனவே, சோடியம் மற்றும் குளோரின் அணுக்கள் இணையும்போது, சோடியம் அணுவிலிருந்து ஒரு எலக்ட்ரான் குளோரின் அணுவிற்கு பரிமாற்றம் செய்யப்பட்டு சோடியம் குளோரைடு மூலக்கூறு உருவாகிறது. இதன் மூலம் இரு அணுக்களும் நிலையான
"எட்டு எலக்ட்ரான்” அமைப்பைப் பெறுகின்றன (படம் 13.7).
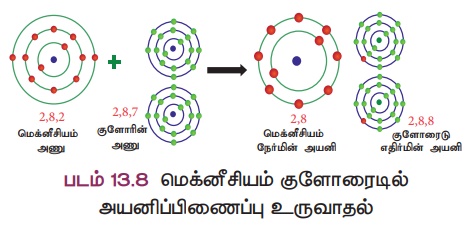
விளக்கம் 2: மக்னீசியம் குளோரைடு (MgCl2) உருவாதல்
மெக்னீசியத்தின் அணு எண் 12 மற்றும் அதன் ரான் அமைப்பு 2,8,2 ஆகும். மக்னீசியம் அதற்கு நெருக்கமான மந்த வாயுவான நியானை விட இரண்டு எலக்ட்ரான்கள் கூடுதலாகப் பெற்றிருக்கிறது. எனவே,
மக்னீசியம் அதன் வெளிக்கூட்டிலிருந்து இரண்டு எலக்ட்ரான்களை இழந்து நிலையான எலக்ட்ரான் அமைப்பைக் கொண்ட மக்னீசியம் அயனியாக (Mg2+)
மாறுகிறது.
ஏற்கனவே விளக்கியதுபோல மக்னீசியம் இழந்த இரண்டு எலக்ட்ரான்களையும் இரு குளோரின் அணுக்கள் ஏற்றுக்கொண்டு மக்னீசியம் குளோரைடு (MgCl2) மூலக்கூறை உருவாக்குகின்றன (படம் 13.8).
அயனிச்சேர்மங்களின் பண்புகள்
ஒரு மூலக்கூறில் உள்ள அணுக்களுக்கிடையேயான பிணைப்பின் தன்மையே அம்மூலக்கூறின் பண்புகளை நிர்ணயிக்கும் முக்கியக் காரணி ஆகும். அந்த வகையில்,
அயனிச்சேர்மங்களில் அணுக்கள் வலிமையான நிலைமின் கவர்ச்சி விசையால் பிணைக்கப்படுகின்றன. எனவே இப்பிணைப்பிற்குரிய கீழ்க்கண்ட பண்புகளை அயனிச்சேர்மங்கள் பெற்றிருக்கின்றன:
இயல்பு நிலை: நேர்மின் அயனி மற்றும் எதிர்மின் அயனிகள் வலிமைமிகு நிலைமின் கவர்ச்சி விசையால் பிணைக்கப்படுவதன் மூலம் உருவாகும் இச்சேர்மங்களில் அயனிகள் ஒரு முறையான வடிவ ஒழுங்கமைப்பில் அமைந்துள்ளன. எனவே அயனிச்சேர்மங்கள் அறை வெப்பநிலையில் படிகத் திண்மங்களாக உள்ளன.
மின் கடத்துத்திறன்: அயனிச்சேர்மங்கள் படிகத் திண்மங்கள் ஆகையால் அவற்றின் அயனிகள் மிகவும் நெருக்கமாக மற்றும் வலிமையாக பிணைக்கப்பட்டுள்ளன. அயனிகள் எளிதில் நகர இயலாது. எனவே திண்மநிலையில் அயனிச் சேர்மங்கள் மின்சாரத்தைக் கடத்துவதில்லை. எனினும்,
உருகிய நிலையில் அல்லது நீர்க்கரைசலில் மின்சாரத்தைக் கடத்துகின்றன.
உருகு நிலை: வலிமைமிகு நிலைமின் கவர்ச்சி விசையால் நேர்மின் மற்றும் எதிர்மின் அயனிகள் நெருக்கமாக பிணைக்கப்பட்டிருப்பதால் அவற்றைப் பிரிக்க மிக அதிக ஆற்றல் தேவைப்படுகிறது. எனவே அயனிச்சேர்மங்கள் உயர் உருகுநிலை மற்றும் கொதிநிலைகளைக் கொண்டுள்ளன.
கரைதிறன்: அயனிச்சேர்மங்கள் நீர் போன்ற முனைவுள்ள கரைப்பான்களில் கரையக் கூடியவை. பென்சீன் (C6H6) மற்றும் கார்பன் டெட்ரா குளோரைடு (CCI)
போன்ற முனைவற்ற கரைப்பான்களில் கரைவதில்லை .
அடர்த்தி, கடினத்தன்மை மற்றும் நொறுங்கும் தன்மை: அயனிச்சேர்மங்களில் வலிமையான நிலைமின் கவர்ச்சி விசையால் அயனிகள் பிணைக்கப்பட்டுள்ளதால்,
அவை அதிக கடினத் தன்மையையும், அடர்த்தியையும் கொண்டுள்ளன. ஆனால் அவை எளிதில் நொறுங்கும் தன்மை கொண்டவை.
வினைகள்: அயனிச்சேர்மங்கள்,
கண நேரத்தில் தீவிரமாக நடைபெறும் அயனி வினைகளில் ஈடுபடுவதால் அவற்றின் வினை வேகம் அதிகம்.
2. சகப்பிணைப்பு
நிலையான எலக்ட்ரான் அமைப்பைப் பெறும் வகையில் அணுக்கள் அவற்றின் வெளிக்கூட்டில் உள்ள எலக்ட்ரான்களை மற்ற அணுக்களுடன் பங்கீடு செய்து இணைகின்றன. அவ்வாறு இணையும்போது அவற்றிற்கிடையே பிணைப்பை உருவாக்கத் தேவையான இரண்டு எலக்ட்ரான்களை இரு அணுக்களும் சமமாக தலா ஒரு எலக்ட்ரான் வீதம் வழங்குகின்றன. இவ்வாறு, இரு அணுக்கள் சமமாக எலக்ட்ரான்களைப் பங்கீடு செய்து அவற்றிற்கிடையே உருவாக்கும் பிணைப்பு சகப்பிணைப்பு எனப்படுகிறது. லூயிஸ் விதிப்படி,
இரு அணுக்கள் எலக்ட்ரான்களைப் பங்கீடு செய்து சகப்பிணைப்பை உருவாக்கும்போது,
அவ்விரு அணுக்களும் நிலையான மந்தவாயு எலக்ட்ரான் அமைப்பைப் பெறுகின்றன. சகப்பிணைப்பில் இரு அணுக்களால் பங்கீடு செய்யப்படும் எலக்ட்ரான்கள் அவ்விரு அணுக்களுக்கும் பொதுவானவை ஆகையால் இது அணுப்பிணைப்பு என்றும் அழைக்கப்படுகிறது.
மேலும் அறிந்துகொள்வோம்
சகப்பிணைப்பின் மூன்று வகைகள்
1. ஒற்றை சகப்பிணைப்பைக் குறிக்க அணுக்களுக்கிடையே ஒரு கோடு
(-) பயன்படுத்தப்படுகிறது.
(எ.கா)
H - H
2. இரட்டை சகப்பிணைப்பைக் குறிக்க அணுக்களுக்கிடையே இரண்டு கோடுகள்
(=) பயன்படுத்தப்படுகின்றன.
(எ.கா)
0 = 0
3. மும்மை சகப்பிணைப்பைக் குறிக்க அணுக்களுக்கிடையே மூன்று கோடுகள்
(=) பயன்படுத்தப்படுகின்றன.
(எ.கா)
N = N
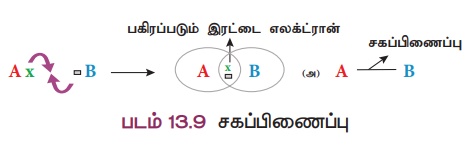
சகப்பிணைப்பு உருவாதல்
A
மற்றும் B
என இரண்டு அணுக்களைக் கருதுவோம். A
அணு தன் வெளிக்கூட்டில் ஒரு எலக்ட்ரானையும், B அணு தன் வெளிக்கூட்டில் ஏழு எலக்ட்ரானையும் பெற்றிருப்பதாகக் கொள்வோம். இவ்விரு அணுக்களும் ஒன்றையொன்று நெருங்கும்போது அவை தலா ஒரு எலக்ட்ரானை மற்றொன்றுடன் பகிர்ந்து கொள்ளும். இதனால் இரண்டு அணுக்களும் தங்கள் இணைதிறன் கூட்டில் முழுவதும் நிரம்பிய எலக்ட்ரான் அமைப்பைப் பெறுவதால் நிலைப்புத்தன்மை அதிகரிக்கிறது.
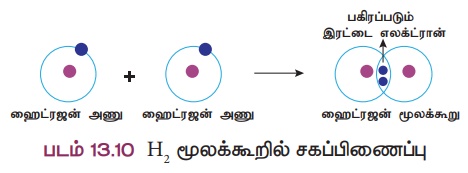
விளக்கம் 1: ஹைட்ரஜன் மூலக்கூறு உருவாதல் (H2)
இரண்டு ஹைட்ரஜன் அணுக்கள் இணைந்து H2
மூலக்கூறு உருவாகிறது. இங்கு இரண்டு ஹைட்ரஜன் அணுக்களும் தங்களின் ஒரு இணைதிறன் எலக்ட்ரானை (1s')
பங்கீடு செய்வதன் மூலம் இரண்டு ஹைட்ரஜன் அணுக்களும் ஹீலியம் அணுவை ஒத்த நிலையான எலக்ட்ரான் அமைப்பைப் பெறுகின்றன.
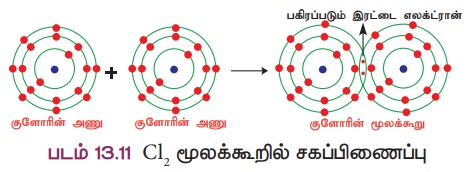
விளக்கம் 2: குளோரின் மூலக்கூறு உருவாதல் (CI2)
இரண்டு குளோரின் அணுக்கள் இணைந்து குளோரின் மூலக்கூறு உருவாகிறது. ஒவ்வொரு குளோரின் அணுவும், ஏழு இணைதிறன் எலக்ட்ரான்களைப் (2,5)
பெற்றுள்ளன. அவை தலா ஒரு எலக்ட்ரானை தங்களுக்கிடையே பங்கீடு செய்வதன் மூலம் இரண்டு குளோரின் அணுக்களும் நிலைத்த எட்டு எலக்ட்ரான் அமைப்பைப் பெறுகின்றன.
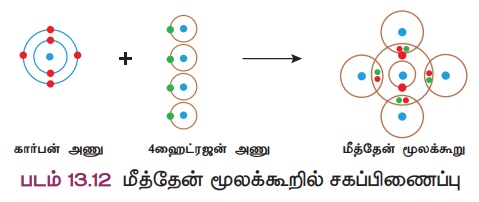
விளக்கம் 3: மீத்தேன் மூலக்கூறு உருவாதல் (CH4)
ஒரு கார்பன் அணு நான்கு ஹைட்ரஜன் அணுக்களுடன் இணைந்து மீத்தேன் மூலக்கூறு உருவாகிறது. கார்பன் அணுவில் நான்கு இணைதிறன் எலக்ட்ரான்கள் (2,4)
உள்ளன. கார்பன் இந்த நான்கு எலக்ட்ரான்களையும் நான்கு ஹைட்ரஜன் அணுக்களுடன் தலா ஒரு எலக்ட்ரான் வீதம் பகிர்ந்து கொள்கிறது. கார்பன் அணுவின் வெளிக்கூட்டில் முழுவதும் நிரம்பிய எட்டு எலக்ட்ரான் அமைப்பு உருவாவதால் நிலைப்புத்தன்மை அடைகிறது.
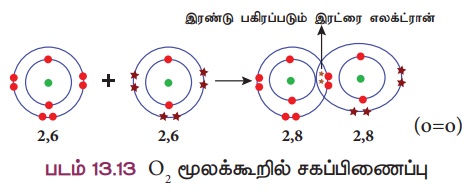
விளக்கம் 4: ஆக்ஸிஜன் மூலக்கூறு உருவாதல் (O2)
இரண்டு ஆக்ஸிஜன் அணுக்கள் இணைந்து ஆக்ஸிஜன் மூலக்கூறு உருவாகிறது. ஒவ்வொரு ஆக்ஸிஜன் அணுவும் தங்களின் வெளிக்கூட்டில் ஆறு இணைதிறன் எலக்ட்ரான்களைப் (2,6)
பெற்றுள்ளன. இரண்டு எலக்ட்ரான்களை தங்களுக்குள்ளே பங்கீடு செய்வதால் இரு அணுக்களும் நிலையான எட்டு எலக்ட்ரான் அமைப்பைப் பெறுகின்றன. எனவே ஆக்ஸிஜன் அணுக்களுக்கிடையே இரட்டைப் பிணைப்பு உருவாகிறது.
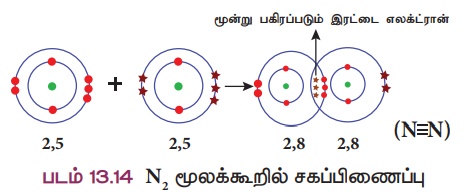
விளக்கம் 5: நைட்ரஜன் மூலக்கூறு உருவாதல் (N2)
நைட்ரஜன் மூலக்கூறு இரண்டு நைட்ரஜன் அணுக்கள் இணைவதால் உருவாகிறது. ஒவ்வொரு நைட்ரஜன் அணுவும் தங்களின் வெளிக்கூட்டில் ஐந்து இணைதிறன் எலக்ட்ரான்களைப் (2,5)
பெற்றுள்ளன. அவ்விரு நைட்ரஜன் அணுக்களும் தலா மூன்று எலக்ட்ரான்களை தங்களுக்குள்ளே பங்கீடு செய்வதால் இரு அணுக்களும் நிலையான எட்டு எலக்ட்ரான் அமைப்பைப் பெறுகின்றன. எனவே நைட்ரஜன் அணுக்களுக்கிடையே மூன்று பிணைப்பு உருவாகிறது.
சகப்பிணைப்புச் சேர்மங்களின் பண்புகள்
சேர்மங்களின் பண்புகள் அவற்றில் உள்ள அணுக்களுக்கிடையான பிணைப்பின் தன்மையைப் பொறுத்தே அமையும் என நாம் அறிவோம். சகப்பிணைப்பு மூலம் உருவான சகப்பிணைப்புச் சேர்மங்கள் அயனிச்சேர்மங்களின் பண்புகளிலிருந்து முற்றிலும் மாறுபடுகின்றன.
இயற்பியல் நிலைமை: சகப்பிணைப்புச் சேர்மங்களின் மூலக்கூறுகளுக்கு இடையே நிலவும் கவர்ச்சி விசையைப் பொறுத்து அவற்றின் பிணைப்பு வலிமையாகவோ அல்லது வலிமையற்றதாகவோ இருக்கலாம். எனவே சகப்பிணைப்புச் சேர்மங்கள் வாயு நிலையிலோ,
நீர்ம நிலையிலோ அல்லது மென்மையான திண்மங்களாகவோ இருக்கின்றன. எ.கா: ஆக்ஸிஜன்-வாயு, நீர் -
நீர்மம், வைரம் -
திண்மம்.
மின்கடத்துத் திறன்: சகப்பிணைப்புச் சேர்மங்களில் அயனிகள் இல்லை .
எனவே இவை மின்சாரத்தைக் கடத்துவதில்லை.
உருகுநிலை: வைரம், சிலிகன் கார்பைடு போன்ற ஒரு சில சகப்பிணைப்புச் சேர்மங்களைத் தவிர மற்றவை அயனிச்சேர்மங்களை விட குறைந்த உருகுநிலையைப் பெற்றுள்ளன.
கரைதிறன்: சகப்பிணைப்புச் சேர்மங்கள் பென்சீன் (C6H6),
கார்பன் டெட்ரா குளோரைடு (CCI4)
போன்ற முனைவற்ற கரைப்பான்களில் எளிதில் கரையும். நீர் போன்ற முனைவுள்ள கரைப்பான்களில் எளிதில் கரைவதில்லை .
கடினத்தன்மையும் நொறுங்கும் தன்மையும்: சகப்பிணைப்புச் சேர்மங்கள் கடினத்தன்மை அற்றவையாகவும், நொறுங்கும் தன்மை அற்றவையாகவும் உள்ளன. இவை மென்மையான திண்மங்களாகக் காணப்படுகின்றன.
வினைபடுதிறன்: சகப்பிணைப்புச் சேர்மங்கள் மூலக்கூறு வினைகளில் ஈடுபடுவதால் இவற்றின் வினைவேகம் குறைவு.
மேலும் அறிந்துகொள்வோம்
வேறுபட்ட எலக்ட்ரான் கவர்தன்மை கொண்ட ஆக்ஸிஜன் மற்றும் ஹைட்ரஜன் போன்ற அணுக்கள் இணைவதால் முனைவுள்ள கரைப்பான்கள் உருவாகின்றன.
எ.கா:
நீர், எத்தனால், அசிட்டிக் அமிலம், அம்மோனியா.
அயனிச்சேர்மங்கள் இத்தகைய கரைப்பான்களில் எளிதில் கரைகின்றன.
எலக்ட்ரான் கவர் தன்மையில் குறைந்த அளவே வேறுபாடு கொண்ட கார்பன் மற்றும் ஹைட்ரஜன் போன்ற அணுக்கள் இணைவதால் முனைவற்ற கரைப்பான்கள் உண்டாகின்றன.
எ.கா:
அசிட்டோன், பென்சீன், டொலுவீன், டர்பன்டைன்.
சகப்பிணைப்புச் சேர்மங்கள் இத்தகைய கரைப்பான்களில் கரைகின்றன.
ஃபஜானின் விதி
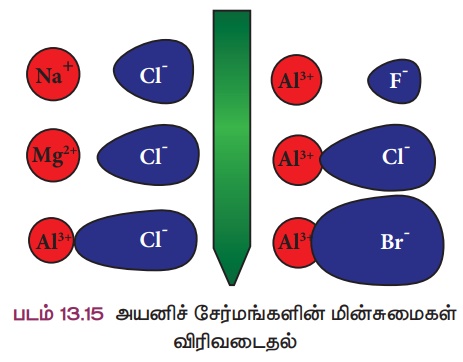
உலோகம் அயனிப்பிணைப்பு மூலம் அலோகங்களோடு இணைகிறது. அவ்வாறு இணையும் போது அவை அயனிச் சேர்மங்களைத் தருவதை நாம் அறிவோம். ஒரு சேர்மத்திலுள்ள அணுக்கள் நேர் மற்றும் எதிர் மின்சுமை கொண்ட அயனிகளாக முற்றிலுமாக பிரிவுறுதல் முனைவுறுதல் எனப்படும். அவ்வாறு முனைவுற்ற சேர்மங்கள் அயனிச்சேர்மங்கள் எனப்படுகின்றன.
1923 ஆம் ஆண்டு ஃபஜான் என்ற அறிவியல் அறிஞர் X- கதிர் படிகநிறமானி ஆய்வுகளின் அடிப்படையில் ஒரு சில அயனிச் சேர்மங்கள், சகப்பிணைப்புச் சேர்மங்களின் பண்புகளைப் பெற்றிருப்பதைக் கண்டறிந்தார். இந்த ஆய்வுகளின் அடிப்படையில் அவர் ஒரு சேர்மம் அயனிப்பிணைப்பைப் பெற்றுள்ளதா அல்லது சகப் பிணைப்பைப் பெற்றுள்ளதா என்பதை ஒரு சில காரணிகளைக் கொண்டு கண்டறிய ஒரு விதிமுறையை உருவாக்கினார். இவ்வழிமுறைகள் ஃபஜான் விதி எனப்படுகின்றன. ஃபஜானின் விதி நேர்மின் அயனியின் மின் சுமையையும்,
நேர் மற்றும் எதிர் மின் அயனிகளின் உருவ அளவையும் தொடர்பு படுத்துகிறது.
● நேர்மின் அயனியின் உருவ அளவு சிறியதாகவும்,
எதிர்மின் அயனியின் உருவ அளவு பெரியதாகவும் இருந்தால், பிணைப்பு சகப்பிணைப்புத் தன்மை பெறும்.
● நேர்மின் அயனியின் மின்சுமை அதிகரிக்க அதிகரிக்க சகப்பிணைப்புத் தன்மை அதிகரிக்கும்.

உதாரணத்திற்கு, சோடியம் குளோரைடைக் கருதுவோம். சோடியத்தின் மின்சுமை
(+1)
குறைவாகவும் அதன் உருவ அளவு பெரியதாகவும் மற்றும் குளோரின் எதிர்மின் அயனியின் உருவ அளவு சிறியதாகவும் உள்ளதால், மின்சுமைகள் எளிதில் பிரிவடைகின்றன. ஆனால் அலுமினியம் டிரை அயோடைடில், அலுமினியத்தின் மின்சுமை அதிகம்
(+3)
மற்றும் அதன் உருவ அளவு சிறியது. அயோடைடு அயனி அலுமினியம் அயனியை விட உருவ அளவில் பெரியது. எனவே அவற்றிற்கிடையான மின்சுமை பிரிகையடைந்து முனைவுறுதல் நடைபெறுவதில்லை . ஆகவே அலுமினியம் டிரை அயோடைடு ஒரு சகப்பிணைப்புச் சேர்மம் ஆகும். பின்வரும் படம் அயனிச் சேர்மங்களின் முனைவுறும் தன்மையை எளிமையாக விளக்குகிறது.
3. ஈதல் சகப்பிணைப்பு உருவாதல்
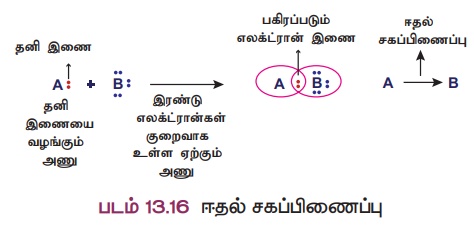
எளிய சகப்பிணைப்பு உருவாதலின் போது, பிணைப்பில் ஈடுபடும் இரு அணுக்களும் தலா ஒரு எலக்ட்ரான் வீதம் பங்கீடு செய்து பிணைப்பை உருவாக்குகின்றன. எனினும்,
ஒரு சில சேர்மங்களில் சகப்பிணைப்பு உருவாகத் தேவையான இரு எலக்ட்ரான்களையும் பிணைப்பில் ஈடுபடும் ஏதேனும் ஒரு அணு வழங்கி,
பிணைப்பை உருவாக்குகிறது. இத்தகைய பிணைப்பு ஈதல் சகப்பிணைப்பு (அ) ஈதல் பிணைப்பு எனப்படுகிறது.
ஈதல் பிணைப்பில் ஈடுபடும் எலக்ட்ரான்கள் தனி இரட்டை (lone
pair) எனப்படுகின்றன. தனி இரட்டை எலக்ட்ரான்களை வழங்கும் அணு 'ஈனி அணு' எனவும், அவற்றை ஏற்கும் அணு 'ஏற்பி அணு' எனவும் அழைக்கப்படுகிறது. ஈதல் சகப்பிணைப்பு,
ஈனி அணுவிலிருந்து ஏற்பி அணுவிற்கு வரையப்படும் அம்புக்குறி
(-) மூலம் குறிக்கப்படுகிறது.
ஈதல் சகப்பிணைப்பு உருவாதல்
A
மற்றும் B
என்ற இரு அணுக்களைக் கருதுவோம். A
அணுவில் பங்கிடப்படாத தனி இரட்டை எலக்ட்ரான்கள் இருப்பதாகவும், B அணுவில் நிலையான எட்டு எலக்ட்ரான் அமைப்பிற்கு இரண்டு எலக்ட்ரான்கள் குறைவாக இருப்பதாகவும் கொள்வோம். இப்போது A
அணு தன் வசம் உள்ள தனி இரட்டை எலக்ட்ரான்களை அணு B
க்கு வழங்கி பிணைப்பை உருவாக்குகிறது. பிணைப்பில் உள்ள இரு எலக்ட்ரான்களையும் A
அணு வழங்கியிருந்த போதும் அவற்றை A
மற்றும் B
ஆகிய இரண்டு அணுக்களும் சமமாகப் பங்கிட்டுக்கொள்கின்றன. இவ்வாறு உருவாகும் பிணைப்பு ஈதல் சகப்பிணைப்பு (A → B) எனப்படுகிறது. எ.கா. NH3
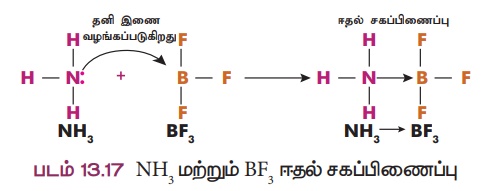
→ BF3
விளக்கம் 1: NH3 → BF3 மூலக்கூறு இடையே சகப்பிணைப்பு உருவாதல்
ஒரு சில சேர்மங்களில் ஈதல்சகப்பிணைப்பானது ஒரு மூலக்கூறு,
தனித்த இணை எலக்ட்ரான்களை மற்றொரு மூலக்கூறிற்கு வழங்குவதால் உருவாகிறது. எடுத்துக்காட்டாக அம்மோனியா மூலக்கூறு (NH3) தனித்த இணை எலக்ட்ரான்களை போரான் டிரை புளூரைடு (BF3)
மூலக்கூறிற்கு வழங்கி ஈதல் சகப்பிணைப்பை உருவாக்குகிறது (NH3
→ BF3). இங்கு NH3 ஈனி மூலக்கூறாகவும் BF3
ஏற்பி மூலக்கூறாகவும் உள்ளன.
ஈதல் சகப்பிணைப்புச் சேர்மங்களின் பண்புகள்
இயற்பியல் நிலைமை: இச்சேர்மங்கள் வாயுநிலை, நீர்ம நிலை மற்றும் திண்ம நிலைகளில் காணப்படுகின்றன.
மின்கடத்துத் திறன்: சகப்பிணைப்புச் சேர்மங்களைப் போலவே, ஈதல் சகப்பிணைப்புச் சேர்மங்களிலும் அயனிகள் இல்லை .
எனவே, இவை அரிதில் மின்கடத்திகள் ஆகும்.
உருகுநிலை: ஈதல் சகப்பிணைப்புச் சேர்மங்களின் உருகுநிலை மற்றும் கொதிநிலை சகப்பிணைப்புச் சேர்மங்களை விட அதிகமாகவும் அயனிச் சேர்மங்களை விட குறைவாகவும் காணப்படுகின்றன.
கரைதிறன்: நீர் போன்ற முனைவுள்ள கரைப்பான்களில் மிகச்சிறிதளவே கரையும் அல்லது கரைவதில்லை. பென்சீன், டொலுவீன், கார்பன் டெட்ரா குளோரைடு போன்ற முனைவற்ற கரைப்பான்களில் எளிதில் கரைகிறது.
வினைபடுதிறன்: இச்சேர்மங்கள் மெதுவான மூலக்கூறு வினைகளில் ஈடுபடுகின்றன.