வேதிப்பிணைப்பு | வேதியியல் | அறிவியல் - பின்வரும் கேள்விகளுக்கு விடையளிக்க | 9th Science : Chemistry : Chemical Bonding
9 ஆம் வகுப்பு அறிவியல் : அலகு 13 : வேதிப்பிணைப்பு
பின்வரும் கேள்விகளுக்கு விடையளிக்க
II. சுருக்கமாக விடையளி
1.
தனிமங்கள்
எவ்வாறு
மந்த
வாயுக்களின்
எலக்ட்ரான்
அமைப்பிற்கு
மாறுகின்றன?
விடை :
• மந்த வாயுக்கள் தவிர மற்ற தனிம அணுக்கள் முழுவதும் நிரப்பப்படாத இணைதிறன் கூட்டைப் பெற்றிருக்கின்றன.
• ஒரு அணு அதன் இணைதிறன் எலக்ட்ரான்களை இழந்து அல்லது பங்கீடு செய்து இணைவதன் மூலம் நிலையான மந்த வாயுக்களின் எலக்ட்ரான் அமைப்பைப் பெறுகின்றன.
2.
CCl4 நீரில்
கரைவதில்லை
. ஆனால்
NaCl நீரில்
கரைகிறது,
காரணம்
கூறு.
விடை :
• CCl4 : கார்பன் டெட்ரா குளோரைடு ஒரு முனைவற்ற சகப்பிணைப்பு மூலக்கூறு ஆகும்.
• சகப்பிணைப்பு சேர்மங்கள் நீர் (H2O) போன்ற முனைவுள்ள கரைப்பான்களில் இவை எளிதில் கரைவதில்லை.
• NaCl: சோடியம் குளோரைடு ஒரு அயனி மூலக்கூறு ஆகும்.
• அயனிச் சேர்மங்கள் நீர் போன்ற முனைவுள்ள கரைப்பான்களில் கரையக் கூடியன.
3.
எண்ம
விதியை
எடுத்துக்காட்டுடன்
கூறுக.
விடை :
• எண்ம விதி: ஒரு அணுவானது மற்றொரு அணுவிடம் அதன் இணைதிறன் கூடு எலக்ட்ரான்களை இழந்தோ (அல்லது) பங்கீடு செய்தோ இணைதிறன் கூட்டில் 8 எலக்ட்ரான்களைப் பெற்றிருக்கும் விளைவு எட்டு (8) எலக்ட்ரான் விதி (அ) எண்ம விதி ஆகும்.
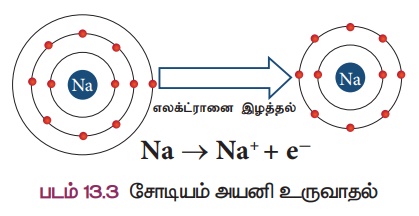
• உம். சோடியத்தின் (Na) அணு எண் 11 மற்றும் எலக்ட்ரான் அமைப்பு 2, 8, 1
• Na அதன் இணைதிறன் கூட்டிலிருந்து ஒரு எலக்ட்ரானை எளிதில் இழந்து நியான் Ne - அணுவின் எலக்ட்ரான்
அமைப்பை 2, 8பெறுகிறது.
4.
பிணைப்பின்
வகைகள்
யாவை?
விடை :
5.
தவறான
கூற்றைக்
கண்டறிந்து
அவற்றைச்
சரி
செய்க.
அ) அயனிச் சேர்மங்கள் முனைவற்ற கரைப்பான்களில் கரையும்.
ஆ) சகப்பிணைப்புச் சேர்மங்கள் உருகிய நிலையிலும், கரைசல் நிலையிலும் மின்சாரத்தைக் கடத்தும்.
விடை :
அ. அயனிச் சேர்மங்கள் முனைவுள்ள கரைப்பான்களில் கரையும்.
ஆ. அயனிச் சேர்மங்கள் உருகிய நிலையிலும், கரைசல் நிலையிலும் மின்சாரத்தைக் கடத்தும்.
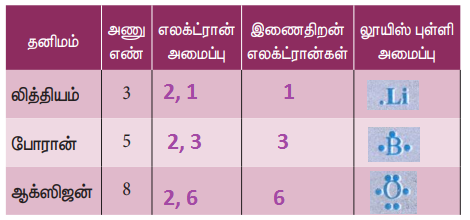
6.
அட்டவணையை
நிரப்புக
விடை :
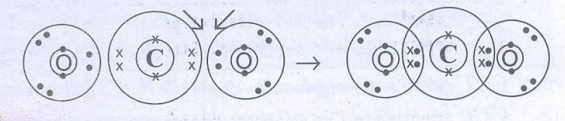
7. கார்பன்-டை-ஆக்சைடு (CO2) உருவாதல் வினையின் எலக்ட்ரான் அமைப்பை வரைக.
விடை :
• C ன் எலக்ட்ரான் அமைப்பு = 2,4
• O ன் எலக்ட்ரான் அமைப்பு = 2,6
8.
கீழ்க்கண்ட
மூலக்கூறுகளில்
உள்ள
பிணைப்பின்
வகையின்
அடிப்படையில்
அட்டவணையை
நிரப்புக.
CaCl2,
H2O, CaO, CO, KBr, HCI, CCl4, HF, CO2, Al2Cl6
விடை :
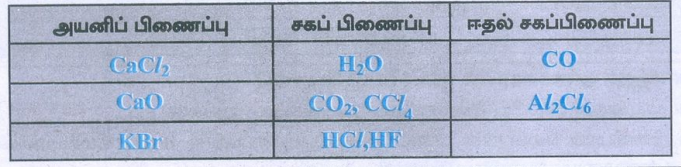
அயனிப் பிணைப்பு
Cacl2
Cao
KBr
சகப் பிணைப்பு
H2O
CO2, CCl4,
HCl,HF
ஈதல் சகப்பிணைப்பு
CO2
Al2CI6
9.
சரியாகப்
பொருந்துவதைத்
தேர்ந்தெடு
அயனிச் சேர்மங்களின் பொதுவான பண்புகள்
அ) இவை அறை வெப்பநிலையில் வாயுக்கள்
ஆ) இவை கடினமான மற்றும் நொறுங்கும் தன்மை கொண்டவை.
இ) இவை மூலக்கூறு வினைகளுக்குட்படுகிறது,
ஈ) இவற்றின் உருகுநிலை குறைவு.
விடை :
ஆ) இவை கடினமான மற்றும் நொறுங்கும் தன்மை கொண்டவை.
10.
கீழ்க்கண்ட
வினைகள்
ஆக்ஸிஜனேற்ற
/ ஒடுக்க
வினைகளா
எனக்
காண்க.
அ) Na à
Na+ + e-
ஆ) Fe3+ + 2e-
à
Fe+
விடை :
அ) ஆக்ஸிஜனேற்றம்
ஆ) ஒடுக்கம்
11.
கொடுக்கப்பட்ட
பண்புகளின்
அடிப்படையில்
சேர்மங்களின்
வகையைக்
கண்டறிக.
(அயனி / சக / ஈதல் சகப்பிணைப்பு)
அ) முனைவற்ற கரைப்பான்களில் கரையும்
ஆ) வினையின் வேகம் மிக அதிகம்
இ) மின்சாரத்தைக் கடத்துவதில்லை
ஈ) அறை வெப்பநிலையில் திண்மங்கள்
விடை :
அ) சகப்பிணைப்பு, ஈதல் பிணைப்பு
ஆ) அயனிப்பிணைப்பு
இ) சகப்பிணைப்பு, ஈதல் சகப்பிணைப்பு
ஈ) அயனிப்பிணைப்பு
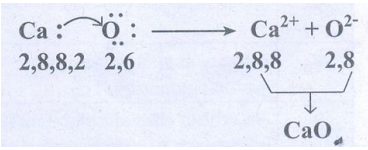
12. அணு எண் 20 கொண்ட × என்ற தனிமம், அணு எண் 8 கொண்ட Y என்ற தனிமத்துடன் இணைந்து ×Y என்ற மூலக்கூறை உருவாக்குகிறது என்க. ×Y மூலக்கூறு உருவாதலின் புள்ளி அமைப்பு வரைபடம் வரைக.
விடை :
அணு எண் 20 கொண்ட தனிமம் × = கால்சியம் (Ca)
அணு எண் 8 கொண்ட தனிமம் Y = ஆக்ஸிஜன் (0)
13.
MgCl, வை
அயனிச்சேர்மமாகவும்
CH, ஐ
சகப்பிணைப்புச்
சேர்மமாகவும்
கொண்டு,
இவ்விரு
சேர்மங்களுக்கும்
உள்ள
ஏதேனும்
இரண்டு
வேறுபாடுகளை
எழுதுக.
விடை :
MgCl2 அயனிச்சேர்மம்:
1. மெக்னீசியம் இதன் வெளிக் கூட்டில் இரண்டு எலக்ட்ரான்களை கூடுதலாகப் பெற்றிருக்கிறது
2. எனவே மெக்னீசியம் அதன் வெளிக்கூட்டிலிருந்து இரண்டு எலக்ட்ரான்களை இழந்து நிலையான எலக்ட்ரான் அமைப்பைக்
கொண்ட மெக்னீசியம் அயனியாக மாறுகிறது.
3. MgCl2, நீரில் கரையும்
CH4 சகப்பிணைப்புச் சேர்மம்:
1. கார்பன் அணு நான்கு இணைதிறன் எலக்ட்ரான்களைப் பெற்றுள்ளன. நிலையான எலக்ட்ரான் அமைப்பைப் பெற 4e-1 தேவைப்படுகிறது.
2. கார்பன் அணு 4 எலட்ரான்களை ஹைட்ரஜனுடன் பகிர்ந்து கொண்டு நிலைப்புத் தன்மையை அடைகிறது.
3. CH4 நீரில் கரைவதில்லை
14.
மந்த
வாயுக்கள்
ஏன்
மந்தத்
தன்மையுடன்
காணப்படுகின்றன?
விடை :
• மந்த வாயு அணுக்கள் முழுவதும் நிரம்பிய இணைதிறன் கூட்டைப் பெற்றுள்ளது.
• இணைதிறன் கூட்டில் நிலையான எலக்ட்ரான் அமைப்பைப் பெற்றிருப்பதால் அவை எலக்ட்ரான்களை இழக்கும் (அ) ஏற்கும் தன்மையைப் பெற்றிருப்பதில்லை.
• எனவே அவற்றின் இணைதிறன் 0 (பூஜ்ஜியம்). இதனால் இவ்வணுக்கள் மந்தத் தன்மையுடன் காணப்படுகிறது.
III. விரிவாக விடையளி
1.
அயனிச்
சேர்மங்களுக்கும்
சகப்பிணைப்புச்
சேர்மங்களுக்கும்
இடையே
உள்ள
வேறுபாடுகளை
அட்டவணைப்படுத்துக.
விடை :
அயனிச் சேர்மங்கள்:
1. உலோக அணுவிலிருந்து அலோக அணுவிற்கு ஒரு எலக்ட்ரான் இடம் பெயர்வதால் உருவாகின்றன
2. நேர் மற்றும் எதிர் அயனிகளுக்கிடையே வலிமையான நிலைமின் கவர்ச்சி விசை உள்ளது.
3. அறை வெப்பநிலையில் திண்மங்கள்
4. உருகிய நிலையிலும் கரைசல் நிலையிலும் மின்சாரத்தைக் கடத்தும்
5. உருகுநிலையும், கொதிநிலையும் அதிகம்
6. முனைவுள்ள கரைப்பான்களில் கரையும்
7. கடினமானது, நொறுங்கும் தன்மையுடையது,
8. அயனிகள் வினைகளில் பங்கேற்பதால் வினைகள் உடனடியாகவும், மிக வேகமாகவும் நடைபெறும்.
சகப்பிணைப்புச் சேர்மங்கள்:
1. அலோக அணுக்களுக்கிடையே எலக்ட்ரான்கள் பங்கிடப்படுவதால் உருவாகின்றன.
2. எலக்ட்ரான்களின் பகிர்வு, எனவே, அணுக்களுக்கிடையே வலிமை குறைந்த கவர்ச்சி விசை உள்ளது.
3. வாயுக்கள், நீர்மங்கள், மென்மையான திண்மங்கள்
4. கடத்துவதில்லை
5. குறைவு
6. முனைவற்ற கரைப்பான்களில் கரையும்.
7. மென்மையானது, மெழுகுத்தன்மையுடையது.
8. மூலக்கூறுகள் வினைகளில் பங்கேற்பதால் வினையின் வேகம் குறைவு.
2.
கீழ்
உள்ள
கூற்றுகள்
ஒவ்வொன்றிற்கும்
ஓர்
எடுத்துக்காட்டு
தருக.
அ) இரண்டு சகப்பிணைப்பு உள்ள ஒரு சேர்மம்.
ஆ) ஒரு அயனிப் பிணைப்பு உள்ள ஒரு சேர்மம்.
இ) இரண்டு சகப்பிணைப்பும், ஒரு ஈதல் சகப்பிணைப்பும் உள்ள ஒரு சேர்மம்.
ஈ) மூன்று சகப்பிணைப்பு உள்ள ஒரு சேர்மம்.
விடை :
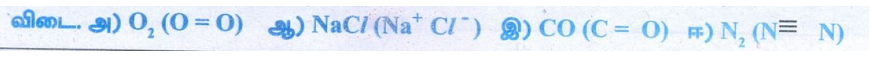
அ) O2
(O = O)
ஆ)
NaCl (Na+Cl-)
இ)
CO (C = O)
ஈ)
N2 (N ≡ N)
3.
தவறான
கூற்றைக்
கண்டறிந்து
சரி
செய்க.
அ) சகப்பிணைப்புச்
சேர்மங்களைப்
போலவே,
ஈதல்
சகப்பிணைப்புச்
சேர்மங்களும்
மின்
சுமை
கொண்ட
(அயனிகள்) துகள்களைப் பெற்றுள்ளன.
எனவே
அவை
நல்ல
மின்கடத்திகள்.
விடை :
தவறு
சகப்பிணைப்புச் சேர்மங்களைப் போலவே, ஈதல் சகப்பிணைப்புச் சேர்மங்களும் மின்சுமை அற்ற (அயனிகள்) துகள்களைப் பெற்றுள்ளன. எனவே அவைஅரிதில் மின்கடத்திகள் ஆகும்.
ஆ) ஹைட்ரஜன் பிணைப்புடன் ஒப்பிடும் போது அயனிப் பிணைப்பு வலிமை குறைந்த பிணைப்பு ஆகும்.
விடை :
தவறு
ஹைட்ரஜன் பிணைப்புடன் ஒப்பிடும்போது அயனிப் பிணைப்புவலிமை மிகுந்த பிணைப்பு ஆகும்.
இ) அயனிப் பிணைப்பு எலக்ட்ரான்களை
சமமாக
பங்கீடு
செய்வதால்
உருவாகிறது.
விடை :
தவறு
சகப் பிணைப்பு எலக்ட்ரான்களை சமமாக பங்கீடு செய்வதால் உருவாகிறது.
ஈ) எலக்ட்ரான் இழப்பு ஆக்ஸிஜனேற்றம்
என்றும்,
எலக்ட்ரான்
ஏற்பு
ஒடுக்கம்
என்றும்
அழைக்கப்படுகிறது.
விடை :
சரி
உ) பிணைப்பில் ஈடுபடாத எலக்ட்ரான்களை
இணைதிறன்
எலக்ட்ரான்கள்
என்கிறோம்.
விடை :
தவறு
பிணைப்பில் ஈடுபடும் எலக்ட்ரான்களை இணைதிறன் எலக்ட்ரான்கள் என்கிறோம்.
4.
ஈதல்
சகப்பிணைப்புச்
சேர்மங்களின்
பண்புகளை
விவரி.
விடை :
1. இயற்பியல் தன்மை : வாயுநிலை, நீர்மநிலை மற்றும் திண்மநிலையில் உள்ளன.
2. மின்கடத்துத்திறன் : இச்சேர்மங்களில் அயனிகள் இல்லை. எனவே இவை அரிதில் மின்கடத்திகள் ஆகும்.
3. உருகுநிலை : இச்சேர்மங்களின் உருகுநிலை மற்றும் கொதிநிலை சகப்பிணைப்புச் சேர்மங்களை விட அதிகமாகவும் அயனிச்சேர்மங்களை விட குறைவாகவும் உள்ளன.
4. கரைதிறன்: நீர் போன்ற முனைவுள்ள கரைப்பான்களில் மிகச்சிறிதளவே கரையும் (அ) கரைவதில்லை.
பென்சீன், டொலுவீன், கார்பன் டெட்ரா குளோரைடு போன்ற முனைவற்ற கரைப்பான்களில் எளிதில் கரைகிறது.
5. வினைபடுதிறன்.. மெதுவான மூலக்கூறு வினைகளில் ஈடுபடுகின்றன.
5.
பின்வரும்
சேர்மங்களில்
உள்ள
குறிப்பிட்ட
தனிமத்தின்
ஆக்ஸிஜனேற்ற
எண்ணைக்
கணக்கிடுக.
அ) CO2 ல் உள்ள C
ஆ) MnSO4 ல் உள்ள Mn
இ) HNO) ல் உள்ள N
விடை :
அ) கார்பனின் (C) ஆக்சிஜனேற்ற எண் = ×
ஆக்சிஜனின் (O2)ஆக்சிஜனேற்ற எண் = -2
C + O2 = 0
X + 2 (-2) = 0
X - 4 = 0
ஃ x = +4
C - யின் ஆக்ஸிஜனேற்ற எண் = 4
ஆ)
Mn - ஆக்சிஜனேற்ற எண் = x
S - ஆக்சிஜனேற்ற எண் = 6
O4 - ஆக்சிஜனேற்ற எண் = -2
Mn + S +O4 =0
x + 6 + (-2 × 4) = 0
x + 6 + (-8) = 0
x – 2 = 0
ஃ x = +2
Mn - ன் ஆக்சிஜனேற்ற எண் = 2
இ)
H - ஆக்சிஜனேற்ற எண் = + 1
0 - ஆக்சிஜனேற்ற எண் = -2
N - ஆக்சிஜனேற்ற எண் = x
+ 1 + x + 3 (-2) = 0
+1 + x – 6 = 0
x - 5 = 0
x = +5
N - ன் ஆக்சிஜனேற்ற எண் = + 5
பிற நூல்கள்
1.
Modern Inorganic Chemistry -by R.D. Madan
2.
Te×tbook of Inorganic Chemistry -By Soni, P.L. and Mohan Katyal.
இணைய வளங்கள்
https://www.youtube.com/watch?v
=tEwp2filmpl
https://youtu.be/gjWZ8nHn59Y
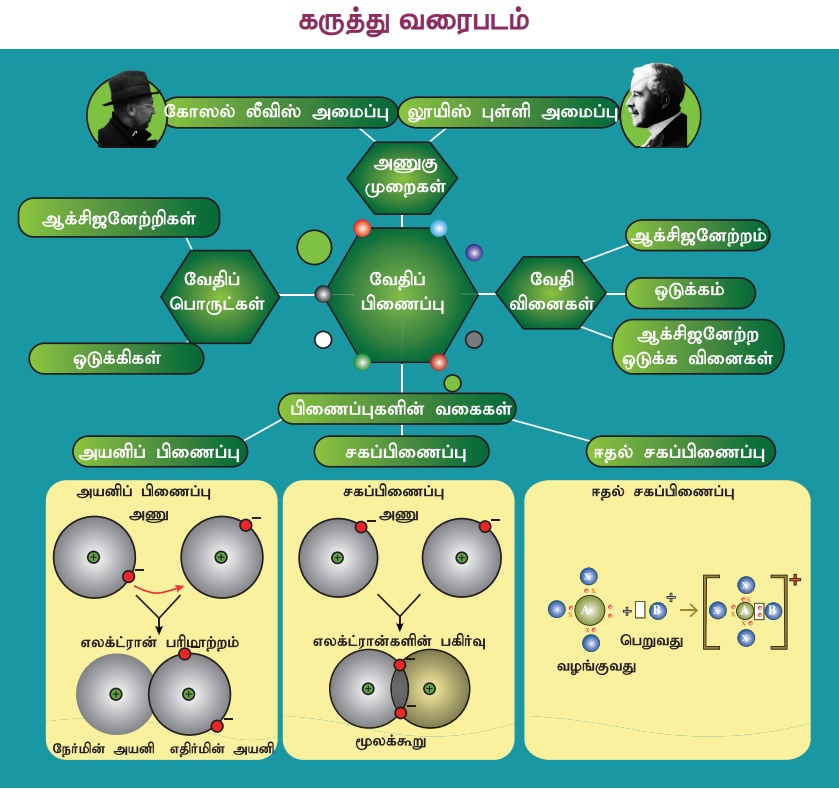
கருத்து வரைபடம்
இணையச்செயல்பாடு
வேதிப்பிணைப்பு
கலவைகளில் உள்ள பல்வேறு வகையான வேதிப்பிணைப்புகளை அறியவும்,
வேதிக் குறியீடுகளைக் கற்றுக் கொள்ளவும் பின்வரும் செயல்பாடினைச் செய்து பார்க்க
படி 1.
கீழ்க்காணும் உரலி விரைவுக் குறியீட்டைப் பயன்படுத்திச் செயல்பாட்டின் இணையப் -பக்கத்திற்குச் செல்க.
படி 2.
ஒப்புருவாக்கப் பகுதியில், சுட்டியைக் கீழுருட்டி, 'lonic & Covalent
Bonding' என்ற விருப்பத்தேர்வினைத் தேர்ந்தெடுத்துக் கொள்ளவும்.
படி 3.
தனிம வரிசை அட்டவணையில், சுட்டிக்காட்டப்பட்ட ஏதேனும் இரு தனிமங்களைத் தேர்ந்தெடுத்துக் கொள்ளவும்
படி 4.
அவ்வாறு தேர்ந்தெடுத்த பின்னர், இருவேறு விருப்பத்தேர்வுகள் ( lonic
Bond Or Covalent Bond) திரையில் தோன்றும். அதில்,
ஏதேனும் ஒரு விருப்பத்தேர்வினைச் சொடுக்கி,
அணுக்களின் எண்ணிக்கை என்ற தேர்விற்கு வரவும். அதில் எண்ணைத் தேர்வு செய்து, சமர்ப்பிப்பதன் மூலம் நமது விடைகளைச் சரிபார்த்துக் கொள்ளலாம்.
உரலி: https://teachchemistry.org/periodical/simulations or Scan the QR Code