9 Я«єЯ««Я»Ї Я«хЯ«ЋЯ»ЂЯ«фЯ»ЇЯ«фЯ»Ђ Я«ЁЯ«▒Я«┐Я«хЯ«┐Я«»Я«▓Я»Ї : Я«ЁЯ«▓Я«ЋЯ»Ђ 11 : Я«ЁЯ«БЯ»Ђ Я«ЁЯ««Я»ѕЯ«фЯ»ЇЯ«фЯ»Ђ
Я«ЁЯ«БЯ»Ђ Я«јЯ«БЯ»Ї (Z) Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«еЯ«┐Я«▒Я»ѕ Я«јЯ«БЯ»Ї (A)
Я«ЁЯ«БЯ»Ђ Я«јЯ«БЯ»Ї (Z) Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«еЯ«┐Я«▒Я»ѕ Я«јЯ«БЯ»Ї (A)
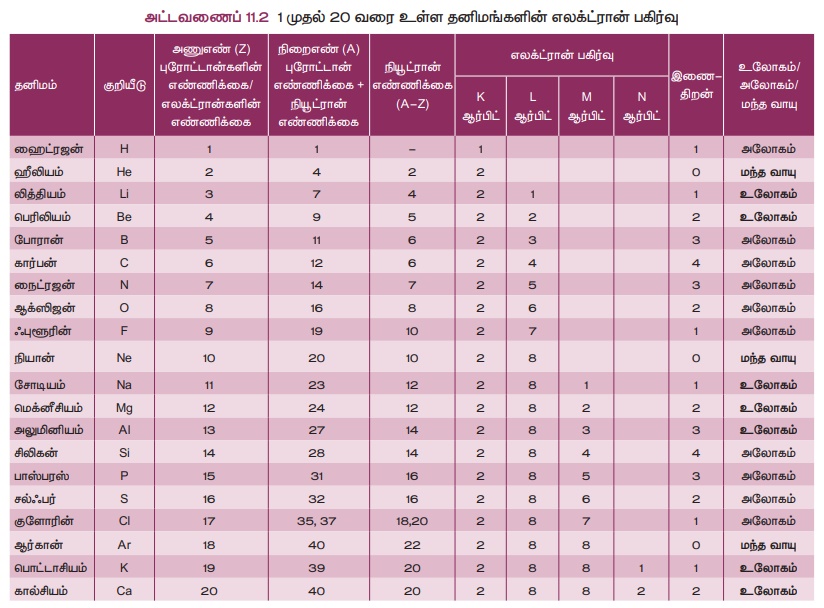
Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я«юЯ«ЕЯ»Ї Я«ЁЯ«БЯ»ЂЯ«хЯ«┐Я«ЕЯ»Ї Я«ЅЯ«ЪЯ»ЇЯ«ЋЯ«░Я»ЂЯ«хЯ«┐Я«▓Я»Ї Я«њЯ«░Я»Ђ Я«фЯ»ЂЯ«░Я»ІЯ«ЪЯ»ЇЯ«ЪЯ«ЙЯ«ЕЯ»Ї Я««Я«ЪЯ»ЇЯ«ЪЯ»ЂЯ««Я»Є Я«ЅЯ«│Я»ЇЯ«│Я«цЯ»Ђ. Я«╣Я»ђЯ«▓Я«┐Я«»Я««Я»Ї Я«ЁЯ«БЯ»ЂЯ«хЯ«┐Я«▓Я»Ї Я«ЄЯ«░Я«БЯ»ЇЯ«ЪЯ»Ђ Я«фЯ»ЂЯ«░Я»ІЯ«ЪЯ»ЇЯ«ЪЯ«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»Ї Я«ЅЯ«│Я»ЇЯ«│Я«Е. Я«цЯ«ЎЯ»ЇЯ«ЋЯ«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»Ї Я«ЁЯ«БЯ»ЂЯ«хЯ«┐Я«▓Я»Ї 79 Я«фЯ»ЂЯ«░Я»ІЯ«ЪЯ»ЇЯ«ЪЯ«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»Ї Я«ЅЯ«│Я»ЇЯ«│Я«Е. Я«јЯ«ЕЯ«хЯ»Є,
Я«ЁЯ«БЯ»ЂЯ«хЯ«┐Я«ЕЯ»Ї Я«ЅЯ«ЪЯ»ЇЯ«ЋЯ«░Я»ЂЯ«хЯ«┐Я«▓Я«┐Я«░Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«фЯ»ЂЯ«░Я»ІЯ«ЪЯ»ЇЯ«ЪЯ«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«јЯ«БЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»ѕЯ«»Я»Є,
Я«ЁЯ«цЯ»Ђ Я«јЯ«хЯ»ЇЯ«хЯ«ЋЯ»ѕЯ«цЯ»Ї Я«цЯ«ЕЯ«┐Я««Я««Я»Ї Я«јЯ«ЕЯ»ЇЯ«фЯ«цЯ«ЕЯ»ѕ Я«еЯ«┐Я«░Я»ЇЯ«БЯ«»Я«┐Я«ЋЯ»ЇЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«ЄЯ«цЯ»ЇЯ«цЯ«ЋЯ»ѕЯ«» Я««Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«»Я«цЯ»ЇЯ«цЯ»ЂЯ«хЯ««Я»Ї Я«хЯ«ЙЯ«»Я»ЇЯ«еЯ»ЇЯ«ц Я«јЯ«БЯ»Ї Я«ЁЯ«БЯ»Ђ Я«јЯ«БЯ»Ї (Я«фЯ»ЂЯ«░Я»ІЯ«ЪЯ»ЇЯ«ЪЯ«ЙЯ«ЕЯ»Ї Я«јЯ«БЯ»Ї )
Я«јЯ«ЕЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
Я«ЁЯ«БЯ»Ђ Я«јЯ«БЯ»Ї =
Я«фЯ»ЂЯ«░Я»ІЯ«ЪЯ»ЇЯ«ЪЯ«ЙЯ«ЕЯ»Ї Я«јЯ«БЯ»ЇЯ«БЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»ѕ =
Я«јЯ«▓Я»єЯ«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»Ї Я«јЯ«БЯ»ЇЯ«БЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»ѕ
Я«њЯ«░Я»Ђ Я«ЁЯ«БЯ»ЂЯ«хЯ«┐Я«ЕЯ»Ї Я««Я»іЯ«цЯ»ЇЯ«ц Я«еЯ«┐Я«▒Я»ѕЯ«»Я«┐Я«ЕЯ»ѕ Я«фЯ»ЂЯ«░Я»ІЯ«ЪЯ»ЇЯ«ЪЯ«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»Ї Я««Я«ЪЯ»ЇЯ«ЪЯ»ЂЯ««Я»Є Я«еЯ«┐Я«░Я»ЇЯ«БЯ«»Я«┐Я«фЯ»ЇЯ«фЯ«цЯ«┐Я«▓Я»ЇЯ«▓Я»ѕ. Я«еЯ«┐Я«»Я»ѓЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»ЂЯ««Я»Ї Я«ЅЯ«ЪЯ»ЇЯ«ЋЯ«░Я»ЂЯ«хЯ«┐Я«▓Я»Ї Я««Я»іЯ«цЯ»ЇЯ«ц Я«еЯ«┐Я«▒Я»ѕЯ«ЋЯ»ЇЯ«ЋЯ»Ђ Я«фЯ«ЎЯ»ЇЯ«ЋЯ«│Я«┐Я«ЋЯ»ЇЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«ЁЯ«БЯ»ЂЯ«хЯ«┐Я«ЕЯ»Ї Я««Я»іЯ«цЯ»ЇЯ«ц Я«еЯ«┐Я«▒Я»ѕЯ«»Я»ѕ Я«њЯ«фЯ»ЇЯ«фЯ«┐Я«ЪЯ»ЂЯ««Я»Ї Я«фЯ»ІЯ«цЯ»Ђ Я««Я«┐Я«ЋЯ«ЋЯ»Ї Я«ЋЯ»ЂЯ«▒Я»ѕЯ«еЯ»ЇЯ«ц Я«еЯ«┐Я«▒Я»ѕЯ«»Я»ѕЯ«фЯ»Ї Я«фЯ»єЯ«▒Я»ЇЯ«▒Я»ЂЯ«│Я»ЇЯ«│ Я«јЯ«▓Я»єЯ«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ«┐Я«ЕЯ»Ї Я«еЯ«┐Я«▒Я»ѕ Я«фЯ»ЂЯ«▒Я«ЋЯ»ЇЯ«ЋЯ«БЯ«┐Я«ЋЯ»ЇЯ«ЋЯ«цЯ»ЇЯ«цЯ«ЋЯ»ЇЯ«ЋЯ«цЯ»Ђ. Я«фЯ»ЂЯ«░Я»ІЯ«ЪЯ»ЇЯ«ЪЯ«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»Ї Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«еЯ«┐Я«»Я»ѓЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«еЯ«┐Я«▒Я»ѕ Я«џЯ««Я««Я«ЙЯ«Ћ Я«ЄЯ«░Я»ЂЯ«фЯ»ЇЯ«фЯ«цЯ«ЙЯ«▓Я»Ї,
Я«њЯ«░Я»Ђ Я«ЋЯ»ЂЯ«▒Я«┐Я«фЯ»ЇЯ«фЯ«┐Я«ЪЯ»ЇЯ«Ъ Я«ЁЯ«БЯ»ЂЯ«хЯ«┐Я«ЕЯ»Ї Я««Я»іЯ«цЯ»ЇЯ«ц Я«еЯ«┐Я«▒Я»ѕ Я«ЄЯ«хЯ»ЇЯ«хЯ«┐Я«░Я«БЯ»ЇЯ«ЪЯ»Ђ Я«еЯ«┐Я«▒Я»ѕЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«ЋЯ»ѓЯ«ЪЯ»ЇЯ«ЪЯ»Ђ Я««Я«цЯ«┐Я«фЯ»ЇЯ«фЯ«ЙЯ«ЋЯ»ЂЯ««Я»Ї. Я«ЄЯ«ЋЯ»ЇЯ«ЋЯ»ѓЯ«ЪЯ»ЇЯ«ЪЯ»Ђ Я««Я«цЯ«┐Я«фЯ»ЇЯ«фЯ»Є Я«њЯ«░Я»Ђ Я«ЁЯ«БЯ»ЂЯ«хЯ«┐Я«ЕЯ»Ї Я«еЯ«┐Я«▒Я»ѕ Я«јЯ«БЯ»Ї (Я«ЁЯ«▓Я»ЇЯ«▓Я«цЯ»Ђ Я«еЯ«┐Я«»Я»ѓЯ«ЋЯ»ЇЯ«│Я«┐Я«»Я«ЙЯ«ЕЯ»Ї Я«јЯ«БЯ»Ї) Я«јЯ«ЕЯ»ЇЯ«▒Я»Ђ Я«ЁЯ«┤Я»ѕЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
Я«еЯ«┐Я«▒Я»ѕ Я«јЯ«БЯ»Ї =
Я«фЯ»ЂЯ«░Я»ІЯ«ЪЯ»ЇЯ«ЪЯ«ЙЯ«ЕЯ»Ї Я«јЯ«БЯ»ЇЯ«БЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»ѕ +
Я«еЯ«┐Я«»Я»ѓЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»Ї Я«јЯ«БЯ»ЇЯ«БЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»ѕ
Я«јЯ«еЯ»ЇЯ«ц Я«њЯ«░Я»Ђ Я«цЯ«ЕЯ«┐Я««Я«цЯ»ЇЯ«цЯ«┐Я«▓Я»ЂЯ««Я»Ї, Я«ЁЯ«БЯ»Ђ Я«јЯ«БЯ»Ї Я«цЯ«ЕЯ«┐Я««Я«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»Ї Я«ЋЯ»ЂЯ«▒Я«┐Я«»Я»ђЯ«ЪЯ»ЇЯ«ЪЯ«┐Я«▒Я»ЇЯ«ЋЯ»Ђ Я«ЋЯ»ђЯ«┤Я»ЄЯ«»Я»ЂЯ««Я»Ї, Я«еЯ«┐Я«▒Я»ѕ Я«јЯ«БЯ»Ї Я««Я»ЄЯ«▓Я»ЄЯ«»Я»ЂЯ««Я»Ї Я«ЋЯ»ЂЯ«▒Я«┐Я«фЯ»ЇЯ«фЯ«┐Я«ЪЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
Я«еЯ»ѕЯ«ЪЯ»ЇЯ«░Я«юЯ«ЕЯ«┐Я«ЕЯ»Ї Я«ЁЯ«БЯ»Ђ Я«јЯ«БЯ»Ї =7
Я«еЯ»ѕЯ«ЪЯ»ЇЯ«░Я«юЯ«ЕЯ«┐Я«ЕЯ»Ї Я«еЯ«┐Я«▒Я»ѕ Я«јЯ«БЯ»Ї =
14
Я«џЯ»єЯ«»Я«▓Я»ЇЯ«фЯ«ЙЯ«ЪЯ»Ђ 1
Я«фЯ«┐Я«ЕЯ»ЇЯ«хЯ«░Я»ЂЯ««Я»Ї Я«цЯ«ЕЯ«┐Я««Я«ЎЯ»ЇЯ«ЋЯ«│Я«┐Я«▓Я»Ї Я«ЅЯ«│Я»ЇЯ«│ Я«ЁЯ«БЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«ЁЯ«БЯ»Ђ Я«јЯ«БЯ»Ї, Я«еЯ«┐Я«▒Я»ѕ Я«јЯ«БЯ»ЇЯ«ЋЯ«│Я»ѕ Я«ЋЯ»ЂЯ«▒Я«┐Я«»Я»ђЯ«ЪЯ»ЇЯ«ЪЯ«┐Я«ЕЯ»Ї Я««Я»ѓЯ«▓Я««Я»Ї Я«јЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ»ЂЯ«░Я»ѕЯ«ЋЯ»ЇЯ«Ћ.
(Я«Ё) Я«ЋЯ«ЙЯ«░Я»ЇЯ«фЯ«ЕЯ»Ї
(Я«є) Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»Ї
(Я«Є) Я«џЯ«┐Я«▓Я«┐Я«ЋЯ»ЇЯ«ЋЯ«ЕЯ»Ї
(Я«ѕ) Я«фЯ»єЯ«░Я«┐Я«▓Я«┐Я«»Я««Я»Ї
Я«њЯ«░Я»Ђ Я«цЯ«ЕЯ«┐Я««Я«цЯ»ЇЯ«цЯ«┐Я«▓Я»ЂЯ«│Я»ЇЯ«│ Я«ЁЯ«БЯ»ЂЯ«хЯ«┐Я«ЕЯ»Ї Я«еЯ«┐Я«▒Я»ѕ Я«јЯ«БЯ»Ї Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«ЁЯ«БЯ»Ђ Я«јЯ«БЯ»ЇЯ«БЯ«┐Я«ЕЯ»Ї Я«хЯ»ЄЯ«▒Я»ЂЯ«фЯ«ЙЯ«ЪЯ»Ђ, Я«ЁЯ«цЯ»ЇЯ«цЯ«ЕЯ«┐Я««Я«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»Ї Я«ЁЯ«БЯ»ЂЯ«хЯ«┐Я«▓Я»ЂЯ«│Я»ЇЯ«│ Я«еЯ«┐Я«»Я»ѓЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«јЯ«БЯ»ЇЯ«БЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»ѕЯ«»Я»ѕ Я«хЯ«┤Я«ЎЯ»ЇЯ«ЋЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
Я«еЯ«┐Я«»Я»ѓЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«јЯ«БЯ»ЇЯ«БЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»ѕ (n) = Я«еЯ«┐Я«▒Я»ѕ Я«јЯ«БЯ»Ї (A) - Я«ЁЯ«БЯ»Ђ Я«јЯ«БЯ»Ї (Z)

Я«јЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«ЙЯ«ЪЯ»ЇЯ«ЪЯ«ЙЯ«Ћ, ![]() -Я«ЄЯ«▓Я»Ї Я«ЅЯ«│Я»ЇЯ«│
-Я«ЄЯ«▓Я»Ї Я«ЅЯ«│Я»ЇЯ«│
Я«еЯ«┐Я«»Я»ѓЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«јЯ«БЯ»ЇЯ«БЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»ѕ (n) = 24(A) - 12(Z) = 12
Я«цЯ«ЕЯ»ЇЯ«ЕЯ»ѕЯ«цЯ»ЇЯ«цЯ«ЙЯ«ЕЯ»Є Я«џЯ»ІЯ«цЯ«┐Я«цЯ»ЇЯ«цЯ«▓Я»Ї
Я«ЋЯ»ђЯ«┤Я»Є Я«ЋЯ»іЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ«│Я»ЇЯ«│ Я«ЁЯ«БЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«│Я«┐Я«▓Я»Ї Я«ЅЯ«│Я»ЇЯ«│ Я«еЯ«┐Я«»Я»ѓЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«јЯ«БЯ»ЇЯ«БЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»ѕЯ«»Я»ѕЯ«ЋЯ»Ї Я«ЋЯ«БЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«ЪЯ»ЂЯ«Ћ:
Я«ЅЯ«ЎЯ»ЇЯ«ЋЯ«│Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ«цЯ»Ї Я«цЯ»єЯ«░Я«┐Я«»Я»ЂЯ««Я«Й?
Я«ЁЯ«БЯ»Ђ Я«јЯ«БЯ»Ї 'Z' Я«хЯ«ЪЯ«┐Я«хЯ«цЯ»ЇЯ«цЯ«┐Я«▓Я»Ї Я«ЈЯ«ЕЯ»Ї Я«хЯ«ЪЯ«┐Я«хЯ««Я»ѕЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ«│Я»ЇЯ«│Я«цЯ»Ђ? 'Z' Я«јЯ«ЕЯ»ЇЯ«▒Я«ЙЯ«▓Я»Ї Я«ИЯ»ЇЯ«ИЯ«ЙЯ«ЃЯ«▓Я»Ї (Zahl) Я«юЯ»єЯ«░Я»ЇЯ««Я«ЙЯ«ЕЯ«┐Я«» Я««Я»іЯ«┤Я«┐Я«»Я«┐Я«▓Я»Ї 'Я«јЯ«БЯ»Ї Я«јЯ«ЕЯ»ЇЯ«▒Я»Ђ Я«фЯ»іЯ«░Я»ЂЯ«│Я»Ї. 'Z' Я«јЯ«ЕЯ»ЇЯ«фЯ«цЯ»ѕ Я«ЁЯ«БЯ»ЂЯ«ИЯ»ЇЯ«ИЯ«ЙЯ«ЃЯ«▓Я»Ї (atom Zahl) Я«ЁЯ«▓Я»ЇЯ«▓Я«цЯ»Ђ Я«ЁЯ«БЯ»Ђ Я«јЯ«БЯ»Ї Я«јЯ«ЕЯ«▓Я«ЙЯ««Я»Ї. 'A' Я«јЯ«ЕЯ»ЇЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒ Я«ЋЯ»ЂЯ«▒Я«┐Я«»Я»ђЯ«ЪЯ»Ђ M, Я«юЯ»єЯ«░Я»ЇЯ««Я«ЙЯ«ЕЯ«┐Я«» Я««Я»іЯ«┤Я«┐Я«»Я«┐Я«▓Я»Ї Я««Я«ЙЯ«џЯ»єЯ«ЕЯ»ЇЯ«ИЯ»ЇЯ«ИЯ«ЙЯ«▓Я»Ї (massenzahl) Я«јЯ«ЕЯ»ЇЯ«ЋЯ«┐Я«▒ Я«ЋЯ»ЂЯ«▒Я«┐Я«»Я»ђЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ«фЯ»Ї Я«фЯ«цЯ«┐Я«▓Я«ЙЯ«Ћ, ACS Я«хЯ«┤Я«┐Я««Я»ЂЯ«▒Я»ѕЯ«»Я«┐Я«▓Я»Ї, Я«ЁЯ«▒Я«┐Я««Я»ЂЯ«ЋЯ««Я»Ї Я«џЯ»єЯ«»Я»ЇЯ«»Я«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ«│Я»ЇЯ«│Я«цЯ»Ђ.
Я«ЋЯ«БЯ«ЋЯ»ЇЯ«ЋЯ»ђЯ«ЪЯ»Ђ 1
Я«њЯ«░Я»Ђ Я«цЯ«ЕЯ«┐Я««Я«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»Ї Я«ЁЯ«БЯ»ЂЯ«хЯ«┐Я«ЕЯ»Ї Я«еЯ«┐Я«▒Я»ѕ Я«јЯ«БЯ»Ї 39, Я«еЯ«┐Я«»Я»ѓЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«јЯ«БЯ»ЇЯ«БЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»ѕ 20 Я«јЯ«ЕЯ«┐Я«▓Я»Ї Я«ЁЯ«цЯ«ЕЯ»Ї Я«ЁЯ«БЯ»Ђ Я«јЯ«БЯ»ЇЯ«БЯ»ѕЯ«ЋЯ»Ї Я«ЋЯ«БЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«ЪЯ»Ђ. Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«ЁЯ«цЯ»ЇЯ«цЯ«ЕЯ«┐Я««Я«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»Ї Я«фЯ»єЯ«»Я«░Я»ѕЯ«ЋЯ»Ї Я«ЋЯ«БЯ»ЇЯ«ЪЯ»ЂЯ«фЯ«┐Я«ЪЯ«┐.
Я«цЯ»ђЯ«░Я»ЇЯ«хЯ»Ђ
Я«еЯ«┐Я«▒Я»ѕ Я«јЯ«БЯ»Ї = Я«ЁЯ«БЯ»Ђ Я«јЯ«БЯ»Ї + Я«еЯ«┐Я«»Я»ѓЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«јЯ«БЯ»ЇЯ«БЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»ѕ
Я«ЁЯ«БЯ»Ђ Я«јЯ«БЯ»Ї = Я«еЯ«┐Я«▒Я»ѕ Я«јЯ«БЯ»Ї РђЊ Я«еЯ«┐Я«»Я»ѓЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«јЯ«БЯ»ЇЯ«БЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»ѕ
= 39 - 20 =
19
Я«ЁЯ«БЯ»Ђ Я«јЯ«БЯ»Ї 19-Я«љЯ«ЋЯ»Ї Я«ЋЯ»іЯ«БЯ»ЇЯ«Ъ Я«цЯ«ЕЯ«┐Я««Я««Я»Ї Я«фЯ»іЯ«ЪЯ»ЇЯ«ЪЯ«ЙЯ«џЯ«┐Я«»Я««Я»Ї Я«єЯ«ЋЯ»ЂЯ««Я»Ї.
1. Я«ЁЯ«БЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»Ї Я«фЯ«ЋЯ«┐Я«░Я»ЇЯ«хЯ»Ђ
Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»Ї Я«єЯ«░Я»ЇЯ«фЯ«┐Я«ЪЯ»Ї Я«јЯ«ЕЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї Я«хЯ«ЪЯ»ЇЯ«ЪЯ«фЯ»ЇЯ«фЯ«ЙЯ«цЯ»ѕЯ«ЋЯ«│Я«┐Я«▓Я»Ї Я«ЅЯ«ЪЯ»ЇЯ«ЋЯ«░Я»ЂЯ«хЯ»ѕЯ«џЯ»Ї Я«џЯ»ЂЯ«▒Я»ЇЯ«▒Я«┐ Я«хЯ«░Я»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е Я«јЯ«ЕЯ»ЇЯ«фЯ«цЯ»ѕ Я«еЯ»ђ Я«ЁЯ«▒Я«┐Я«хЯ«ЙЯ«»Я»Ї. Я«єЯ«░Я»ЇЯ«фЯ«┐Я«ЪЯ»ЇЯ«ЪЯ»ЂЯ«ЋЯ«│Я»Ї Я«њЯ«хЯ»ЇЯ«хЯ»іЯ«ЕЯ»ЇЯ«▒Я«┐Я«▒Я»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»ѕЯ«фЯ»Ї Я«фЯ«ЋЯ«┐Я«░Я»ЇЯ«еЯ»ЇЯ«цЯ»Ђ Я«еЯ«┐Я«░Я«фЯ»ЇЯ«фЯ»ЂЯ«цЯ«▓Я»Ї Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»Ї Я«фЯ«ЋЯ«┐Я«░Я»ЇЯ«хЯ»Ђ Я«јЯ«ЕЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї. Я«ЁЯ«БЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«│Я«┐Я«▓Я»Ї Я«ЅЯ«│Я»ЇЯ«│ Я«ЄЯ«еЯ»ЇЯ«ц Я«єЯ«░Я»ЇЯ«фЯ«┐Я«ЪЯ»ЇЯ«ЪЯ»ЂЯ«ЋЯ«│Я«┐Я«▓Я»Ї Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»Ї Я«фЯ«ЋЯ«┐Я«░Я»ЇЯ«еЯ»ЇЯ«цЯ»Ђ Я«еЯ«┐Я«░Я«фЯ»ЇЯ«фЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«хЯ«цЯ»Ђ,
Я«ЋЯ»ЂЯ«▒Я«┐Я«фЯ»ЇЯ«фЯ«┐Я«ЪЯ»ЇЯ«Ъ Я«хЯ«┐Я«цЯ«┐Я«ЋЯ«│Я»Ї (Я«Ё) Я«еЯ«┐Я«фЯ«еЯ»ЇЯ«цЯ«ЕЯ»ѕЯ«ЋЯ«│Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ«ЪЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«ЪЯ»Є Я«еЯ«┐Я«ЋЯ«┤Я»ЇЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«ЄЯ«хЯ»ЇЯ«хЯ«┐Я«цЯ«┐Я«ЋЯ«│Я»Ї Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»Ї Я«ЁЯ««Я»ѕЯ«фЯ»ЇЯ«фЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«ЙЯ«Е Я«фЯ»ІЯ«░Я»Ї Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«фЯ»ЂЯ«░Я«┐ Я«хЯ«┐Я«цЯ«┐Я«ЋЯ«│Я»Ї Я«јЯ«ЕЯ»ЇЯ«▒Я»Ђ Я«ЁЯ«┤Я»ѕЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е.
Я«ЁЯ«БЯ»ЂЯ«хЯ«┐Я«ЕЯ»Ї Я«ЋЯ»ѓЯ«ЪЯ»ЂЯ«ЋЯ«│Я«┐Я«▓Я»Ї Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»Ї Я«фЯ«ЎЯ»ЇЯ«ЋЯ»ђЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«ЙЯ«Е Я«хЯ«┐Я«цЯ«┐Я«ЋЯ«│Я»ѕ Я«фЯ»ІЯ«░Я»Ї Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«фЯ»ЂЯ«░Я«┐ Я«єЯ«ЋЯ«┐Я«»Я»ІЯ«░Я»Ї Я«фЯ«┐Я«ЕЯ»ЇЯ«хЯ«░Я»ЂЯ««Я«ЙЯ«▒Я»Ђ Я««Я»ЂЯ«ЕЯ»Ї Я««Я»іЯ«┤Я«┐Я«еЯ»ЇЯ«цЯ«ЕЯ«░Я»Ї.
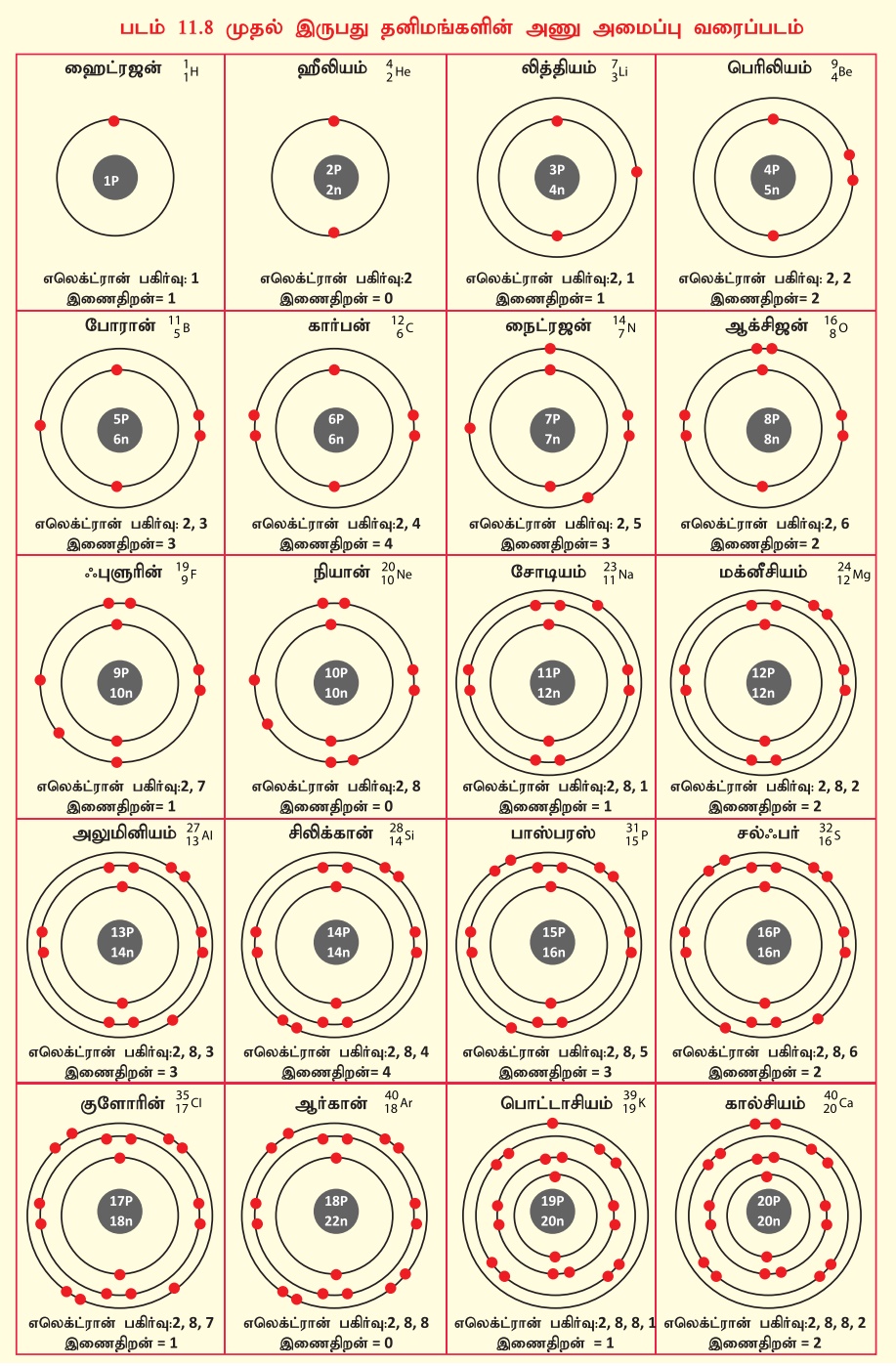
Я«хЯ«┐Я«цЯ«┐ (1):
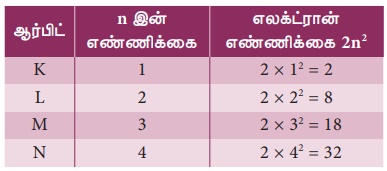
Я«њЯ«░Я»Ђ Я«хЯ«ЪЯ»ЇЯ«ЪЯ«фЯ»ЇЯ«фЯ«ЙЯ«цЯ»ѕЯ«»Я«┐Я«▓Я»Ї Я«ЄЯ«ЪЯ«ЎЯ»ЇЯ«ЋЯ»іЯ«│Я»ЇЯ«│Я»ЂЯ««Я»Ї Я«ЁЯ«цЯ«┐Я«ЋЯ«фЯ«ЪЯ»ЇЯ«џ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«јЯ«БЯ»ЇЯ«БЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»ѕ 2n2 Я«јЯ«ЕЯ»ЇЯ«▒ Я«хЯ«ЙЯ«»Я»ЇЯ«фЯ»ЇЯ«фЯ«ЙЯ«ЪЯ»ЇЯ«ЪЯ«ЙЯ«▓Я»Ї Я«ЋЯ«БЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«ЪЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. n
Я«јЯ«ЕЯ»ЇЯ«фЯ«цЯ»Ђ Я««Я»ЂЯ«цЯ«ЕЯ»ЇЯ««Я»ѕ Я«ЋЯ»ЂЯ«хЯ«ЙЯ«БЯ»ЇЯ«ЪЯ««Я»Ї Я«јЯ«БЯ»Ї Я«єЯ«ЋЯ»ЂЯ««Я»Ї.
(Я«ЁЯ«цЯ«ЙЯ«хЯ«цЯ»Ђ Я«ЅЯ«ЪЯ»ЇЯ«ЋЯ«░Я»ЂЯ«хЯ«┐Я«▓Я«┐Я«░Я»ЂЯ«еЯ»ЇЯ«цЯ»Ђ Я«ЋЯ»ѓЯ«ЪЯ»ЇЯ«ЪЯ«┐Я«ЕЯ»Ї Я«хЯ«░Я«┐Я«џЯ»ѕ Я«јЯ«БЯ»Ї)
Я«хЯ«┐Я«цЯ«┐ (2):
Я«ЋЯ»ѓЯ«ЪЯ»ЂЯ«ЋЯ«│Я»Ї Я«ЁЯ«хЯ«▒Я»ЇЯ«▒Я«┐Я«ЕЯ»Ї Я«єЯ«▒Я»ЇЯ«▒Я«▓Я»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«ЈЯ«▒Я»Ђ Я«хЯ«░Я«┐Я«џЯ»ѕЯ«»Я«┐Я«▓Я»Ї Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я«ЙЯ«▓Я»Ї Я«фЯ«ЪЯ«┐Я«фЯ»ЇЯ«фЯ«ЪЯ«┐Я«»Я«ЙЯ«Ћ Я«еЯ«┐Я«░Я«фЯ»ЇЯ«фЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е.
Я«хЯ«┐Я«цЯ«┐ (3):
Я«њЯ«░Я»Ђ Я«ЁЯ«БЯ»ЂЯ«хЯ«┐Я«ЕЯ»Ї Я«хЯ»єЯ«│Я«┐Я«хЯ«ЪЯ»ЇЯ«Ъ Я«єЯ«░Я»ЇЯ«фЯ«┐Я«ЪЯ»ЇЯ«ЪЯ«┐Я«ЕЯ«ЙЯ«▓Я»Ї Я«ЋЯ»ѓЯ«ЪЯ»ЂЯ«цЯ«▓Я«ЙЯ«Ћ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»ѕЯ«фЯ»Ї Я«фЯ»єЯ«▒ Я««Я»ЂЯ«ЪЯ«┐Я«еЯ»ЇЯ«цЯ«ЙЯ«▓Я»ЂЯ««Я»Ї,
Я«ЄЯ«еЯ»ЇЯ«ц Я«єЯ«░Я»ЇЯ«фЯ«┐Я«ЪЯ»ЇЯ«ЪЯ«┐Я«▓Я»Ї Я«ЅЯ«│Я»ЇЯ«│ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«јЯ«БЯ»ЇЯ«БЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»ѕ 8 Я«ЋЯ»ЇЯ«ЋЯ»Ђ Я««Я«┐Я«ЋЯ«ЙЯ««Я«▓Я»Ї Я«ЄЯ«░Я»ЂЯ«ЋЯ»ЇЯ«Ћ Я«хЯ»ЄЯ«БЯ»ЇЯ«ЪЯ»ЂЯ««Я»Ї. Я«јЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«ЙЯ«ЪЯ»ЇЯ«ЪЯ«ЙЯ«Ћ,
20 Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»ѕЯ«ЋЯ»Ї Я«ЋЯ»іЯ«БЯ»ЇЯ«Ъ Я«ЋЯ«ЙЯ«▓Я»ЇЯ«џЯ«┐Я«»Я««Я»Ї Я«ЁЯ«БЯ»ЂЯ«хЯ«┐Я«ЕЯ»Ї Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»Ї Я«фЯ«ЋЯ«┐Я«░Я»ЇЯ«хЯ»Ђ,
K L
M N
2
8 8 2
Я«ЋЯ«БЯ«ЋЯ»ЇЯ«ЋЯ»ђЯ«ЪЯ»Ђ 2
Я«ЁЯ«▓Я»ЂЯ««Я«┐Я«ЕЯ«┐Я«»Я««Я»Ї Я«ЁЯ«БЯ»ЂЯ«хЯ«┐Я«ЕЯ»Ї (13 Я«јЯ«▓Я«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»Ї) Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»Ї Я«фЯ«ЋЯ«┐Я«░Я»ЇЯ«хЯ»ѕЯ«ЋЯ»Ї Я«ЋЯ«БЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«ЪЯ»ЂЯ«Ћ.
Я«цЯ»ђЯ«░Я»ЇЯ«хЯ»Ђ
K - Я«єЯ«░Я»ЇЯ«фЯ«┐Я«ЪЯ»Ї = 2 Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»Ї
L - Я«єЯ«░Я»ЇЯ«фЯ«┐Я«ЪЯ»Ї = 8 Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»Ї
M - Я«єЯ«░Я»ЇЯ«фЯ«┐Я«ЪЯ»Ї - 3 Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»Ї
Я«Ѓ Я«ЁЯ«▓Я»ЂЯ««Я«┐Я«ЕЯ«┐Я«»Я«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»Ї Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»Ї Я«ЁЯ««Я»ѕЯ«фЯ»ЇЯ«фЯ»Ђ 2,8,3
Я«ЅЯ«ЎЯ»ЇЯ«ЋЯ«│Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ«цЯ»Ї Я«цЯ»єЯ«░Я«┐Я«»Я»ЂЯ««Я«Й?
Я«фЯ»ЂЯ«░Я»ІЯ«ЪЯ»ЇЯ«ЪЯ«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»ѕЯ«»Я»ЂЯ««Я»Ї Я«еЯ«┐Я«»Я»ѓЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»ѕЯ«»Я»ЂЯ««Я»Ї Я«ЄЯ«БЯ»ѕЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«хЯ«┐Я«џЯ»ѕЯ«»Я«ЙЯ«ЕЯ«цЯ»Ђ Я«ѕЯ«░Я»ЇЯ«фЯ»ЇЯ«фЯ»Ђ Я«хЯ«┐Я«џЯ»ѕЯ«»Я»ѕЯ«ЋЯ»Ї Я«ЋЯ«ЙЯ«ЪЯ»ЇЯ«ЪЯ«┐Я«▓Я»ЂЯ««Я»Ї Я««Я«┐Я«ЋЯ«хЯ»ЂЯ««Я»Ї Я«хЯ«▓Я«┐Я««Я»ѕЯ«»Я«ЙЯ«ЕЯ«цЯ»Ђ.
Я«ЄЯ«цЯ»Ђ Я«»Я»ЂЯ«ЋЯ«ЙЯ«хЯ«Й Я«хЯ«┐Я«џЯ»ѕ Я«јЯ«Е Я«ЁЯ«┤Я»ѕЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
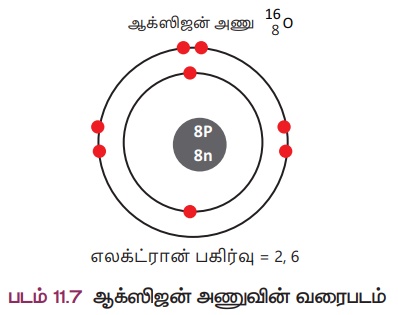
Я«цЯ«ЕЯ«┐Я««Я«ЎЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«ЁЯ«БЯ»Ђ Я«ЁЯ««Я»ѕЯ«фЯ»ЇЯ«фЯ«┐Я«ЕЯ»Ї Я«хЯ«░Я»ѕЯ«фЯ«Ъ Я«хЯ«┐Я«│Я«ЋЯ»ЇЯ«ЋЯ««Я»Ї
Я«јЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«ЙЯ«ЪЯ»ЇЯ«ЪЯ»Ђ
168O
- Я«єЯ«ЋЯ»ЇЯ«џЯ«┐Я«юЯ«ЕЯ»Ї Я«ЁЯ«БЯ»ЂЯ«хЯ«┐Я«ЕЯ»Ї Я«хЯ«░Я»ѕЯ«фЯ«Ъ Я«хЯ«┐Я«│Я«ЋЯ»ЇЯ«ЋЯ««Я»Ї
Я«еЯ«┐Я«▒Я»ѕ Я«јЯ«БЯ»Ї A
= 16
Я«ЁЯ«БЯ»Ђ Я«јЯ«БЯ»Ї Z
= 8
Я«»Я»ѓЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«јЯ«БЯ»ЇЯ«БЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»ѕ =
A
- Z = 16 РђЊ 8 = 8
Я«фЯ»ЂЯ«░Я»ІЯ«ЪЯ»ЇЯ«ЪЯ«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«јЯ«БЯ»ЇЯ«БЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»ѕ = 8
Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«јЯ«БЯ»ЇЯ«БЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»ѕ = 8
Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»Ї Я«фЯ«ЋЯ«┐Я«░Я»ЇЯ«хЯ»Ђ =
2,6
Я«ЅЯ«ЎЯ»ЇЯ«ЋЯ«│Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ«цЯ»Ї Я«цЯ»єЯ«░Я«┐Я«»Я»ЂЯ««Я«Й?
Я«ЁЯ«БЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«│Я»Ї Я««Я«┐Я«Ћ Я«еЯ»ЂЯ«БЯ»ЇЯ«БЯ«┐Я«» Я«еЯ«┐Я«▒Я»ѕ Я«јЯ«БЯ»ЇЯ«ЋЯ«│Я»ѕЯ«фЯ»Ї Я«фЯ»єЯ«▒Я»ЇЯ«▒Я»ЂЯ«│Я»ЇЯ«│Я«цЯ«ЙЯ«▓Я»Ї Я«ЁЯ«хЯ«▒Я»ЇЯ«▒Я»ѕ Я«ЋЯ«┐Я«░Я«ЙЯ««Я«┐Я«▓Я»Ї Я«ЁЯ«│Я«хЯ«┐Я«Ъ Я««Я»ЂЯ«ЪЯ«┐Я«»Я«ЙЯ«цЯ»Ђ. Я«ЁЯ«хЯ»ѕ anu
(Я«ЁЯ«БЯ»Ђ Я«еЯ«┐Я«▒Я»ѕ Я«ЁЯ«▓Я«ЋЯ»Ђ)
Я«јЯ«ЕЯ»ЇЯ«▒Я»ЂЯ««Я»Ї Я«ЁЯ«│Я«хЯ«┐Я«ЪЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е.
Я«ЄЯ«цЯ«ЕЯ»Ї Я«фЯ»ЂЯ«цЯ«┐Я«» Я«ЁЯ«▓Я«ЋЯ»Ђ U. Я«ЁЯ«БЯ»ЂЯ«хЯ«┐Я«ЕЯ»Ї Я«ЅЯ«░Я»ЂЯ«х Я«ЁЯ«│Я«хЯ»Ђ Я«еЯ«ЙЯ«ЕЯ»ІЯ««Я»ђЯ«ЪЯ»ЇЯ«ЪЯ«░Я»Ї Я«јЯ«ЕЯ»ЇЯ«▒ Я«ЁЯ«▓Я«ЋЯ«┐Я«ЕЯ«ЙЯ«▓Я»Ї Я«ЁЯ«│Я«хЯ«┐Я«ЪЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«цЯ»Ђ
(1 nm = 10-9m).
Я«ЁЯ«БЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«│Я»ЇЯ««Я«┐Я«ЋЯ«хЯ»ЂЯ««Я»Ї Я«еЯ»ЂЯ«БЯ»ЇЯ«БЯ«┐Я«» Я«фЯ»іЯ«░Я»ЂЯ«│Я«ЙЯ«Ћ Я«ЅЯ«│Я»ЇЯ«│Я«цЯ«ЙЯ«▓Я»Ї Я«ЁЯ«хЯ»ѕ Я«ИЯ»ЇЯ«ЋЯ»ЄЯ«ЕЯ«┐Я«ЎЯ»Ї Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»Ї Я««Я»ѕЯ«ЋЯ»ЇЯ«░Я»ІЯ«ИЯ»ЇЯ«ЋЯ»ІЯ«фЯ»Ї
(SEM) Я««Я»ѓЯ«▓Я««Я»Ї Я«фЯ«ЙЯ«░Я»ЇЯ«хЯ»ѕЯ«»Я«┐Я«ЪЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е.
2. Я«ЄЯ«БЯ»ѕЯ«цЯ«┐Я«▒Я«ЕЯ»Ї Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»Ї
Я««Я»ЄЯ«▓Я»Є Я«ЅЯ«│Я»ЇЯ«│ Я«јЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«ЙЯ«ЪЯ»ЇЯ«ЪЯ«┐Я«▓Я»Ї (Я«фЯ«ЪЯ««Я»Ї 11.7), Я«єЯ«ЋЯ»ЇЯ«џЯ«┐Я«юЯ«ЕЯ»Ї Я«ЁЯ«БЯ»ЂЯ«хЯ«┐Я«ЕЯ»Ї Я«хЯ»єЯ«│Я«┐Я«хЯ«ЪЯ»ЇЯ«Ъ Я«єЯ«░Я»ЇЯ«фЯ«┐Я«ЪЯ»ЇЯ«ЪЯ«┐Я«▓Я»Ї Я«єЯ«▒Я»Ђ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»Ї Я«ЅЯ«│Я»ЇЯ«│Я«Е Я«јЯ«ЕЯ»ЇЯ«фЯ«цЯ»ѕ Я«еЯ«ЙЯ««Я»Ї Я«ЋЯ«ЙЯ«БЯ«▓Я«ЙЯ««Я»Ї. Я«ЄЯ«еЯ»ЇЯ«ц Я«єЯ«▒Я»Ђ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»Ї Я«ЄЯ«БЯ»ѕЯ«цЯ«┐Я«▒Я«ЕЯ»Ї Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»Ї Я«јЯ«Е Я«ЁЯ«┤Я»ѕЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е.
Я«ЁЯ«БЯ»ЂЯ«хЯ«┐Я«ЕЯ»Ї Я«ЅЯ«ЪЯ»ЇЯ«ЋЯ«░Я»ЂЯ«хЯ«┐Я«▓Я«┐Я«░Я»ЂЯ«еЯ»ЇЯ«цЯ»Ђ Я«ЋЯ«ЪЯ»ѕЯ«џЯ«┐Я«»Я«ЙЯ«Ћ Я«ЅЯ«│Я»ЇЯ«│ Я«хЯ»єЯ«│Я«┐Я«ЋЯ»ЇЯ«ЋЯ»ѓЯ«ЪЯ»Ђ Я«ЄЯ«БЯ»ѕЯ«цЯ«┐Я«▒Я«ЕЯ»Ї Я«ЋЯ»ѓЯ«ЪЯ»Ђ Я«јЯ«ЕЯ»ЇЯ«▒Я»ЂЯ««Я»Ї,
Я«ЁЯ«цЯ«┐Я«▓Я»Ї Я«ЅЯ«│Я»ЇЯ«│ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»Ї Я«ЄЯ«БЯ»ѕЯ«цЯ«┐Я«▒Я«ЕЯ»Ї Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»Ї Я«јЯ«ЕЯ»ЇЯ«▒Я»ЂЯ««Я»Ї Я«ЁЯ«┤Я»ѕЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е. Я«цЯ«ЕЯ«┐Я««Я«ЎЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«хЯ»ЄЯ«цЯ«┐Я«фЯ»ЇЯ«фЯ«БЯ»ЇЯ«фЯ»ЂЯ«ЋЯ«│Я»Ї Я«ЁЯ«хЯ«▒Я»ЇЯ«▒Я«┐Я«ЕЯ»Ї Я«ЄЯ«БЯ»ѕЯ«цЯ«┐Я«▒Я«ЕЯ»Ї Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я«ЙЯ«▓Я»Ї Я«цЯ»ђЯ«░Я»ЇЯ««Я«ЙЯ«ЕЯ«┐Я«ЋЯ»ЇЯ«ЋЯ«фЯ»Ї Я«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е. Я«ЈЯ«ЕЯ»єЯ«ЕЯ«┐Я«▓Я»Ї Я«ЁЯ«хЯ»ѕ Я««Я«ЪЯ»ЇЯ«ЪЯ»ЂЯ««Я»Є Я«хЯ»ЄЯ«цЯ«┐ Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я«┐Я«▓Я»Ї Я«фЯ«ЎЯ»ЇЯ«ЋЯ»єЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е.
Я«хЯ»єЯ«│Я«┐Я«хЯ«ЪЯ»ЇЯ«ЪЯ«фЯ»ЇЯ«фЯ«ЙЯ«цЯ»ѕЯ«»Я«┐Я«▓Я»Ї Я«џЯ«« Я«јЯ«БЯ»ЇЯ«БЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»ѕЯ«»Я«┐Я«▓Я»Ї Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»ѕ Я«ЅЯ«ЪЯ»ѕЯ«» Я«цЯ«ЕЯ«┐Я««Я«ЎЯ»ЇЯ«ЋЯ«│Я»Ї Я«њЯ«░Я»Є Я««Я«ЙЯ«цЯ«┐Я«░Я«┐Я«»Я«ЙЯ«Е Я«фЯ«БЯ»ЇЯ«фЯ»ЂЯ«ЋЯ«│Я»ѕЯ«ЋЯ»Ї Я«ЋЯ»іЯ«БЯ»ЇЯ«ЪЯ«┐Я«░Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї. Я«хЯ»ЄЯ«▒Я»ЂЯ«фЯ«ЪЯ»ЇЯ«Ъ Я«јЯ«БЯ»ЇЯ«БЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»ѕЯ«»Я«┐Я«▓Я»Ї Я«ЄЯ«БЯ»ѕЯ«цЯ«┐Я«▒Я«ЕЯ»Ї Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»ѕ Я«ЅЯ«ЪЯ»ѕЯ«» Я«цЯ«ЕЯ«┐Я««Я«ЎЯ»ЇЯ«ЋЯ«│Я»Ї Я«хЯ»єЯ«хЯ»ЇЯ«хЯ»ЄЯ«▒Я»Ђ Я«фЯ«БЯ»ЇЯ«фЯ»ЂЯ«ЋЯ«│Я»ѕЯ«ЋЯ»Ї Я«ЋЯ»іЯ«БЯ»ЇЯ«ЪЯ«┐Я«░Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї.
1,2 Я«ЁЯ«▓Я»ЇЯ«▓Я«цЯ»Ђ 3 Я«ЄЯ«БЯ»ѕЯ«цЯ«┐Я«▒Я«ЕЯ»Ї Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»ѕ Я«ЅЯ«ЪЯ»ѕЯ«» Я«цЯ«ЕЯ«┐Я««Я«ЎЯ»ЇЯ«ЋЯ«│Я»Ї (Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я«юЯ«ЕЯ»ѕЯ«цЯ»Ї Я«цЯ«хЯ«┐Я«░Я»ЇЯ«цЯ»ЇЯ«цЯ»Ђ) Я«ЅЯ«▓Я»ІЯ«ЋЯ«ЎЯ»ЇЯ«ЋЯ«│Я»Ї Я«јЯ«ЕЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е. Я«хЯ»єЯ«│Я«┐Я«ЋЯ»ЇЯ«ЋЯ»ѓЯ«ЪЯ»ЇЯ«ЪЯ«┐Я«▓Я»Ї 4 Я««Я»ЂЯ«цЯ«▓Я»Ї 7 Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»Ї Я«хЯ«░Я»ѕ Я«ЋЯ»іЯ«БЯ»ЇЯ«Ъ Я«цЯ«ЕЯ«┐Я««Я«ЎЯ»ЇЯ«ЋЯ«│Я»Ї Я«ЁЯ«▓Я»ІЯ«ЋЯ«ЎЯ»ЇЯ«ЋЯ«│Я»Ї Я«јЯ«ЕЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е.
3. Я«ЄЯ«БЯ»ѕЯ«цЯ«┐Я«▒Я«ЕЯ»Ї
Я«њЯ«░Я»Ђ Я«цЯ«ЕЯ«┐Я««Я«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»Ї Я«ЄЯ«БЯ»ѕ Я«цЯ«┐Я«▒Я«ЕЯ»Ї Я«јЯ«ЕЯ»ЇЯ«фЯ«цЯ»Ђ Я«ЁЯ«цЯ»ЇЯ«цЯ«ЕЯ«┐Я««Я««Я»Ї Я««Я«▒Я»ЇЯ«▒Я»іЯ«░Я»Ђ Я«цЯ«ЕЯ«┐Я««Я«цЯ»ЇЯ«цЯ»ЂЯ«ЪЯ«ЕЯ»Ї Я«џЯ»ЄЯ«░Я»ЂЯ««Я»Ї Я«цЯ«┐Я«▒Я«ЕЯ«┐Я«ЕЯ»Ї Я«ЁЯ«│Я«хЯ»Ђ Я«єЯ«ЋЯ»ЂЯ««Я»Ї. Я««Я»ЄЯ«▓Я»ЂЯ««Я»Ї Я«ЁЯ«цЯ»Ђ Я«хЯ»ЄЯ«цЯ«┐ Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я«┐Я«▓Я»Ї -
Я«фЯ«ЎЯ»ЇЯ«ЋЯ»Ђ Я«фЯ»єЯ«▒Я»ЂЯ««Я»Ї Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»Ї Я«јЯ«БЯ»ЇЯ«БЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»ѕЯ«ЋЯ»ЇЯ«ЋЯ»Ђ Я«џЯ««Я««Я«ЙЯ«Ћ Я«ЄЯ«░Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї. 1,2,3,4 Я«фЯ»ІЯ«ЕЯ»ЇЯ«▒ Я«ЄЯ«БЯ»ѕЯ«цЯ«┐Я«▒Я«ЕЯ»Ї Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»ѕ Я«ЅЯ«ЪЯ»ѕЯ«» Я«цЯ«ЕЯ«┐Я««Я«ЎЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«ЄЯ«БЯ»ѕЯ«цЯ«┐Я«▒Я«ЕЯ»Ї 1,2,3,4 Я«єЯ«ЋЯ«хЯ»Є Я«ЄЯ«░Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї. Я«њЯ«░Я»Ђ Я«цЯ«ЕЯ«┐Я««Я«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»Ї Я«ЄЯ«БЯ»ѕЯ«цЯ«┐Я«▒Я«ЕЯ»Ї Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»Ї 5,6,7 Я«єЯ«Ћ Я«ЄЯ«░Я»ЂЯ«еЯ»ЇЯ«цЯ«ЙЯ«▓Я»Ї Я«ЁЯ«цЯ«ЕЯ»Ї Я«ЄЯ«БЯ»ѕЯ«цЯ«┐Я«▒Я«ЕЯ»Ї 3,2,1 Я«єЯ«ЋЯ«хЯ»Є Я«ЄЯ«░Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї. Я«ЁЯ«цЯ«ЙЯ«хЯ«цЯ»Ђ Я«ЁЯ«БЯ»Ђ Я«еЯ«┐Я«▓Я»ѕЯ«фЯ»ЇЯ«фЯ»ЂЯ«цЯ»ЇЯ«цЯ«ЕЯ»ЇЯ««Я»ѕЯ«»Я»ѕ Я«ЁЯ«ЪЯ»ѕЯ«»Я«цЯ»Ї Я«цЯ»ЄЯ«хЯ»ѕЯ«»Я«ЙЯ«Е 8 Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»ѕЯ«фЯ»Ї Я«фЯ»єЯ«▒ Я««Я»ЂЯ«▒Я»ѕЯ«»Я»Є,
3,2,1 Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»Ї Я«цЯ»ЄЯ«хЯ»ѕЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е. Я«ЁЯ«БЯ»ЂЯ«хЯ«┐Я«ЕЯ»Ї Я«хЯ»єЯ«│Я«┐Я«ЋЯ»ЇЯ«ЋЯ»ѓЯ«ЪЯ»Ђ Я««Я»ЂЯ«┤Я»ЂЯ««Я»ѕЯ«»Я«ЙЯ«Ћ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я«ЙЯ«▓Я»Ї Я«еЯ«┐Я«░Я«фЯ»ЇЯ«фЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«ЪЯ«┐Я«░Я»ЂЯ«фЯ»ЇЯ«фЯ«┐Я«ЕЯ»Ї,
Я«ЁЯ«цЯ»ЇЯ«цЯ«ЕЯ«┐Я««Я«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»Ї Я«ЄЯ«БЯ»ѕЯ«цЯ«┐Я«▒Я«ЕЯ»Ї Я«фЯ»ѓЯ«юЯ»ЇЯ«юЯ«┐Я«»Я««Я»Ї Я«єЯ«ЋЯ»ЂЯ««Я»Ї.
Я«ј.Я«ЋЯ«Й. Я«еЯ«┐Я«»Я«ЙЯ«ЕЯ«┐Я«ЕЯ»Ї Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»Ї Я«хЯ«ЪЯ«┐Я«хЯ««Я»ѕЯ«фЯ»ЇЯ«фЯ»Ђ 2,8
(Я««Я»ЂЯ«ЪЯ«┐Я«хЯ»Ђ Я«фЯ»єЯ«▒Я»ЇЯ«▒Я«цЯ»Ђ). Я«ЁЯ«цЯ«ЕЯ«ЙЯ«▓Я»Ї,
Я«ЁЯ«цЯ«ЕЯ»Ї Я«ЄЯ«БЯ»ѕЯ«цЯ«┐Я«▒Я«ЕЯ»Ї Я«фЯ»ѓЯ«юЯ»ЇЯ«юЯ«┐Я«»Я««Я»Ї Я«єЯ«ЋЯ»ЂЯ««Я»Ї.
Я«ЋЯ«БЯ«ЋЯ»ЇЯ«ЋЯ»ђЯ«ЪЯ»Ђ 3
Я««Я»єЯ«ЋЯ»ЇЯ«ЕЯ»ђЯ«џЯ«┐Я«»Я««Я»Ї Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«џЯ«▓Я»ЇЯ«ЃЯ«фЯ«░Я«┐Я«ЕЯ»Ї Я«ЄЯ«БЯ»ѕ Я«цЯ«┐Я«▒Я«ЕЯ»ѕЯ«ЋЯ»Ї Я«ЋЯ»ЂЯ«▒Я«┐Я«фЯ»ЇЯ«фЯ«┐Я«ЪЯ»Ђ.
Я«цЯ»ђЯ«░Я»ЇЯ«хЯ»Ђ
Я««Я»єЯ«ЋЯ»ЇЯ«ЕЯ»ђЯ«џЯ«┐Я«»Я«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»Ї Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»Ї Я«хЯ«ЪЯ«┐Я«хЯ««Я»ѕЯ«фЯ»ЇЯ«фЯ»Ђ 2,8,2 Я«ЁЯ«цЯ«ЕЯ«ЙЯ«▓Я»Ї Я«ЁЯ«цЯ«ЕЯ»Ї Я«ЄЯ«БЯ»ѕЯ«цЯ«┐Я«▒Я«ЕЯ»Ї 2.
Я«џЯ«▓Я»ЇЯ«ЃЯ«фЯ«░Я«┐Я«ЕЯ»Ї Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»Ї Я«хЯ«ЪЯ«┐Я«хЯ««Я»ѕЯ«фЯ»ЇЯ«фЯ»Ђ 2,8,6 Я«ЁЯ«цЯ«ЕЯ«ЙЯ«▓Я»Ї Я«ЁЯ«цЯ«ЕЯ»Ї Я«ЄЯ«БЯ»ѕЯ«цЯ«┐Я«▒Я«ЕЯ»Ї 2.
Я«џЯ»єЯ«»Я«▓Я»ЇЯ«фЯ«ЙЯ«ЪЯ»Ђ 2
Я«фЯ«ЙЯ«ИЯ»ЇЯ«фЯ«░Я«ИЯ»Ї, Я«ЋЯ»ЂЯ«│Я»ІЯ«░Я«┐Я«ЕЯ»Ї, Я«џЯ«┐Я«▓Я«┐Я«ЋЯ»ЇЯ«ЋЯ«ЙЯ«ЕЯ»Ї Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«єЯ«░Я»ЇЯ«ЋЯ«ЙЯ«ЕЯ«┐Я«ЕЯ»Ї Я«ЄЯ«БЯ»ѕЯ«цЯ»ЇЯ«цЯ«┐Я«▒Я«ЕЯ»ѕЯ«ЋЯ»Ї Я«ЋЯ»ЂЯ«▒Я«┐Я«фЯ»ЇЯ«фЯ«┐Я«ЪЯ»Ђ.
Я«џЯ»єЯ«»Я«▓Я»ЇЯ«фЯ«ЙЯ«ЪЯ»Ђ 3
Я«ЋЯ»ђЯ«┤Я»Є Я«ЋЯ»іЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ«│Я»ЇЯ«│ Я««Я«ЙЯ«цЯ«┐Я«░Я«┐Я«»Я»ѕЯ«фЯ»Ї Я«фЯ«ЙЯ«░Я»Ї.
Я«љЯ«еЯ»ЇЯ«цЯ»Ђ Я«ЋЯ»ЂЯ«┤Я»ЂЯ«хЯ»ѕ Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ»ЇЯ«ЋЯ«┐, Я«њЯ«хЯ»ЇЯ«хЯ»іЯ«░Я»Ђ Я«ЋЯ»ЂЯ«┤Я»ЂЯ«хЯ»ЂЯ««Я»Ї Я«ЄЯ«░Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ«ЋЯ»Ї Я«ЋЯ»ѓЯ«ЪЯ«┐Я«» Я«фЯ»іЯ«░Я»ЂЯ«│Я»Ї Я«ЋЯ«│Я»ѕЯ«ЋЯ»Ї Я«ЋЯ»іЯ«БЯ»ЇЯ«ЪЯ»Ђ
(Я«фЯ«еЯ»ЇЯ«цЯ»Ђ, Я««Я«БЯ«┐Я«ЋЯ«│Я»Ї, Я«еЯ»ѓЯ«▓Я»Ї)
Я«еЯ«ЙЯ«ЕЯ»ЇЯ«ЋЯ»Ђ Я«цЯ«ЕЯ«┐Я««Я«ЎЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я««Я«ЙЯ«цЯ«┐Я«░Я«┐Я«»Я»ѕ Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ«Ћ).
