9 ஆம் வகுப்பு அறிவியல் : அலகு 11 : அணு அமைப்பு
ஐசோடோப்புகள், ஐசோபார்கள் மற்றும் ஐசோடோன்கள்
ஐசோடோப்புகள், ஐசோபார்கள் மற்றும் ஐசோடோன்கள்
1. ஐசோடோப்புகள்
இயற்கையில், சில தனிமங்களின் அணுக்கள் ஒரே அணு எண்ணையும் வெவ்வேறு நிறை எண்ணையும் பெற்றிருப்பது அடையாளம் காணப்பட்டுள்ளது. எடுத்துக்காட்டாக,
ஹைட்ரஜன் அணுவின் மூன்று விதமான அணுக்கள் கீழே காண்பிக்கப்பட்டுள்ளன.
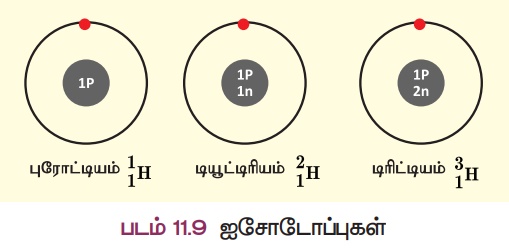
இம்மூன்று அணுக்களின் அணு எண் 1,
ஆனால் நிறை எண் முறையே 1,2 மற்றும் 3 ஆகும். இவை ஐசோடோப்புகள் என்று அழைக்கப்படுகின்றன. மேலும் சில எடுத்துக்காட்டுகள்:

இந்த எடுத்துக்காட்டுகளின் அடிப்படையில் ஐசோடோப்பு என்பது,
ஒத்த அணு எண்ணையும், வேறுபட்ட நிறை எண்ணையும் கொண்ட ஒரு தனிமத்தின் வெவ்வேறு அணுக்கள் எனப்படுகிறது. இவை இருவகைப்படும்: நிலைப்புத் தன்மை உடையவைமற்றும் நிலைப்புத் தன்மையற்றவை. ஐசோடோப்புகளின் நிலையற்ற தன்மைக்குக் காரணம் அவற்றின் அணுக்கருவிலுள்ள கூடுதல் நியூட்ரான்களாகும். இவ்வகை ஐசோடோப்புகள் கதிரியக்கத் தன்மையைப் பெற்றிருப்பதால்,
அவை கதிரியக்க ஐசோடோப்புகள் என அழைக்கப்படுகின்றன.
எடுத்துக்காட்டாக, அணுக்கரு உலையின் மூலமாகிய யுரேனியம்-235 மற்றும் கதிர்வீச்சு சிகிச்சையில் பயன்படுத்தப்படும் கோபால்ட்-60 ஆகியவை கதிரியக்க ஐசோடோப்புகள் ஆகும்.
செயல்பாடு 4
ஆக்ஸிஜனின் ஐசோடோப்புகள் O16 மற்றும் O18 கட்டமைப்பை வரைக.
ஆக்ஸிஜனின் அணுஎண் 8.
2. ஐசோபார்கள்
கால்சியம் (அணு எண் 20)
மற்றும் ஆர்கான் (அணு எண் 18)
ஆகியவற்றைக் கருதுவோம்.
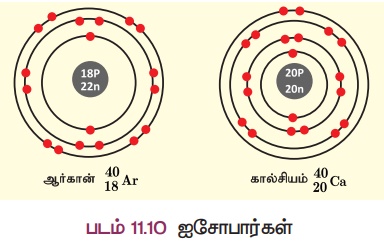
இவற்றில் வெவ்வேறு (படம் 11.10)
எண்ணிக்கையில் புரோட்டான்கள் மற்றும் எலக்ட்ரான்கள் உள்ளன. ஆனால், இவ்விரண்டு தனிமங்களின் நிறை எண் 40 ஆகும். ஆகையால்,
இவற்றின் நியூக்ளியான் எண்ணும் ஒத்த அளவினைப் பெற்றுள்ளது. இவை ஐசோபார்கள் எனப்படும். இவ்வாறாக ஒத்த நிறை எண்களையும் வேறுபட்ட அணு எண்களையும் கொண்ட வெவ்வேறு தனிமங்களின் அணுக்கள் ஐசோபார்கள் எனப்படும்.
மேலும் அறிந்துகொள்வோம்
கட்டை விரல் விதியைப் பயன்படுத்தி t என்பது மேலே எனவும், b என்பது கீழே எனவும் கொள்வோம்.
ஐசோடோப்புகள்:
மேலே உள்ள நிறைஎண் மாறியிருத்தல்; ஐசோபார்கள்:
கீழே உள்ள அணு எண் மாறியிருத்தல்.
3. ஐசோடோன்கள்
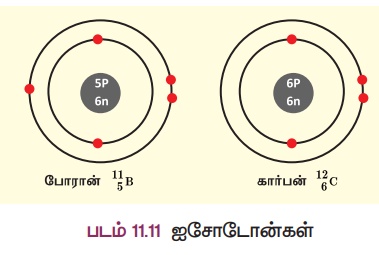
போரானிலுள்ள நியூட்ரான்களின் எண்ணிக்கை = 11 – 5 = 6
கார்பனிலுள்ள நியூட்ரான்களின் எண்ணிக்கை = 12 - 6 = 6
மேற்கண்ட தனிமங்களான போரான், கார்பன் ஆகியவை ஒத்த எண்ணிக்கையில் நியூட்ரான்களைப் பெற்றுள்ளன. ஆனால் புரோட்டான் எண்ணிக்கை வேறுபடுவதால் அவற்றின் அணு எண்களும் வேறுபடுகின்றன. இவ்வாறாக ஒத்த நியூட்ரான் எண்ணிக்கை கொண்ட வெவ்வேறு தனிமங்களின் அணுக்கள் ஐசோடோன்கள் எனப்படும்.
செயல்பாடு 5
கீழ்க்கண்ட ஐசோடோன்
- இணைகளின் மாதிரியை வரைக.
i. ஃபுளூரின் & நியான்
ii. சோடியம் & மெக்னீசியம்
iii. அலுமினியம் & சிலிகன்
வேதிச் சேர்க்கை விதிகள்
17-ஆம் நூற்றாண்டில் அறிவியலாளர்கள் ஒரு பொருளை மற்றொரு பொருளாக மாற்றும் முறைகளைக் கண்டறிய முற்பட்டனர். வேதி மாற்றத்தைப் பற்றிய ஆய்வின் பொழுது சில முக்கியக் கருத்துக்களைப் பொதுமைப்படுத்தினர். இப்பொதுமைப்படுத்தப்பட்ட கருத்துக்களே சேர்க்கை விதிகள் ஆகும். அவைகளானவை:
1.
நிறை மாறா விதி.
2.
மாறா விகித விதி.
3.
பெருக்கல் விகித விதி.
4.
தலைகீழ் விகித விதி.
5. கேலூசாக்கின் பருமன் இணைப்பு விதி.
இந்த ஐந்து விதிகளில், இரண்டு விதிகளைப் பற்றி ஏற்கனவே நீங்கள் அறிந்திருப்பீர்கள். மேலும் உள்ள மூன்று விதிகளைப் பற்றி இப்பாடப் பகுதியில் விளக்கமாகக் காண்போம்.
1. பெருக்கல் விகித விதி
இந்த விதியானது 1804 ஆம் ஆண்டில் ஜான் டால்டன் என்பவரால் முன்மொழியப்பட்டது.
இவ்விதியின் கூற்றுப்படி, A மற்றும் B
என்ற இரண்டு தனிமங்கள் ஒன்றாகச் சேர்ந்து, ஒன்றுக்கும் மேற்பட்ட சேர்மங்களை உருவாக்கும் பொழுது, A - ன் நிறையானது B-ன் நிறையோடு எளிய விகிதத்தில் சேர்ந்திருக்கும்.
இதனை விளக்குவதற்கு கீழ்க்கண்ட எடுத்துக்காட்டைக் காண்போம்.
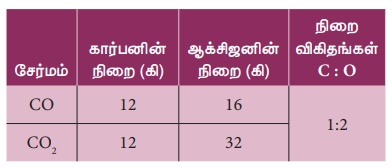
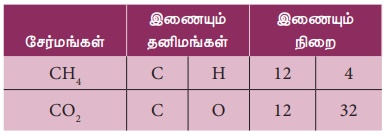
கார்பன், ஆக்சிஜன் உடன் இணைந்து கார்பன் மோனாக்சைடு (CO)
மற்றும் கார்பன் டைஆக்சைடு (CO2)
என்ற இரு ஆக்சைடுகளைத் தருகிறது.
ஒரு குறிப்பிட்ட நிறையுள்ள கார்பனுடன், ஆக்சிஜன் இணைந்து உருவாகும் கார்பன் மோனாக்சைடு (CO)
மற்றும்கார்பன்டைஆக்சைடு (CO2) ஆகியவற்றில் உள்ள ஆக்சிஜனின் நிறை விகிதம் 1:2.
மேலும் ஒரு எடுத்துக்காட்டை எடுத்துக் கொள்வோம். சல்ஃபர்,
ஆக்சிஜனுடன் வினை பர் டைஆக்சைடு மற்றும் சல்ஃபர் ட்ரைஆக்சைடை உருவாக்கும். SO2
மற்றும் SO3
ஆகியவற்றில் உள்ள ஆக்சிஜனின் நிலையான நிறை விகிதம் 2 :3.
2. தலைகீழ் விகித விதி
ஜெர்மியஸ் ரிச்சர் (1792)
என்பவர் தலைகீழ் விகித விதியைப் பற்றிக் கூறினார்.
இவ்விதியின் கூற்றுப்படி, இரண்டு மாறுபட்ட தனிமங்கள் தனித்தனியே ஒரே நிறையுள்ள மூன்றாவது தனிமத்துடன் சேரும்போது, அவற்றின் நிறைகளின் விகிதம் சமமாகவோ அல்லது எளிய பெருக்கல் விகிதத்திலோ இருக்கும்".
கீழே கொடுக்கப்பட்டுள்ள மூன்று தனிமங்களான ஹைட்ரஜன்,
ஆக்சிஜன், மற்றும் கார்பனை கருத்தில் கொள்வோம்.
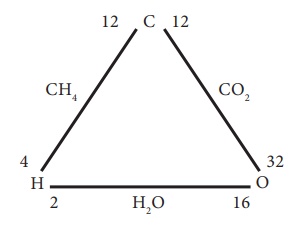
இங்கு, ஹைட்ரஜன் மற்றும் ஆக்சிஜன் ஒத்த நிறையுள்ள கார்பனுடன் வினைபுரிந்து மீத்தேன் (CH4)
மற்றும் கார்பன் டைஆக்சைடைத் (CO2)
தருகிறது.

இதேபோல், ஹைட்ரஜனும் ஆக்ஸிஜனும் இணைந்து நீரினை (H2O)
உருவாக்குகின்றன.
ஹைட்ரஜன் மற்றும் ஆக்ஸிஜன் நிறைகளின் விகிதம்= 2:16
(or) 1:8 (2)
(1) மற்றும் (2)
ஆகியவற்றின் விகிதங்கள் சமமாக உள்ளன. எனவே, தலைகீழ் விகித விதி நிரூபிக்கப்பட்டுள்ளது.
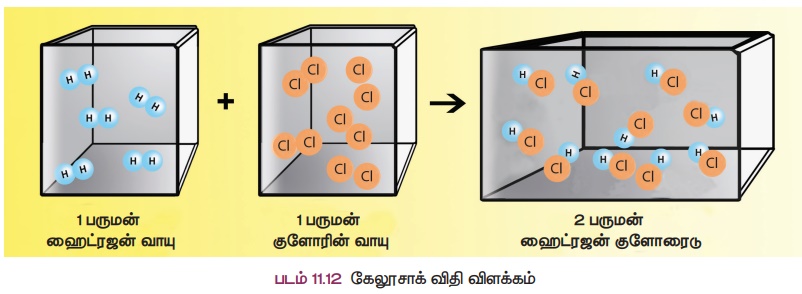
3. கேலூசாக்கின் பருமன் இணைப்பு விதி
வாயுக்கள் வினைபுரியும் போது, அவற்றின் பருமன்கள் அவ்வினையின் விளைபொருள்களின் பருமனுக்கு எளிய முழு எண் விகிதத்தில் இருக்கும் (வாயுக்களின் பருமன்கள் ஒரே வெப்பநிலை மற்றும் அழுத்தத்தில் அளவிடப்படும் பட்சத்தில்).
ஒரு பருமன் ஹைட்ரஜன் வாயுவானது, ஒரு பருமன் குளோரின் வாயுவுடன் வினைபுரிந்து இரண்டு பருமன் ஹைட்ரஜன் குளோரைடு சேர்மத்தைத் தருகிறது. இது பருமனில் 1
: 1 : 2 என்ற எளிய முழு எண் விகிதத்தில் உள்ளது.
செயல்பாடு 6
நைட்ரஜன் ஹைட்ரஜனுடன் சேர்ந்து அம்மோனியா
(NH3) வை உருவாக்குகின்றது.
இந்த எடுத்துக்காட்டினைப் பயன்படுத்தி கே லூசாக்கின் விதியை நிரூபிக்கவும்.
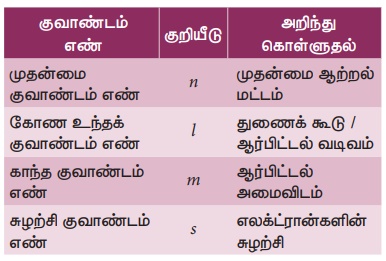
குவாண்டம் எண்கள்
அணுவில் உள்ள ஒவ்வொரு எலக்ட்ரானின் தனித்தன்மை அதன் நான்கு குவாண்டம் எண்களின் அடிப்படையிலேயே அமையும்.
நீங்கள் ஒரு கட்டிடத்தின் இடத்தைக் குறிக்கும் போது, எப்படி பட்டியலிடுவீர்கள்? அது எந்த நாட்டிலுள்ளது, எந்த மாநிலத்திலுள்ளது, எந்த நகரத்திலுள்ளது, அதன் இருப்பிடம் மற்றும் தெரு என்ன, இறுதியாக கதவு எண் என்ன எனக் கேட்பீர்கள். அதைப் போலவே ஒரு அணுவிலுள்ள எலக்ட்ரான்களின் அமைவிடத்தையும் நாம் குறிக்கலாம்.
அணுவின் உள்ளிருக்கும் அணு ஆர்ப்பிட்டல் மற்றும் எலக்ட்ரான்களின் வடிவமைப்பு மற்றும் வேறுபாட்டைக் குறிக்கும் எண்கள் "குவாண்டம் எண்கள்" எனப்படும்.
இதைப் பற்றி மேலும் உயர் வகுப்பில் அறிந்து கொள்வீர்கள்.
நினைவில் கொள்க
❖ ரூதர்போர்டின் ஆல்பா துகள்களின் சிதறல் சோதனை, அணுக்கரு கண்டுபிடிப்பிற்கு வித்திட்டது.
❖ ஜெ. சாட்விக் -
உட்கருவில் நியூட்ரான்கள் உள்ளதைக் கண்டுபிடித்தார்.
❖ நிறை எண் என்பது புரோட்டான் மற்றும் நியூட்ரான்களின் மொத்த எண்ணிக்கையைக் குறிப்பதாகும்.
❖ வெளிப்புற ஆற்றல் மட்டத்தில் உள்ள எலக்ட்ரான்கள், இணைதிறன் எலக்ட்ரான்கள் எனப்படும்.
❖ அணுவின் இணையும் திறனானது இணைதிறன் எனப்படும்.
❖ ஒரே அணு எண் மற்றும் வெவ்வேறு நிறை எண்களைக் கொண்ட ஒரே தனிமத்தின் அணுக்கள் ஐசோடோப் எனப்படும்.
❖ ஒரே நிறை எண்ணையும், வெவ்வேறு அணு எண்ணையும் கொண்ட வெவ்வேறு தனிமத்தின் அணுக்கள் ஐசோபார் எனப்படும்.
❖ ஒரே எண்ணிக்கையில் நியூட்ரான்களையும் ஆனால் வெவ்வேறு அணு எண் மற்றும் நிறை எண் கொண்ட வெவ்வேறு தனிமத்தின் அணுக்கள் ஐசோடோன்கள் எனப்படுகின்றன.
A-Z சொல்லடைவு
அணு : ஒரு வேதிவினையில் ஈடுபடும் மிகச்சிறிய துகள்.
எலக்ட்ரான்
: மின் கடத்துத்திறன் கொண்ட அனைத்து திண்மங்களிலும் காணப்படும் எதிர்மின் சுமை கொண்ட துகள்கள்.
நியூட்ரான் : ஆவர்த்தன அட்டவணையில் ஹைட்ரஜனைத் தவிர அனைத்துத் தனிமங்களின் உட்கருவிலும் காணப்படும் அணுவின் உட்கருவில் உள்ள மின்சுமையற்ற துகள்.
ஆர்பிட்டல்
: அணுவின் உட்கருவைச் சுற்றி எலக்ட்ரான்களால் நிரப்பப்பட்ட சுற்றுவட்டப்பாதை.
புரோட்டான் : எலக்ட்ரான்களின் மின்சுமைக்குச் சமமான நேர்மின் சுமை கொண்ட அணுவின் உட்கருவிலுள்ள துகள்.
குவாண்டம் எண் : அணுவின் உள்ளிருக்கும் அணு ஆர்ப்பிட்டல், எலக்ட்ரான்களின் வடிவமைப்பு மற்றும் வேறுபாட்டைக் குறிக்கும் எண்கள்.