9 ஆம் வகுப்பு அறிவியல் : அலகு 12 : தனிமங்களின் வகைப்பாட்டு அட்டவணை
நவீன கால தனிம வரிசை அட்டவணை
நவீன கால தனிம வரிசை அட்டவணை
1913 ல்,
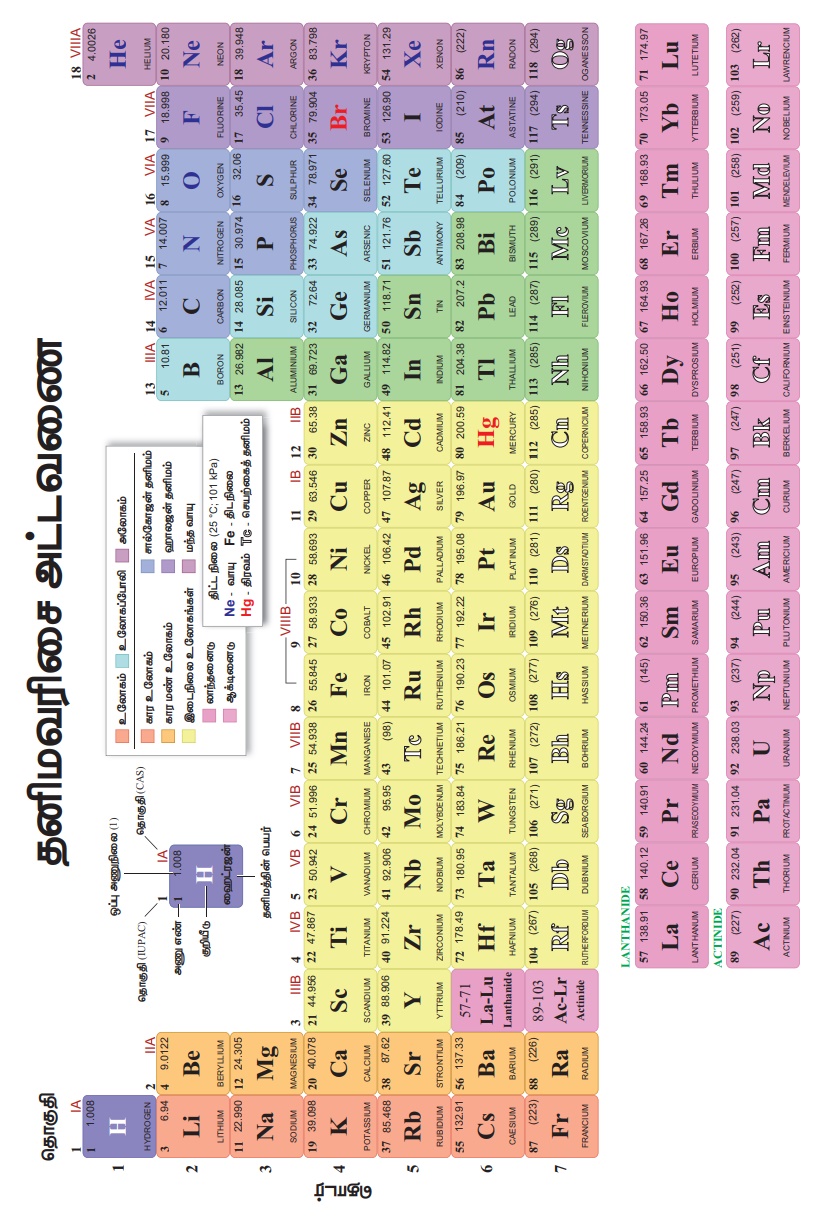
ஆங்கிலேய இயற்பியலாளர் ஹென்றி மோஸ்லே என்பவர் தன்னுடைய X-கதிர் சிதைவு சோதனை மூலம் தனிமங்களின் பண்புகள் அவற்றின் அணு எண்ணைப் பொறுத்து இருக்குமே தவிர அவற்றின் நிறையைப் பொறுத்து இருக்காது என்று நிரூபித்தார். இதன் விளைவாக நவீன கால தனிம வரிசை அட்டவணையானது அணு எண்ணின் ஏறு வரிசையில் அமைக்கப்பட்டது.
இந்த நவீன கால அட்டவணை மெண்டலீஃப் அட்டவணையின் ஒரு விரிவு படுத்தலே ஆகும். மெண்டலீஃப் அட்டவணை குறும் அட்டவணை என்றும் நவீன அட்டவணை நீண்ட அட்டவணை என்றும் அறியப்படுகிறது.
1. நவீன ஆவர்த்தன விதி
ஒரு தனிமத்தின் அணு எண்ணானது (Z)
அவற்றிலுள்ள புரோட்டான்களின் (நேர் மின் சுமை) எண்ணிக்கையை மட்டும் குறிப்பதில்லை அவற்றிலுள்ள எலக்ட்ரான்களின் (எதிர் மின் சுமை) எண்ணிக்கையையும் குறிக்கிறது. தனிமங்களின் இயற்பியல் மற்றும் வேதியியல் பண்புகள் அவற்றின் புரோட்டான்களின் எண்ணிக்கையச் சார்ந்தவை அல்ல;
மாறாக எலக்ட்ரான்களின் எண்ணிக்கையையும் சார்ந்ததாகும். எனவே நவீன ஆவர்த்தன விதியை இவ்வாறு கூறலாம். "தனிமங்களின் இயற்பியல் மற்றும் வேதியியல் பண்புகள் அவற்றின் அணு எண்களின் தனிம வரிசை செயல்பாடுகளாகும்". இந்த நவீன விதியை வைத்து நவீன தனிம வரிசை அட்டவணை உருவாக்கப்பட்டது.
2. நீள் வரிசை தனிம அட்டவணை அமைப்பின் சிறப்புகள்
● அனைத்துத் தனிமங்களும் அவற்றின் அதிகரிக்கும் அணு எண்ணிற்கு ஏற்றாற்போல் அமைக்கப்பட்டுள்ளன.
● தனிம அட்டவணையில் தனிமங்கள் கிடைமட்டமாக வரிசைப்படுத்தப்பட்ட அமைப்பு 'தொடர்கள்' என அழைக்கப்படுகிறது. மொத்தம் ஏழு தொடர்கள் உள்ளன.
● தனிமங்கள் அவற்றின் அணுக்களில் உள்ள கூடுகளின் எண்ணிக்கைகளுக்கு ஏற்ப வரிசைகளில் அமைக்கப்படும்.
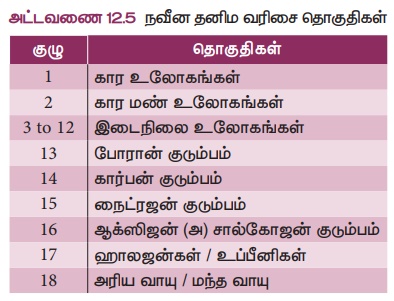
● தனிம வரிசை அட்டவணையில் மேலிருந்து கீழாக செங்குத்தாக உள்ள பத்தி 'தொகுதிகள்' எனப்படும். தனிம அட்டவணையில் 18 தொகுதிகள் உள்ளன.
● ஒவ்வொரு தொகுதியிலும் உள்ள தனிமங்களின் பண்பிற்கு ஏற்ப இவை பல குடும்பங்களாகப் பிரிக்கப்பட்டுள்ளன.
3. தனிமங்களை தொகுதிகளாக வரிசைப் படுத்துதல்
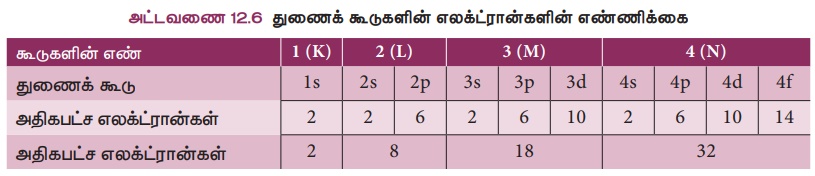
ஒரு தனிமத்தில் அவற்றின் எலக்ட்ரான்கள் உட்கருவைச் சுற்றி கூடுகளில் வைக்கப்பட்டுள்ளன என்பதை நாம் அறிவோம். ஒவ்வொரு கூடும் ஒன்று அல்லது அதற்கு மேற்பட்ட துணைக் கூடுகளைக் கொண்டுள்ளது. இவற்றில் எலக்ட்ரான்கள் ஒரு குறிப்பிட்ட வகையில் நிரப்பப்படுகின்றன.
தனிமவரிசை அட்டவணை
இந்த துணைக் கூடுகள் s,
p, d மற்றும் f ஆகும். துணைக்கூடுகளில் எலக்ட்ரான்கள் வைக்கப்பட்டுள்ள அமைப்பின் அடிப்படையில் தனிமங்கள் s, p, d மற்றும் f
என நான்கு துணைத் தொகுதிகளாகப் பிரிக்கப்பட்டுள்ளன.
1.
S-தொகுதி தனிமங்கள்: தொகுதி 1 மற்றும் 2-இல் உள்ள தனிமங்களை சீரமைக்கும் போது கடைசி எலக்ட்ரானானது s
துணைக் கூட்டில் வைக்கப்படுகிறது. எனவே இந்த தனிமங்கள் s - தொகுதி தனிமங்கள் என்று அழைக்கப்படுகின்றன. ஹைட்ரஜன் தவிர தொகுதி ஒன்றின் தனிமங்கள் உலோகங்களாகும். இவை நீருடன் வினைபுரிந்து உருவாக்கும் கரைசலானது காய்கறிகளிலிருந்து கிடைக்கும் சிவப்பு சாயத்தை ஊதா நிறத்துக்கு மாற்றும். இந்தக் கரைசல்கள் அதிக காரத்தன்மை கொண்டதாகக் காணப்படுகின்றன. எனவே,
இவை கார உலோகங்கள் அழைக்கப்படுகின்றன.
தொகுதி 2 இன் தனிமங்களும் உலோகங்களே. இவை ஆக்ஸிஜனோடு இணைந்து ஆக்ஸைடுகளை உருவாக்குகின்றன. முன்பு இவை 'புவி'
என்று அழைக்கப்பட்டன. இந்த ஆக்ஸைடுகள் நீரில் கரையும் போது கார கரைசல்களை உருவாக்குகின்றன. எனவே, இவை கார மண் உலோகங்கள் என அழைக்கப்படுகின்றன.
2.
p-தொகுதி தனிமங்கள்: இவை அட்டவணையில் 13 முதல் 18 தொகுதிகள் வரை உள்ளன. இவற்றில் போரான்,
கார்பன், நைட்ரஜன், ஆக்ஸிஜன், புளுரின் குடும்பம் மற்றும் மந்த வாயுக்கள் (ஹீலியம் தவிர) அடங்கும். இவை பிரதி நிதித்துவ தனிமங்கள் என்று அழைக்கப்படுகின்றன. p
தொகுதி பெரிய அளவில் வேறுபட்ட தனிமங்களின் சங்கமமாகும். இந்த ஒரு தொகுதியில்மட்டுமே உலோகங்கள்,
அலோகங்கள் மற்றும் உலோகப் போலிகள் என்ற மூன்று வகைப்பாடும் காணப்படுகின்றன.
3.
d-தொகுதி தனிமங்கள்: இவை 3 முதல் 12 தொகுதி வரை உள்ளதனிமங்களை உள்ளடக்கியது. இவை தனிம அட்டவணையின் மையத்தில் காணப் படுகின்றன. இவற்றின் பண்புகள் S தொகுதி மற்றும் p
தொகுதி தனிமங்களுக்கு இடையில் காணப்படும். எனவே, இவை இடைநிலைத் தனிமங்கள் என அழைக்கப் படுகின்றன.
4.
f-தொகுதி தனிமங்கள்: இவை லாந்தனத்தை அடுத்துள்ள லாந்தனைடுகள் எனப்படும் 14 தனிமங்களையும் ஆக்டினத்தை அடுத்துள்ள ஆக்டினைடுகள் எனப்படும் 14 தனிமங்களையும் உள்ளடக்கியதாகும். இவை தனிமங்களின் வகைப்பாட்டு அட்டவணை
தனிம வரிசை அட்டவணையில் அடிப்பாகத்தில் வைக்கப்பட்டுள்ளன. இவை உள் இடைநிலைத் தனிமங்கள் என்றும் அழைக்கப்படுகின்றன.
4. நவீன தனிம வரிசை அட்டவணையின் சிறப்புகள்
● இந்த அட்டவணை அணுவின் மிகுந்த அடிப்படைத் தன்மையான அணு எண்ணை அடிப்படையாகக் கொண்டது.
● இது தனிமத்தின் அமைவிடத்தையும் அணு அமைப்பையும் தெளிவாக ஒருங்கிணைக்கிறது. .
● ஒவ்வொரு தொடர் முடிவதும் வாதப் பொருத்தமானது. ஒரு தொடரில் அணு எண் அதிகரிக்க அதிகரிக்க ஆற்றல் கூடுகள் மந்த வாயு வரும் வரை மெதுவாக நிரம்புகின்றன.
● இது நினைவில் வைத்துக் கொள்வதற்கும் மறுபடி உருவாக்குவதற்கும் எளியது.
● ஒவ்வொரு தொகுதியும் தற்சார்பு உடையது. இதனால் துணைத் தொகுதிகள் வேண்டாம் என முடிவு செய்யப்பட்டது.
● ஒரு தனிமத்தின் ஐசோடோப்புகள் ஒரே அணு எண்ணைக் கொண்டுள்ளதால் அவற்றிற்கு ஒரே அமைவிடம் போதும் என எடுத்துக் கொள்ளப்பட்டது.
● எட்டாம் தொகுதியின் (மெண்டெலீவ் அட்டவணை) அமைவிடமும் சரி என நிரூபிக்கப்பட்டது. இடை நிலைத் தனிமங்களின் பண்புகள் அவற்றின் வலது மற்றும் இடதுபுறம் உள்ள தனிமங்களின் பண்புகளுக்கு இடைப்பட்டதாக உள்ளதால் அவை நடுவில் கொண்டுவரப்பட்டன.
● இந்த அட்டவணை உலோகங்களையும் அலோகங்களையும் தனித் தனியாக பிரிக்கிறது. அலோகங்கள் அட்டவணையின் மேல் வலது மூலையில் அமைந்துள்ளன.
● மெண்ட்லீவ் அட்டவணையில் இடம் மாறி வைக்கப்பட்டிருந்த தனிமங்கள் அனைத்தும் சரி செய்யப்பட்டு தற்போது சரியான இடத்தில் வைக்கப்பட்டுள்ளன. ஏனென்றால் இவை அணு எண்ணை அடிப்படையாகக் கொண்டவை.
● லாந்தனைடுகளும் ஆக்டினைடுகளும் அட்டவணையின் அடியில் வைக்கப்பட்டதற்கு சரியான காரணம் கொடுக்கப்பட்டது.
5. தனிம வரிசை அட்டவணையில் ஹைட்ரஜனின் நிலைப்பாடு
ஹைட்ரஜன் மிகவும் லேசான, சிறிய மற்றும் தனிம வரிசை அட்டவணையில் முதல் தனிமமாகும். இதனுடைய அணு அமைப்பு (1S1)
மிகவும் எளியது. இது அட்டவணையில் ஒரு தனி இடத்தில் உள்ளது. இவை கார உலோகம் மற்றும் ஹாலஜனின் பண்பை தன்னுள் கொண்டுள்ளன.
அட்டவணை 12.6 துணைக் கூடுகளின் எலக்ட்ரான்களின் எண்ணிக்கை
1.
ஹைட்ரஜன் தனது ஒரே எலக்ட்ரானை இழந்து கார உலோகங்களைப் போல நேர் மின் அயனியாக (H+)
மாறும் தன்மை உடையது.
2.
இது ஹேலஜன்கள் (உப்பீனிகள்) போல ஒரு எலக்ட்ரானைப் பெற்று ஹைட்ரைடுகளாக (H-)
மாறும் தன்மை கொண்டுள்ளது.
3. கார உலோகங்கள் திண்மங்கள்;
அதே வேளையில் ஹைட்ரஜன் ஒரு வாயு.
எனவே தனிம வரிசை அட்டவணையில் ஹைட்ரஜனின் நிலைப்பாடு இன்னும் சர்ச்சைக்குரியதே. ஏனென்றால் ஹைட்ரஜனின் பண்புகள் தனித்தன்மை கொண்டவையாகும்.
6. மந்த வாயுக்களின் நிலைப்பாடு
ஹீலியம், நியான், ஆர்கான், கிரிப்டான், செனான் மற்றும் 18ஆம் தொகுதியில் உள்ள ரேடான் போன்ற தனிமங்கள் அரிய வாயுக்கள் அல்லது மந்த வாயுக்கள் என அழைக்கப் படுகின்றன. இவை ஓரணுத் தனிமங்கள். மற்ற பொருட்களுடன் அவ்வளவு எளிதில் வினை புரிவதில்லை . எனவே, இவைமந்தவாயுக்கள் என்று அழைக்கப்படுகின்றன. மேலும், இவை மிகச் சிறிய அளவிலேயே காணப்படுகின்றன. எனவே, இவை அரிய வாயுக்கள் என்றும் அழைக்கப்படுகின்றன.