Я«хЯ«ЋЯ»ѕЯ«ЋЯ«│Я»Ї, Я«фЯ«БЯ»ЇЯ«фЯ»ЂЯ«ЋЯ«│Я»Ї, Я«фЯ«»Я«ЕЯ»ЇЯ«ЋЯ«│Я»Ї, Я«ЄЯ«░Я«ЙЯ«юЯ«цЯ«┐Я«░Я«ЙЯ«хЯ«ЋЯ««Я»Ї - Я«ЁЯ««Я«┐Я«▓Я«ЎЯ»ЇЯ«ЋЯ«│Я»Ї | 9th Science : Acids, Bases and Salts
9 Я«єЯ««Я»Ї Я«хЯ«ЋЯ»ЂЯ«фЯ»ЇЯ«фЯ»Ђ Я«ЁЯ«▒Я«┐Я«хЯ«┐Я«»Я«▓Я»Ї : Я«ЁЯ«▓Я«ЋЯ»Ђ 14 : Я«ЁЯ««Я«┐Я«▓Я«ЎЯ»ЇЯ«ЋЯ«│Я»Ї, Я«ЋЯ«ЙЯ«░Я«ЎЯ»ЇЯ«ЋЯ«│Я»Ї Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«ЅЯ«фЯ»ЇЯ«фЯ»ЂЯ«ЋЯ«│Я»Ї
Я«ЁЯ««Я«┐Я«▓Я«ЎЯ»ЇЯ«ЋЯ«│Я»Ї
Я«ЁЯ««Я«┐Я«▓Я«ЎЯ»ЇЯ«ЋЯ«│Я»Ї
Я«ЋЯ»ђЯ«┤Я»Є Я«ЋЯ»іЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ«│Я»ЇЯ«│ Я«еЯ««Я«цЯ»Ђ Я«ЁЯ«ЕЯ»ЇЯ«▒Я«ЙЯ«Ъ Я«хЯ«ЙЯ«┤Я»ЇЯ«хЯ«┐Я«▓Я»Ї Я«фЯ«»Я«ЕЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї Я«џЯ«┐Я«▓ Я«фЯ»іЯ«░Я»ЂЯ«ЪЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«фЯ«ЪЯ«цЯ»ЇЯ«цЯ»ѕЯ«фЯ»Ї Я«фЯ«ЙЯ«░Я»ЇЯ«ЋЯ»ЇЯ«ЋЯ«хЯ»ЂЯ««Я»Ї.
Я«џЯ«ЙЯ«фЯ»ЇЯ«фЯ«┐Я«ЪЯ«ЋЯ»ЇЯ«ЋЯ»ѓЯ«ЪЯ«┐Я«» Я«ЄЯ«еЯ»ЇЯ«ц Я«ЁЯ«ЕЯ»ѕЯ«цЯ»ЇЯ«цЯ»ЂЯ«фЯ»Ї Я«фЯ»іЯ«░Я»ЂЯ«│Я»ЇЯ«ЋЯ«│Я»ЂЯ««Я»Ї Я«њЯ«░Я»Є Я«џЯ»ЂЯ«хЯ»ѕЯ«»Я»ѕЯ«ЋЯ»Ї Я«ЋЯ»іЯ«БЯ»ЇЯ«ЪЯ«хЯ»ѕ. Я«ЁЯ«цЯ«ЙЯ«хЯ«цЯ»Ђ Я«фЯ»ЂЯ«│Я«┐Я«фЯ»ЇЯ«фЯ»ЂЯ«џЯ»Ї Я«џЯ»ЂЯ«хЯ»ѕ. Я«ЄЯ«еЯ»ЇЯ«ц Я«фЯ»ЂЯ«│Я«┐Я«фЯ»ЇЯ«фЯ»ЂЯ«џЯ»Ї Я«џЯ»ЂЯ«хЯ»ѕЯ«»Я»ѕ Я«јЯ«цЯ»Ђ Я«ЈЯ«▒Я»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ? Я«ЁЯ«хЯ«▒Я»ЇЯ«▒Я«┐Я«▓Я»Ї Я«ЅЯ«│Я»ЇЯ«│ Я«ЈЯ«цЯ»І Я«њЯ«░Я»Ђ Я«хЯ«ЋЯ»ѕЯ«»Я«ЙЯ«Е Я«хЯ»ЄЯ«цЯ«┐Я«џЯ»Ї Я«џЯ»ЄЯ«░Я»ЇЯ««Я«ЎЯ»ЇЯ«ЋЯ«│Я»Ї Я«фЯ»ЂЯ«│Я«┐Я«фЯ»ЇЯ«фЯ»ЂЯ«џЯ»Ї Я«џЯ»ЂЯ«хЯ»ѕЯ«»Я»ѕ Я«ЈЯ«▒Я»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е. Я«ЄЯ«хЯ»ѕЯ«ЋЯ«│Я»Ї Я«ЁЯ««Я«┐Я«▓Я«ЎЯ»ЇЯ«ЋЯ«│Я»Ї Я«јЯ«ЕЯ»ЇЯ«▒Я«┤Я»ѕЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е. 'Я«єЯ«џЯ«┐Я«ЪЯ»Ї' Я«јЯ«ЕЯ»ЇЯ«▒ Я«єЯ«ЎЯ»ЇЯ«ЋЯ«┐Я«▓Я«џЯ»Ї Я«џЯ»іЯ«▓Я»Ї 'Я«ЁЯ«џЯ«┐Я«ЪЯ«ИЯ»Ї' Я«јЯ«ЕЯ»ЇЯ«▒ Я«ЄЯ«▓Я«цЯ»ЇЯ«цЯ»ђЯ«ЕЯ»Ї Я««Я»іЯ«┤Я«┐Я«»Я«┐Я«▓Я«┐Я«░Я»ЂЯ«еЯ»ЇЯ«цЯ»Ђ Я«фЯ»єЯ«▒Я«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«ЪЯ«цЯ»Ђ. Я«ЁЯ«цЯ«ЕЯ»Ї Я«фЯ»іЯ«░Я»ЂЯ«│Я»Ї Я«фЯ»ЂЯ«│Я«┐Я«фЯ»ЇЯ«фЯ»ЂЯ«џЯ»Ї Я«џЯ»ЂЯ«хЯ»ѕ. Я«фЯ»ЂЯ«│Я«┐Я«фЯ»ЇЯ«фЯ»ЂЯ«џЯ»Ї Я«џЯ»ЂЯ«хЯ»ѕ Я«ЋЯ»іЯ«БЯ»ЇЯ«Ъ Я«фЯ»іЯ«░Я»ЂЯ«│Я»ЇЯ«ЋЯ«│Я»Ї Я«ЁЯ««Я«┐Я«▓Я«ЎЯ»ЇЯ«ЋЯ«│Я»Ї Я«јЯ«ЕЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї.

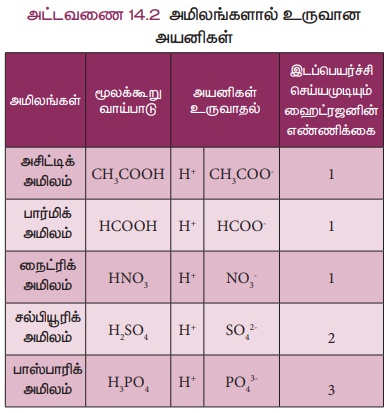
1884-Я«єЯ««Я»Ї Я«єЯ«БЯ»ЇЯ«ЪЯ»ЂЯ«ИЯ»ЇЯ«хЯ»ђЯ«ЪЯ«ЕЯ»Ї Я«еЯ«ЙЯ«ЪЯ»ЇЯ«ЪЯ»Ђ Я«хЯ»ЄЯ«цЯ«┐Я«»Я«┐Я«»Я«▓Я«ЙЯ«░Я»Ї Я«ИЯ»ЇЯ«хЯ«ЙЯ«ЕЯ»ЇЯ«ЪЯ»Є Я«ЁЯ«░Я»ЇЯ«╣Я»ђЯ«ЕЯ«┐Я«»Я«ИЯ»Ї Я«ЁЯ««Я«┐Я«▓Я«ЎЯ»ЇЯ«ЋЯ«│Я»Ї Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«ЋЯ«ЙЯ«░Я«ЎЯ»ЇЯ«ЋЯ«│Я»ѕЯ«фЯ»Ї Я«фЯ«▒Я»ЇЯ«▒Я«┐Я«» Я«ЋЯ»іЯ«│Я»ЇЯ«ЋЯ»ѕЯ«»Я»ѕ Я««Я»ЂЯ«ЕЯ»ЇЯ««Я»іЯ«┤Я«┐Я«еЯ»ЇЯ«цЯ«ЙЯ«░Я»Ї. Я«ЁЯ«░Я»ЇЯ«╣Я»ђЯ«ЕЯ«┐Я«»Я«ИЯ»Ї Я«ЋЯ»ѓЯ«▒Я»ЇЯ«▒Я»ЂЯ«фЯ»ЇЯ«фЯ«ЪЯ«┐, Я«ЁЯ««Я«┐Я«▓Я«ЎЯ»ЇЯ«ЋЯ«│Я»Ї Я«еЯ»ђЯ«░Я«┐Я«▓Я»Ї Я«ЋЯ«░Я»ѕЯ«»Я»ЂЯ««Я»Ї Я«фЯ»іЯ«┤Я»ЂЯ«цЯ»Ђ H+ Я«ЁЯ«»Я«ЕЯ«┐Я«ЋЯ«│Я»ѕЯ«»Я»І Я«ЁЯ«▓Я»ЇЯ«▓Я«цЯ»Ђ H3O+
Я«ЁЯ«»Я«ЕЯ«┐Я«ЋЯ«│Я»ѕЯ«»Я»І Я«цЯ«░Я»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е. Я«ЁЯ««Я«┐Я«▓Я«ЎЯ»ЇЯ«ЋЯ«│Я»Ї Я«њЯ«ЕЯ»ЇЯ«▒Я»Ђ Я«ЁЯ«▓Я»ЇЯ«▓Я«цЯ»Ђ Я«ЁЯ«цЯ«▒Я»ЇЯ«ЋЯ»Ђ Я««Я»ЄЯ«▒Я»ЇЯ«фЯ«ЪЯ»ЇЯ«Ъ Я«ЄЯ«ЪЯ«фЯ»ЇЯ«фЯ»єЯ«»Я«░Я»ЇЯ«џЯ»ЇЯ«џЯ«┐ Я«џЯ»єЯ«»Я»ЇЯ«»Я«цЯ»ЇЯ«цЯ«ЋЯ»ЇЯ«Ћ Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я«юЯ«ЕЯ»Ї Я«ЁЯ«БЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«│Я»ѕЯ«ЋЯ»Ї Я«ЋЯ»іЯ«БЯ»ЇЯ«ЪЯ«хЯ»ѕ.
Я«јЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«ЙЯ«ЪЯ»ЇЯ«ЪЯ«ЙЯ«Ћ Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я«юЯ«ЕЯ»Ї Я«ЋЯ»ЂЯ«│Я»ІЯ«░Я»ѕЯ«ЪЯ»Ђ Я«еЯ»ђЯ«░Я«┐Я«▓Я»Ї Я«ЋЯ«░Я»ѕЯ«»Я»ЂЯ««Я»Ї Я«фЯ»іЯ«┤Я»ЂЯ«цЯ»Ђ H+ Я«ЁЯ«»Я«ЕЯ«┐Я«ЋЯ«│Я»ѕЯ«»Я»ЂЯ««Я»Ї,
CI- Я«ЁЯ«»Я«ЕЯ«┐Я«ЋЯ«│Я»ѕЯ«»Я»ЂЯ««Я»Ї Я«цЯ«░Я»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
HCI
(aq) Рєњ H+ (aq) + Cl- (aq)
Я«еЯ»ђЯ«░Я«┐Я«▓Я»Ї Я«ЁЯ««Я«┐Я«▓Я««Я»Ї Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«ЋЯ«ЙЯ«░Я«цЯ»ЇЯ«цЯ«┐Я«▒Я»ЇЯ«ЋЯ»Ђ Я«јЯ«ЕЯ»ЇЯ«Е Я«еЯ«┐Я«ЋЯ«┤Я»ЂЯ««Я»Ї? Я«еЯ»ђЯ«░Я»ЇЯ«цЯ»ЇЯ«ц Я«ЋЯ«░Я»ѕЯ«џЯ«▓Я«┐Я«▓Я»Ї Я««Я«ЪЯ»ЇЯ«ЪЯ»ЂЯ««Я»ЇЯ«цЯ«ЙЯ«ЕЯ»Ї Я«ЁЯ««Я«┐Я«▓Я«ЎЯ»ЇЯ«ЋЯ«│Я»Ї Я«ЁЯ«»Я«ЕЯ«┐Я«ЋЯ«│Я»ѕЯ«цЯ»Ї Я«цЯ«░Я»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«ЕЯ«хЯ«Й? Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я»І Я«ЋЯ»ЂЯ«│Я»ІЯ«░Я«┐Я«ЋЯ»Ї Я«ЁЯ««Я«┐Я«▓Я««Я»Ї Я«еЯ»ђЯ«░Я»ЂЯ«ЪЯ«ЕЯ»Ї Я«хЯ«┐Я«ЕЯ»ѕЯ«фЯ»ЂЯ«░Я«┐Я«еЯ»ЇЯ«цЯ»Ђ Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я«юЯ«ЕЯ»Ї Я«ЁЯ«»Я«ЕЯ«┐Я«ЋЯ«│Я»ѕЯ«цЯ»Ї Я«цЯ«░Я»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«еЯ»ђЯ«░Я»Ї Я«ЄЯ«▓Я»ЇЯ«▓Я«ЙЯ«ц Я«фЯ»іЯ«┤Я»ЂЯ«цЯ»Ђ Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я»ІЯ«ЋЯ»ЂЯ«│Я»ІЯ«░Я«┐Я«ЋЯ»Ї Я«ЁЯ««Я«┐Я«▓Я«цЯ»ЇЯ«цЯ«┐Я«▓Я»Ї Я«ЅЯ«│Я»ЇЯ«│ Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я«юЯ«ЕЯ»Ї Я«ЁЯ«»Я«ЕЯ«┐Я«ЋЯ«│Я»ѕЯ«фЯ»Ї Я«фЯ«┐Я«░Я«┐Я«ЋЯ»ЇЯ«Ћ Я««Я»ЂЯ«ЪЯ«┐Я«»Я«ЙЯ«цЯ»Ђ.
HCl
+ H2O Рєњ H3O+ +
Cl-
Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я«юЯ«ЕЯ»Ї Я«ЁЯ«»Я«ЕЯ«┐Я«ЋЯ«│Я»Ї Я«цЯ«ЕЯ«┐Я«цЯ»ЇЯ«цЯ»ЂЯ«ЋЯ»Ї Я«ЋЯ«ЙЯ«БЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«хЯ«цЯ»Ђ Я«ЄЯ«▓Я»ЇЯ«▓Я»ѕ. Я«ЄЯ«хЯ»ѕ Я«еЯ»ђЯ«░Я»ЂЯ«ЪЯ«ЕЯ»Ї Я«џЯ»ЄЯ«░Я»ЇЯ«еЯ»ЇЯ«цЯ»Ђ Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я»ІЯ«ЕЯ«┐Я«»Я««Я»Ї (H3O+)
Я«ЁЯ«»Я«ЕЯ«┐Я«ЋЯ«│Я«ЙЯ«Ћ Я«ЅЯ«│Я»ЇЯ«│Я«Е. Я«єЯ«ЋЯ«хЯ»Є Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я«юЯ«ЕЯ»Ї Я«ЁЯ«»Я«ЕЯ«┐Я«ЋЯ«│Я»Ї H+ Я«ЁЯ«▓Я»ЇЯ«▓Я«цЯ»Ђ H3O+
Я«єЯ«Ћ Я«ЄЯ«░Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї
H+
+ H2O Рєњ H3O+
Я«ЅЯ«ЎЯ»ЇЯ«ЋЯ«│Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ«цЯ»Ї Я«цЯ»єЯ«░Я«┐Я«»Я»ЂЯ««Я«Й?
Я«ЁЯ«ЕЯ»ѕЯ«цЯ»ЇЯ«цЯ»Ђ Я«ЁЯ««Я«┐Я«▓Я«ЎЯ»ЇЯ«ЋЯ«│Я»ЂЯ««Я»Ї Я«њЯ«ЕЯ»ЇЯ«▒Я»Ђ Я«ЁЯ«▓Я»ЇЯ«▓Я«цЯ»Ђ Я«ЁЯ«цЯ«▒Я»ЇЯ«ЋЯ»Ђ Я««Я»ЄЯ«▒Я»ЇЯ«фЯ«ЪЯ»ЇЯ«Ъ Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я«юЯ«ЕЯ»Ї Я«ЁЯ«БЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«│Я»ѕЯ«ЋЯ»Ї Я«ЋЯ»іЯ«БЯ»ЇЯ«ЪЯ«хЯ»ѕ. Я«єЯ«ЕЯ«ЙЯ«▓Я»Ї Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я«юЯ«ЕЯ»Ї Я«ЅЯ«│Я»ЇЯ«│ Я«ЁЯ«ЕЯ»ѕЯ«цЯ»ЇЯ«цЯ»ЂЯ«фЯ»Ї Я«фЯ»іЯ«░Я»ЂЯ«│Я»ЇЯ«ЋЯ«│Я»ЂЯ««Я»Ї Я«ЁЯ««Я«┐Я«▓Я«ЎЯ»ЇЯ«ЋЯ«│Я»Ї Я«ЁЯ«▓Я»ЇЯ«▓. Я«ј.Я«ЋЯ«Й Я««Я»ђЯ«цЯ»ЇЯ«цЯ»ЄЯ«ЕЯ»Ї (CH4)
Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«ЁЯ««Я»ЇЯ««Я»ІЯ«ЕЯ«┐Я«»Я«Й (NH3) Я«єЯ«ЋЯ«┐Я«»Я«хЯ»ѕ Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я«юЯ«ЕЯ»ѕЯ«ЋЯ»Ї Я«ЋЯ»іЯ«БЯ»ЇЯ«ЪЯ»ЂЯ«│Я»ЇЯ«│Я«Е. Я«єЯ«ЕЯ«ЙЯ«▓Я»Ї Я«ЄЯ«хЯ»ѕ Я«еЯ»ђЯ«░Я»ЇЯ«цЯ»ЇЯ«ц Я«ЋЯ«░Я»ѕЯ«џЯ«▓Я«┐Я«▓Я»Ї Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я«юЯ«ЕЯ»Ї (H+) Я«ЁЯ«»Я«ЕЯ«┐Я«ЋЯ«│Я»ѕЯ«цЯ»Ї Я«цЯ«░Я«ЙЯ«цЯ»Ђ.
Я«фЯ«▓Я»ЇЯ«хЯ»ЄЯ«▒Я»Ђ Я«ЁЯ««Я«┐Я«▓Я«ЎЯ»ЇЯ«ЋЯ«│Я»Ї Я«еЯ»ђЯ«░Я«┐Я«▓Я»Ї Я«ЋЯ«░Я»ѕЯ«еЯ»ЇЯ«цЯ»Ђ Я«јЯ«хЯ»ЇЯ«хЯ«ЙЯ«▒Я»Ђ Я«ЁЯ«»Я«ЕЯ«┐Я«ЋЯ«│Я»ѕ Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е Я«јЯ«ЕЯ»ЇЯ«фЯ«цЯ»ѕ Я«ЋЯ»ђЯ«┤Я»ЇЯ«ЋЯ»ЇЯ«ЋЯ«БЯ»ЇЯ«Ъ Я«ЁЯ«ЪЯ»ЇЯ«ЪЯ«хЯ«БЯ»ѕЯ«»Я«┐Я«▓Я»Ї Я«фЯ«ЙЯ«░Я»ЇЯ«ЋЯ»ЇЯ«ЋЯ«▓Я«ЙЯ««Я»Ї.
1. Я«ЁЯ««Я«┐Я«▓Я«ЎЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«хЯ«ЋЯ»ѕЯ«ЋЯ«│Я»Ї
Я«ЁЯ««Я«┐Я«▓Я«ЎЯ»ЇЯ«ЋЯ«│Я»Ї Я«ЋЯ»ђЯ«┤Я»ЇЯ«ЋЯ»ЇЯ«ЋЯ«БЯ»ЇЯ«ЪЯ«хЯ«ЙЯ«▒Я»Ђ Я«фЯ«▓Я»ЇЯ«хЯ»ЄЯ«▒Я»Ђ Я«хЯ«ЋЯ»ѕЯ«ЋЯ«│Я«┐Я«▓Я»Ї Я«хЯ«ЋЯ»ѕЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е.
Я«Ё. Я««Я»ѓЯ«▓Я«ЎЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«ЁЯ«ЪЯ«┐Я«фЯ»ЇЯ«фЯ«ЪЯ»ѕЯ«»Я«┐Я«▓Я»Ї
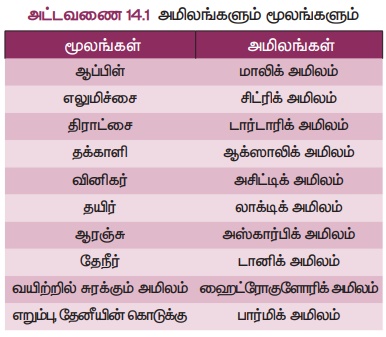
Я«ЋЯ«░Я«┐Я«« Я«ЁЯ««Я«┐Я«▓Я«ЎЯ»ЇЯ«ЋЯ«│Я»Ї: Я«цЯ«ЙЯ«хЯ«░Я«ЎЯ»ЇЯ«ЋЯ«│Я»Ї Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«хЯ«┐Я«▓Я«ЎЯ»ЇЯ«ЋЯ»ЂЯ«ЋЯ«│Я«┐Я«▓Я»Ї (Я«ЅЯ«»Я«┐Я«░Я«┐Я«ЕЯ«ЎЯ»ЇЯ«ЋЯ«│Я«┐Я«▓Я»Ї) Я«ЋЯ«ЙЯ«БЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї Я«ЁЯ««Я«┐Я«▓Я«ЎЯ»ЇЯ«ЋЯ«│Я»Ї Я«ЋЯ«░Я«┐Я«« Я«ЁЯ««Я«┐Я«▓Я«ЎЯ»ЇЯ«ЋЯ«│Я»Ї Я«јЯ«ЕЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї. Я«ј.Я«ЋЯ«Й: HCOOH, CH3COOH
Я«ЋЯ«ЕЯ«┐Я«« Я«ЁЯ««Я«┐Я«▓Я«ЎЯ»ЇЯ«ЋЯ«│Я»Ї: Я«фЯ«ЙЯ«▒Я»ѕЯ«ЋЯ«│Я»Ї Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«ЋЯ«ЕЯ«┐Я««Я«фЯ»Ї Я«фЯ»іЯ«░Я»ЂЯ«│Я»ЇЯ«ЋЯ«│Я«┐Я«▓Я«┐Я«░Я»ЂЯ«еЯ»ЇЯ«цЯ»Ђ Я«фЯ»єЯ«▒Я«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї Я«ЁЯ««Я«┐Я«▓Я«ЎЯ»ЇЯ«ЋЯ«│Я»Ї Я«ЋЯ«ЕЯ«┐Я«« Я«ЁЯ««Я«┐Я«▓Я«ЎЯ»ЇЯ«ЋЯ«│Я»Ї Я«јЯ«ЕЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї. Я«ј.Я«ЋЯ«Й: HCI, HNO3, H2SO4
Я«є. Я«ЋЯ«ЙЯ«░Я«цЯ»ЇЯ«цЯ»ЂЯ«хЯ«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»Ї Я«ЁЯ«ЪЯ«┐Я«фЯ»ЇЯ«фЯ«ЪЯ»ѕЯ«»Я«┐Я«▓Я»Ї
Я«њЯ«▒Я»ЇЯ«▒Я»ѕЯ«ЋЯ»Ї Я«ЋЯ«ЙЯ«░Я«цЯ»ЇЯ«цЯ»ЂЯ«х Я«ЁЯ««Я«┐Я«▓Я««Я»Ї: Я«ЄЯ«хЯ»ѕ, Я«њЯ«░Я»Ђ Я««Я»ѓЯ«▓Я«ЋЯ»ЇЯ«ЋЯ»ѓЯ«▒Я«┐Я«▓Я»Ї Я«њЯ«░Я»Є Я«њЯ«░Я»Ђ Я«фЯ«цЯ«┐Я«▓Я»ђЯ«ЪЯ»Ђ Я«џЯ»єЯ«»Я»ЇЯ«»Я«фЯ»ЇЯ«фЯ«ЪЯ«ЋЯ»ЇЯ«ЋЯ»ѓЯ«ЪЯ«┐Я«» Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я«юЯ«ЕЯ»Ї Я«ЁЯ«»Я«ЕЯ«┐Я«»Я»ѕЯ«фЯ»Ї Я«фЯ»єЯ«▒Я»ЇЯ«▒ Я«ЁЯ««Я«┐Я«▓Я«ЎЯ»ЇЯ«ЋЯ«│Я»Ї Я«єЯ«ЋЯ»ЂЯ««Я»Ї. Я«ЄЯ«цЯ»Ђ Я«еЯ»ђЯ«░Я»ЇЯ«ЋЯ»ЇЯ«ЋЯ«░Я»ѕЯ«џЯ«▓Я«┐Я«▓Я»Ї Я«њЯ«░Я»Ђ Я««Я»ѓЯ«▓Я«ЋЯ»ЇЯ«ЋЯ»ѓЯ«▒Я»Ђ Я«ЁЯ««Я«┐Я«▓Я«цЯ»ЇЯ«цЯ«┐Я«▒Я»ЇЯ«ЋЯ»Ђ Я«њЯ«░Я»Ђ Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я«юЯ«ЕЯ»Ї Я«ЁЯ«»Я«ЕЯ«┐Я«»Я»ѕЯ«цЯ»Ї Я«цЯ«░Я»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«ј.Я«ЋЯ«Й: HCI, HNO3
Я«ЅЯ«ЎЯ»ЇЯ«ЋЯ«│Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ«цЯ»Ї Я«цЯ»єЯ«░Я«┐Я«»Я»ЂЯ««Я«Й?
Я«ЁЯ««Я«┐Я«▓Я«ЎЯ»ЇЯ«ЋЯ«│Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ»Ђ Я«ЋЯ«ЙЯ«░Я«цЯ»ЇЯ«цЯ»ЂЯ«хЯ««Я»Ї Я«јЯ«ЕЯ»ЇЯ«▒ Я«фЯ«цЯ«цЯ»ЇЯ«цЯ»ѕЯ«фЯ»Ї Я«фЯ«»Я«ЕЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ»ЂЯ«ЋЯ«┐Я«▒Я»ІЯ««Я»Ї. Я«ЄЯ«цЯ»Ђ Я«ЁЯ«цЯ«┐Я«▓Я»ЂЯ«│Я»ЇЯ«│ Я«ЄЯ«ЪЯ«фЯ»ЇЯ«фЯ»єЯ«»Я«░Я»ЇЯ«џЯ»ЇЯ«џЯ«┐ Я«џЯ»єЯ«»Я»ЇЯ«»Я«ЋЯ»ЇЯ«ЋЯ»ѓЯ«ЪЯ«┐Я«» Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я«юЯ«ЕЯ»Ї Я«ЁЯ«БЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«јЯ«БЯ»ЇЯ«БЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»ѕЯ«»Я»ѕЯ«ЋЯ»Ї Я«ЋЯ»ЂЯ«▒Я«┐Я«фЯ»ЇЯ«фЯ«цЯ«ЙЯ«ЋЯ»ЂЯ««Я»Ї. Я«ј.Я«ЋЯ«Й Я«ЁЯ«џЯ«┐Я«ЪЯ»ЇЯ«ЪЯ«┐Я«ЋЯ»Ї Я«ЁЯ««Я«┐Я«▓Я«цЯ»ЇЯ«цЯ«┐Я«▓Я»Ї (CH3COOH)
Я«еЯ«ЙЯ«ЕЯ»ЇЯ«ЋЯ»Ђ Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я«юЯ«ЕЯ»Ї Я«ЁЯ«БЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«│Я»Ї Я«ЄЯ«░Я»ЂЯ«еЯ»ЇЯ«цЯ«ЙЯ«▓Я»ЂЯ««Я»Ї, Я«њЯ«░Я»Є Я«њЯ«░Я»ЂЯ«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я«юЯ«ЕЯ»ѕ Я««Я«ЪЯ»ЇЯ«ЪЯ»ЂЯ««Я»Є Я«ЄЯ«ЪЯ«фЯ»ЇЯ«фЯ»єЯ«»Я«░Я»ЇЯ«џЯ»ЇЯ«џЯ«┐ Я«џЯ»єЯ«»Я»ЇЯ«» Я««Я»ЂЯ«ЪЯ«┐Я«»Я»ЂЯ««Я»Ї. Я«јЯ«ЕЯ«хЯ»Є Я«ЄЯ«цЯ»Ђ Я«њЯ«▒Я»ЇЯ«▒Я»ѕЯ«ЋЯ»Ї Я«ЋЯ«ЙЯ«░Я«цЯ»ЇЯ«цЯ»ЂЯ«хЯ««Я»ЂЯ«ЪЯ»ѕЯ«»Я«цЯ»Ђ.
Я«ЄЯ«░Я«ЪЯ»ЇЯ«ЪЯ»ѕЯ«ЋЯ»Ї Я«ЋЯ«ЙЯ«░Я«цЯ»ЇЯ«цЯ»ЂЯ«х Я«ЁЯ««Я«┐Я«▓Я««Я»Ї: Я«ЄЯ«хЯ»ѕ Я«еЯ»ђЯ«░Я»ЇЯ«ЋЯ»ЇЯ«ЋЯ«░Я»ѕЯ«џЯ«▓Я«┐Я«▓Я»Ї Я«њЯ«░Я»Ђ Я««Я»ѓЯ«▓Я«ЋЯ»ЇЯ«ЋЯ»ѓЯ«▒Я»Ђ Я«ЁЯ««Я«┐Я«▓Я«цЯ»ЇЯ«цЯ«┐Я«▒Я»ЇЯ«ЋЯ»Ђ Я«ЄЯ«░Я«БЯ»ЇЯ«ЪЯ»Ђ Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я«юЯ«ЕЯ»Ї Я«ЁЯ«»Я«ЕЯ«┐Я«ЋЯ«│Я»ѕЯ«цЯ»Ї Я«цЯ«░Я»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е. Я«ј.Я«ЋЯ«Й: H2SO4, H2CO3
Я««Я»ЂЯ««Я»ЇЯ««Я»ѕЯ«ЋЯ»Ї Я«ЋЯ«ЙЯ«░Я«цЯ»ЇЯ«цЯ»ЂЯ«х Я«ЁЯ««Я«┐Я«▓Я««Я»Ї: Я«ЄЯ«хЯ»ѕ Я«еЯ»ђЯ«░Я»ЇЯ«ЋЯ»ЇЯ«ЋЯ«░Я»ѕЯ«џЯ«▓Я«┐Я«▓Я»Ї Я«њЯ«░Я»Ђ Я««Я»ѓЯ«▓Я«ЋЯ»ЇЯ«ЋЯ»ѓЯ«▒Я»Ђ Я«ЁЯ««Я«┐Я«▓Я«цЯ»ЇЯ«цЯ«┐Я«▒Я»ЇЯ«ЋЯ»Ђ Я««Я»ѓЯ«ЕЯ»ЇЯ«▒Я»Ђ Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я«юЯ«ЕЯ»Ї Я«ЁЯ«»Я«ЕЯ«┐Я«ЋЯ«│Я»ѕЯ«цЯ»Ї Я«цЯ«░Я»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е. Я«ј.Я«ЋЯ«Й: H3PO4
Я«Є. Я«ЁЯ«»Я«ЕЯ«┐Я«»Я»ЂЯ«▒Я»ЂЯ««Я»Ї Я«ЁЯ«ЪЯ«┐Я«фЯ»ЇЯ«фЯ«ЪЯ»ѕЯ«»Я«┐Я«▓Я»Ї
Я«ЁЯ««Я«┐Я«▓Я«ЎЯ»ЇЯ«ЋЯ«│Я»Ї Я«еЯ»ђЯ«░Я«┐Я«▓Я»Ї Я««Я»ЂЯ«┤Я»ЂЯ«хЯ«цЯ»ЂЯ««Я«ЙЯ«ЋЯ«хЯ»І Я«ЁЯ«▓Я»ЇЯ«▓Я«цЯ»Ђ Я«фЯ«ЋЯ»ЂЯ«цЯ«┐Я«»Я«ЙЯ«ЋЯ«хЯ»І Я«ЋЯ«░Я»ѕЯ«»Я»ЂЯ««Я»Ї Я«фЯ»іЯ«┤Я»ЂЯ«цЯ»Ђ Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я«юЯ«ЕЯ»Ї (H+)
Я«ЁЯ«»Я«ЕЯ«┐Я«ЋЯ«│Я»ѕЯ«цЯ»Ї Я«цЯ«░Я»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е. Я«ЁЯ«»Я«ЕЯ«┐Я«»Я»ЂЯ«▒Я»ЂЯ««Я»Ї Я«єЯ«▒Я»ЇЯ«▒Я«▓Я»Ї Я«ЁЯ«ЪЯ«┐Я«фЯ»ЇЯ«фЯ«ЪЯ»ѕЯ«»Я«┐Я«▓Я»Ї Я«ЁЯ««Я«┐Я«▓Я«ЎЯ»ЇЯ«ЋЯ«│Я»ѕ Я«ЄЯ«░Я»ЂЯ«хЯ«ЋЯ»ѕЯ«»Я«ЙЯ«ЋЯ«фЯ»Ї Я«фЯ«┐Я«░Я«┐Я«ЋЯ»ЇЯ«ЋЯ«▓Я«ЙЯ««Я»Ї.
Я«хЯ«▓Я«┐Я««Я»ѕ Я««Я«┐Я«ЋЯ»Ђ Я«ЁЯ««Я«┐Я«▓Я«ЎЯ»ЇЯ«ЋЯ«│Я»Ї: Я«ЄЯ«еЯ»ЇЯ«ц Я«ЁЯ««Я«┐Я«▓Я«ЎЯ»ЇЯ«ЋЯ«│Я»Ї Я«еЯ»ђЯ«░Я«┐Я«▓Я»Ї Я««Я»ЂЯ«┤Я»ЂЯ«хЯ«цЯ»ЂЯ««Я«ЙЯ«Ћ Я«ЁЯ«»Я«ЕЯ«┐Я«»Я»ЂЯ«▒Я»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е. Я«ј.Я«ЋЯ«Й: HCI
Я«хЯ«▓Я«┐Я««Я»ѕ Я«ЋЯ»ЂЯ«▒Я»ѕЯ«еЯ»ЇЯ«ц Я«ЁЯ««Я«┐Я«▓Я«ЎЯ»ЇЯ«ЋЯ«│Я»Ї: Я«ЄЯ«еЯ»ЇЯ«ц Я«ЁЯ««Я«┐Я«▓Я«ЎЯ»ЇЯ«ЋЯ«│Я»Ї Я«еЯ»ђЯ«░Я«┐Я«▓Я»Ї Я«фЯ«ЋЯ»ЂЯ«цЯ«┐Я«»Я«│Я«хЯ»Є Я«ЁЯ«»Я«ЕЯ«┐Я«»Я»ЂЯ«▒Я»ЂЯ««Я»Ї Я«цЯ«ЕЯ»ЇЯ««Я»ѕ Я«ЋЯ»іЯ«БЯ»ЇЯ«ЪЯ«хЯ»ѕ. Я«ј.Я«ЋЯ«Й: CH3COOH.
Я«ЅЯ«ЎЯ»ЇЯ«ЋЯ«│Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ«цЯ»Ї Я«цЯ»єЯ«░Я«┐Я«»Я»ЂЯ««Я«Й?
Я«хЯ»єЯ«фЯ»ЇЯ«фЯ««Я»Ї Я«ЁЯ«▓Я»ЇЯ«▓Я«цЯ»Ђ Я«ЋЯ«цЯ«┐Я«░Я»ЇЯ«хЯ»ђЯ«џЯ»ЇЯ«џЯ»Ђ Я«ЁЯ«▓Я»ЇЯ«▓Я«цЯ»Ђ Я«хЯ»ЄЯ«цЯ«┐Я«хЯ«┐Я«ЕЯ»ѕ Я«ЁЯ«▓Я»ЇЯ«▓Я«цЯ»Ђ Я««Я«┐Я«ЕЯ»ЇЯ«ЕЯ«┐Я«▒Я«ЋЯ»ЇЯ«ЋЯ«цЯ»ЇЯ«цЯ«ЙЯ«▓Я»Ї Я«ЁЯ«»Я«ЕЯ«┐Я«ЋЯ«│Я»ѕЯ«фЯ»Ї Я«фЯ«┐Я«░Я«┐Я«цЯ»ЇЯ«цЯ»єЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«еЯ«┐Я«▓Я»ѕ Я«ЁЯ«»Я«ЕЯ«┐Я«»Я«ЙЯ«цЯ«▓Я»Ї Я«јЯ«ЕЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї.
Я«ѕ. Я«џЯ»єЯ«▒Я«┐Я«хЯ«┐Я«ЕЯ»Ї Я«ЁЯ«ЪЯ«┐Я«фЯ»ЇЯ«фЯ«ЪЯ»ѕЯ«»Я«┐Я«▓Я»Ї
Я«џЯ»єЯ«▒Я«┐Я«хЯ»Ђ Я««Я«┐Я«ЋЯ»Ђ Я«ЁЯ««Я«┐Я«▓Я«ЎЯ»ЇЯ«ЋЯ«│Я»Ї: Я«ЄЯ«цЯ»Ђ Я«њЯ«░Я»Ђ Я«ЋЯ«░Я»ѕЯ«фЯ»ЇЯ«фЯ«ЙЯ«ЕЯ«┐Я«▓Я»Ї Я«ЁЯ«цЯ«┐Я«ЋЯ«│Я«хЯ»Ђ Я«ЋЯ«░Я»ѕЯ«еЯ»ЇЯ«цЯ»ЂЯ«│Я»ЇЯ«│ Я«ЁЯ««Я«┐Я«▓Я«цЯ»ЇЯ«цЯ»ѕЯ«ЋЯ»Ї Я«ЋЯ»іЯ«БЯ»ЇЯ«ЪЯ»ЂЯ«│Я»ЇЯ«│Я«цЯ»Ђ.
Я«еЯ»ђЯ«░Я»ЇЯ«цЯ»ЇЯ«ц Я«ЁЯ««Я«┐Я«▓Я«ЎЯ»ЇЯ«ЋЯ«│Я»Ї: Я«ЄЯ«цЯ»Ђ Я«њЯ«░Я»Ђ Я«ЋЯ«░Я»ѕЯ«фЯ»ЇЯ«фЯ«ЙЯ«ЕЯ«┐Я«▓Я»Ї Я«ЋЯ»ЂЯ«▒Я»ѕЯ«еЯ»ЇЯ«ц Я«ЁЯ«│Я«хЯ»Ђ Я«ЋЯ«░Я»ѕЯ«еЯ»ЇЯ«цЯ»ЂЯ«│Я»ЇЯ«│ Я«ЁЯ««Я«┐Я«▓Я«цЯ»ЇЯ«цЯ»ѕЯ«ЋЯ»Ї Я«ЋЯ»іЯ«БЯ»ЇЯ«ЪЯ»ЂЯ«│Я»ЇЯ«│Я«цЯ»Ђ.
2. Я«ЁЯ««Я«┐Я«▓Я«ЎЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«фЯ«БЯ»ЇЯ«фЯ»ЂЯ«ЋЯ«│Я»Ї
Я«Ё) Я«ЁЯ««Я«┐Я«▓Я«ЎЯ»ЇЯ«ЋЯ«│Я»Ї Я«фЯ»ЂЯ«│Я«┐Я«фЯ»ЇЯ«фЯ»ЂЯ«џЯ»Ї Я«џЯ»ЂЯ«хЯ»ѕ Я«ЅЯ«ЪЯ»ѕЯ«»Я«хЯ»ѕ.
Я«є) Я«ЄЯ«хЯ«▒Я»ЇЯ«▒Я«┐Я«ЕЯ»Ї Я«еЯ»ђЯ«░Я»ЇЯ«цЯ»ЇЯ«ц Я«ЋЯ«░Я»ѕЯ«џЯ«▓Я»ЇЯ«ЋЯ«│Я»Ї Я««Я«┐Я«ЕЯ»ЇЯ«џЯ«ЙЯ«░Я«цЯ»ЇЯ«цЯ»ѕЯ«ЋЯ»Ї Я«ЋЯ«ЪЯ«цЯ»ЇЯ«цЯ»ЂЯ««Я»Ї. Я«ЈЯ«ЕЯ»єЯ«ЕЯ»ЇЯ«▒Я«ЙЯ«▓Я»Ї, Я«ЄЯ«хЯ»ѕ Я«ЁЯ«»Я«ЕЯ«┐Я«ЋЯ«│Я»ѕЯ«ЋЯ»Ї Я«ЋЯ»іЯ«БЯ»ЇЯ«ЪЯ»ЂЯ«│Я»ЇЯ«│Я«Е.
Я«Є) Я«ЄЯ«хЯ»ѕ Я«еЯ»ђЯ«▓ Я«▓Я«┐Я«ЪЯ»ЇЯ««Я«ИЯ»ЇЯ«цЯ«ЙЯ«│Я»ѕ Я«џЯ«┐Я«хЯ«фЯ»ЇЯ«фЯ«ЙЯ«Ћ Я««Я«ЙЯ«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї.
Я«ѕ) Я«ЁЯ««Я«┐Я«▓Я«ЎЯ»ЇЯ«ЋЯ«│Я»Ї Я«џЯ»єЯ«»Я«▓Я»ЇЯ«цЯ«┐Я«▒Я«ЕЯ»Ї Я««Я«┐Я«ЋЯ»ЇЯ«Ћ Я«ЅЯ«▓Я»ІЯ«ЋЯ«ЎЯ»ЇЯ«ЋЯ«│Я»ЂЯ«ЪЯ«ЕЯ»Ї Я«хЯ«┐Я«ЕЯ»ѕЯ«фЯ»ЂЯ«░Я«┐Я«еЯ»ЇЯ«цЯ»Ђ Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я«юЯ«ЕЯ»Ї Я«хЯ«ЙЯ«»Я»ЂЯ«хЯ»ѕЯ«цЯ»Ї Я«цЯ«░Я»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е.
Mg + H2SO4 Рєњ MgSO2
+ H2 РєЉ
Zn
+ 2HCI Рєњ ZnCl2 + H2РєЉ
Я«ЅЯ«ЎЯ»ЇЯ«ЋЯ«│Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ«цЯ»Ї Я«цЯ»єЯ«░Я«┐Я«»Я»ЂЯ««Я«Й?
Я«џЯ«┐Я«▓ Я«ЅЯ«▓Я»ІЯ«ЋЯ«ЎЯ»ЇЯ«ЋЯ«│Я»Ї Я«ЁЯ««Я«┐Я«▓Я«цЯ»ЇЯ«цЯ»ЂЯ«ЪЯ«ЕЯ»Ї Я«хЯ«┐Я«ЕЯ»ѕЯ«фЯ»ЂЯ«░Я«┐Я«еЯ»ЇЯ«цЯ»Ђ Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я«юЯ«ЕЯ»ѕ Я«хЯ»єЯ«│Я«┐Я«»Я»ЄЯ«▒Я»ЇЯ«▒Я»ЂЯ«хЯ«цЯ«┐Я«▓Я»ЇЯ«▓Я»ѕ . Я«ј.Я«ЋЯ«Й: Ag, Cu
Я«Ѕ) Я«ЁЯ««Я«┐Я«▓Я«ЎЯ»ЇЯ«ЋЯ«│Я»Ї Я«ЅЯ«▓Я»ІЯ«Ћ Я«ЋЯ«ЙЯ«░Я»ЇЯ«фЯ«ЕЯ»ЄЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ«ЋЯ«│Я»Ї Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«ЅЯ«▓Я»ІЯ«Ћ Я«фЯ»ѕЯ«ЋЯ«ЙЯ«░Я»ЇЯ«фЯ«ЕЯ»ЄЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ«ЋЯ«│Я»ЂЯ«ЪЯ«ЕЯ»Ї Я«хЯ«┐Я«ЕЯ»ѕЯ«фЯ»ЂЯ«░Я«┐Я«еЯ»ЇЯ«цЯ»Ђ Я«ЋЯ«ЙЯ«░Я»ЇЯ«фЯ«ЕЯ»Ї Я«ЪЯ»ѕЯ«єЯ«ЋЯ»ЇЯ«џЯ»ѕЯ«ЪЯ»ѕЯ«цЯ»Ї Я«цЯ«░Я»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е.
Na2CO3
+ 2HCI Рєњ 2NaCl + H2O + CO2 РєЉ
NaHCO3
+ HCI Рєњ NaCl + H2O + CO2
РєЉ
Я«і) Я«ЁЯ««Я«┐Я«▓Я«ЎЯ»ЇЯ«ЋЯ«│Я»Ї Я«ЅЯ«▓Я»ІЯ«Ћ Я«єЯ«ЋЯ»ЇЯ«џЯ»ѕЯ«ЪЯ»ЂЯ«ЋЯ«│Я»ЂЯ«ЪЯ«ЕЯ»Ї Я«хЯ«┐Я«ЕЯ»ѕ Я«фЯ»ЂЯ«░Я«┐Я«еЯ»ЇЯ«цЯ»Ђ Я«ЅЯ«фЯ»ЇЯ«фЯ»ѕЯ«»Я»ЂЯ««Я»Ї, Я«еЯ»ђЯ«░Я»ѕЯ«»Я»ЂЯ««Я»Ї Я«цЯ«░Я»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е.
CaO
+ H2SO4 Рєњ CaSO4
+ H2O
Я«ј) Я«ЁЯ««Я«┐Я«▓Я«ЎЯ»ЇЯ«ЋЯ«│Я»Ї Я«ЋЯ«ЙЯ«░Я«ЎЯ»ЇЯ«ЋЯ«│Я»ЂЯ«ЪЯ«ЕЯ»Ї Я«хЯ«┐Я«ЕЯ»ѕЯ«фЯ»ЂЯ«░Я«┐Я«еЯ»ЇЯ«цЯ»Ђ Я«ЅЯ«фЯ»ЇЯ«фЯ»ѕЯ«»Я»ЂЯ««Я»Ї Я«еЯ»ђЯ«░Я»ѕЯ«»Я»ЂЯ««Я»Ї Я«цЯ«░Я»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е.
HCl
+ NaOH Рєњ NaCl + H2O
Я«ЄЯ«цЯ»Ђ Я«еЯ«ЪЯ»ЂЯ«еЯ«┐Я«▓Я»ѕЯ«»Я«ЙЯ«ЋЯ»ЇЯ«ЋЯ«▓Я»Ї Я«хЯ«┐Я«ЕЯ»ѕ Я«јЯ«ЕЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї.
Я«џЯ»єЯ«»Я«▓Я»ЇЯ«фЯ«ЙЯ«ЪЯ»Ђ 1
10 Я««Я«┐Я«▓Я«┐ Я«еЯ»ђЯ«░Я»ЇЯ«цЯ»ЇЯ«ц Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я»І Я«ЋЯ»ЂЯ«│Я»ІЯ«░Я«┐Я«ЋЯ»Ї Я«ЁЯ««Я«┐Я«▓Я«цЯ»ЇЯ«цЯ»ѕ Я«џЯ»ІЯ«цЯ«ЕЯ»ѕЯ«ЋЯ»Ї Я«ЋЯ»ЂЯ«┤Я«ЙЯ«»Я«┐Я«▓Я»Ї Я«јЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ»іЯ«БЯ»ЇЯ«ЪЯ»Ђ Я«ЁЯ«цЯ«┐Я«▓Я»Ї Я«џЯ«┐Я«▒Я«┐Я«цЯ»Ђ Я«цЯ»ЂЯ«цЯ»ЇЯ«цЯ«еЯ«ЙЯ«ЋЯ«цЯ»Ї Я«цЯ»ЂЯ«ЋЯ«│Я»ЇЯ«ЋЯ«│Я»ѕ Я«џЯ»ЄЯ«░Я»ЇЯ«ЋЯ»ЇЯ«ЋЯ«хЯ»ЂЯ««Я»Ї. Я«јЯ«ЕЯ»ЇЯ«Е Я«ЋЯ«ЙЯ«БЯ»ЇЯ«ЋЯ«┐Я«▒Я»ђЯ«░Я»ЇЯ«ЋЯ«│Я»Ї? Я«ЋЯ«░Я»ѕЯ«џЯ«▓Я«┐Я«▓Я»Ї Я«ЋЯ»ЂЯ««Я«┐Я«┤Я«┐Я«ЋЯ«│Я»Ї Я«ЈЯ«ЕЯ»Ї Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е? Я«ЊЯ«░Я»Ї Я«јЯ«░Я«┐Я«»Я»ЂЯ««Я»Ї Я««Я»єЯ«┤Я»ЂЯ«ЋЯ»ЂЯ«хЯ«░Я»ЇЯ«цЯ»ЇЯ«цЯ«┐Я«»Я»ѕ Я«ЄЯ«цЯ«ЕЯ»Ї Я«ЁЯ«░Я»ЂЯ«ЋЯ«┐Я«▓Я»Ї Я«ЋЯ»іЯ«БЯ»ЇЯ«ЪЯ»Ђ Я«џЯ»єЯ«▓Я»ЇЯ«▓Я»ЂЯ««Я»ЇЯ«фЯ»ІЯ«цЯ»Ђ Я«ЁЯ«цЯ»Ђ Я«фЯ«ЙЯ«фЯ»Ї Я«јЯ«ЕЯ»ЇЯ«▒ Я«њЯ«▓Я«┐Я«»Я»ЂЯ«ЪЯ«ЕЯ»Ї Я«ЁЯ«БЯ»ѕЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«ЄЯ«цЯ»Ђ Я«ЅЯ«▓Я»ІЯ«ЋЯ««Я»Ї Я«еЯ»ђЯ«░Я»ЇЯ«цЯ»ЇЯ«ц Я«ЁЯ««Я«┐Я«▓Я«ЎЯ»ЇЯ«ЋЯ«│Я»ЂЯ«ЪЯ«ЕЯ»Ї Я«хЯ«┐Я«ЕЯ»ѕЯ«фЯ»ЂЯ«░Я«┐Я«еЯ»ЇЯ«цЯ»Ђ Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я«юЯ«ЕЯ»Ї Я«хЯ«ЙЯ«»Я»Ђ Я«хЯ»єЯ«│Я«┐Я«»Я»ЄЯ«▒Я»ЂЯ«хЯ«цЯ»ѕ Я«ЅЯ«▒Я»ЂЯ«цЯ«┐ Я«џЯ»єЯ«»Я»ЇЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
Я«ЋЯ«хЯ«ЕЯ««Я»Ї: Я«џЯ»єЯ«▒Я«┐Я«хЯ»Ђ Я««Я«┐Я«ЋЯ»ЂЯ«еЯ»ЇЯ«ц Я«ЋЯ«ЕЯ«┐Я«« Я«ЁЯ««Я«┐Я«▓Я«цЯ»ЇЯ«цЯ»ѕ Я«еЯ»ђЯ«░Я»ЇЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«фЯ»ІЯ«цЯ»Ђ Я««Я«┐Я«ЋЯ«ЋЯ»Ї Я«ЋЯ«хЯ«ЕЯ««Я«ЙЯ«Ћ Я«џЯ»єЯ«»Я«▓Я»ЇЯ«фЯ«Ъ Я«хЯ»ЄЯ«БЯ»ЇЯ«ЪЯ»ЂЯ««Я»Ї. Я«јЯ«фЯ»ЇЯ«фЯ»іЯ«┤Я»ЂЯ«цЯ»ЂЯ««Я»Є Я«ЁЯ««Я«┐Я«▓Я«цЯ»ЇЯ«цЯ»ѕ Я«еЯ»ђЯ«░Я«┐Я«ЕЯ»ЂЯ«│Я»Ї Я«џЯ«┐Я«▒Я«┐Я«цЯ»Ђ Я«џЯ«┐Я«▒Я«┐Я«цЯ«ЙЯ«ЋЯ«џЯ»Ї Я«џЯ»ЄЯ«░Я»ЇЯ«цЯ»ЇЯ«цЯ»Ђ Я«ЋЯ«▓Я«ЋЯ»ЇЯ«ЋЯ«┐Я«ЋЯ»Ї Я«ЋЯ»іЯ«БЯ»ЇЯ«ЪЯ»Є Я«ЄЯ«░Я»ЂЯ«ЋЯ»ЇЯ«Ћ Я«хЯ»ЄЯ«БЯ»ЇЯ«ЪЯ»ЂЯ««Я»Ї. Я«ЄЯ«хЯ»ЇЯ«хЯ«ЙЯ«▒Я»Ђ Я«џЯ»єЯ«»Я»ЇЯ«»Я«ЙЯ««Я«▓Я»Ї Я«џЯ»єЯ«▒Я«┐Я«хЯ»Ђ Я««Я«┐Я«ЋЯ»ЂЯ«еЯ»ЇЯ«ц Я«ЁЯ««Я«┐Я«▓Я«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»ЂЯ«│Я»Ї Я«еЯ»ђЯ«░Я»ѕЯ«џЯ»Ї Я«џЯ»ЄЯ«░Я»ЇЯ«цЯ»ЇЯ«цЯ«ЙЯ«▓Я»Ї, Я«ЁЯ«цЯ«┐Я«Ћ Я«ЁЯ«│Я«хЯ»Ђ Я«хЯ»єЯ«фЯ»ЇЯ«фЯ««Я»Ї Я«хЯ»єЯ«│Я«┐Я«»Я»ЄЯ«▒Я«┐, Я«ЁЯ««Я«┐Я«▓Я««Я»Ї Я«ЋЯ»іЯ«│Я»ЇЯ«ЋЯ«▓Я«ЕЯ«┐Я«▓Я«┐Я«░Я»ЂЯ«еЯ»ЇЯ«цЯ»Ђ Я«хЯ»єЯ«│Я«┐Я«»Я»Є Я«цЯ»єЯ«▒Я«┐Я«цЯ»ЇЯ«цЯ»Ђ Я«ЅЯ«ЪЯ«▓Я«┐Я«▓Я»Ї Я«ЋЯ«ЙЯ«»Я«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»ѕ Я«ЈЯ«▒Я»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ»ЂЯ««Я»Ї.
3. Я«ЁЯ««Я«┐Я«▓Я«ЎЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«фЯ«»Я«ЕЯ»ЇЯ«ЋЯ«│Я»Ї
РЌЈ Я«џЯ«▓Я»ЇЯ«фЯ«┐Я«»Я»ѓЯ«░Я«┐Я«ЋЯ»Ї Я«ЁЯ««Я«┐Я«▓Я««Я»Ї Я«хЯ»ЄЯ«цЯ«┐Я«фЯ»Ї Я«фЯ»іЯ«░Я»ЂЯ«│Я»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«ЁЯ«░Я«џЯ«ЕЯ»Ї Я«јЯ«ЕЯ»ЇЯ«▒Я«┤Я»ѕЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«ЈЯ«ЕЯ»єЯ«ЕЯ«┐Я«▓Я»Ї Я«фЯ«▓ Я«џЯ»ЄЯ«░Я»ЇЯ««Я«ЎЯ»ЇЯ«ЋЯ«│Я»Ї Я«цЯ«»Я«ЙЯ«░Я«┐Я«фЯ»ЇЯ«фЯ«цЯ«▒Я»ЇЯ«ЋЯ»Ђ Я«ЄЯ«цЯ»Ђ Я«фЯ«»Я«ЕЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«хЯ«ЙЯ«ЋЯ«Е Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«ЎЯ»ЇЯ«ЋЯ«│Я«┐Я«▓Я»ЂЯ««Я»Ї Я«ЄЯ«цЯ»Ђ Я«фЯ«»Я«ЕЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
РЌЈ Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я»І Я«ЋЯ»ЂЯ«│Я»ІЯ«░Я«┐Я«ЋЯ»Ї Я«ЁЯ««Я«┐Я«▓Я««Я»Ї,
Я«ЋЯ«┤Я«┐Я«хЯ«▒Я»ѕЯ«ЋЯ«│Я»ѕЯ«цЯ»Ї Я«цЯ»ѓЯ«»Я»ЇЯ««Я»ѕЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ»ЂЯ««Я»Ї Я«фЯ»іЯ«░Я»ЂЯ«│Я«ЙЯ«ЋЯ«фЯ»Ї Я«фЯ«»Я«ЕЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
РЌЈ Я«џЯ«┐Я«ЪЯ»ЇЯ«░Я«┐Я«ЋЯ»Ї Я«ЁЯ««Я«┐Я«▓Я««Я»Ї Я«ЅЯ«БЯ«хЯ»ЂЯ«фЯ»Ї Я«фЯ»іЯ«░Я»ЂЯ«│Я»ЇЯ«ЋЯ«│Я»ѕЯ«фЯ»Ї Я«фЯ«цЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ«хЯ»ЂЯ««Я»Ї,
Я«еЯ»ЂЯ«░Я»ѕЯ«цЯ»ЇЯ«цЯ»ЂЯ«фЯ»ЇЯ«фЯ»іЯ«ЎЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«ЅЯ«фЯ»ЇЯ«фЯ»ЂЯ«ЋЯ«│Я»Ї Я«цЯ«»Я«ЙЯ«░Я«┐Я«ЋЯ»ЇЯ«ЋЯ«хЯ»ЂЯ««Я»Ї Я«фЯ«»Я«ЕЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
РЌЈ Я«еЯ»ѕЯ«ЪЯ»ЇЯ«░Я«┐Я«ЋЯ»Ї Я«ЁЯ««Я«┐Я«▓Я««Я»Ї Я«ЅЯ«░Я««Я«ЙЯ«ЋЯ«фЯ»Ї Я«фЯ«»Я«ЕЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї Я«ЁЯ««Я»ЇЯ««Я»ІЯ«ЕЯ«┐Я«»Я««Я»Ї Я«еЯ»ѕЯ«ЪЯ»ЇЯ«░Я»ЄЯ«ЪЯ»Ї Я«јЯ«ЕЯ»ЇЯ«▒ Я«џЯ»ЄЯ«░Я»ЇЯ««Я«цЯ»ЇЯ«цЯ»ѕЯ«»Я»ЂЯ««Я»Ї,
Я«џЯ«ЙЯ«»Я«ЎЯ»ЇЯ«ЋЯ«│Я»Ї, Я«хЯ«БЯ»ЇЯ«БЯ«фЯ»Ї Я«фЯ»ѓЯ«џЯ»ЇЯ«џЯ»ЂЯ«ЋЯ«│Я»Ї Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я««Я«░Я»ЂЯ«еЯ»ЇЯ«цЯ»ЂЯ«ЋЯ«│Я»ѕЯ«»Я»ЂЯ««Я»Ї Я«цЯ«»Я«ЙЯ«░Я«┐Я«ЋЯ»ЇЯ«ЋЯ«фЯ»Ї Я«фЯ«»Я«ЕЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
РЌЈ Я«єЯ«ЋЯ»ЇЯ«ИЯ«ЙЯ«▓Я«┐Я«ЋЯ»Ї Я«ЁЯ««Я«┐Я«▓Я««Я»Ї Я«ЋЯ»ЂЯ«хЯ«ЙЯ«░Я»ЇЯ«ЪЯ»ЇЯ«ИЯ»Ї Я«фЯ«ЪЯ«┐Я«ЋЯ«цЯ»ЇЯ«цЯ«┐Я«▓Я»Ї Я«ЈЯ«▒Я»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї Я«ЄЯ«░Я»ЂЯ««Я»ЇЯ«фЯ»Ђ Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я««Я«ЙЯ«ЎЯ»ЇЯ«ЋЯ«ЕЯ»ђЯ«џЯ»Ђ Я«фЯ«ЪЯ«┐Я«хЯ»ЂЯ«ЋЯ«│Я»ѕ Я«џЯ»ЂЯ«цЯ»ЇЯ«цЯ««Я»Ї Я«џЯ»єЯ«»Я»ЇЯ«»Я«хЯ»ЂЯ««Я»Ї,
Я««Я«░Я«фЯ»ЇЯ«фЯ»іЯ«░Я»ЂЯ«│Я»ЇЯ«ЋЯ«│Я»ѕЯ«цЯ»Ї Я«цЯ»ѓЯ«»Я»ЇЯ««Я»ѕЯ«»Я«ЙЯ«ЋЯ»ЇЯ«ЋЯ«хЯ»ЂЯ««Я»Ї Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«ЋЯ«░Я»ЂЯ«фЯ»ЇЯ«фЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«▒Я»ѕЯ«ЋЯ«│Я»ѕ Я«еЯ»ђЯ«ЋЯ»ЇЯ«ЋЯ«хЯ»ЂЯ««Я»Ї Я«фЯ«»Я«ЕЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
РЌЈ Я«ЋЯ«ЙЯ«░Я»ЇЯ«фЯ«ЙЯ«ЕЯ«┐Я«ЋЯ»Ї Я«ЁЯ««Я«┐Я«▓Я««Я»Ї Я«ЋЯ«ЙЯ«▒Я»ЇЯ«▒Я»Ђ Я«ЁЯ«ЪЯ»ѕЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«Ъ Я«фЯ«ЙЯ«ЕЯ«ЎЯ»ЇЯ«ЋЯ«│Я«┐Я«▓Я»Ї Я«фЯ«»Я«ЕЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
РЌЈ Я«ЪЯ«ЙЯ«░Я»ЇЯ«ЪЯ«ЙЯ«░Я«┐Я«ЋЯ»Ї Я«ЁЯ««Я«┐Я«▓Я««Я«ЙЯ«ЕЯ«цЯ»Ђ Я«░Я»іЯ«ЪЯ»ЇЯ«ЪЯ«┐Я«џЯ»Ї Я«џЯ»ІЯ«ЪЯ«ЙЯ«хЯ«┐Я«ЕЯ»Ї Я«њЯ«░Я»Ђ Я«фЯ«ЋЯ»ЂЯ«цЯ«┐Я«фЯ»ЇЯ«фЯ»іЯ«░Я»ЂЯ«│Я«ЙЯ«ЋЯ»ЂЯ««Я»Ї.
Я«ЅЯ«ЎЯ»ЇЯ«ЋЯ«│Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ«цЯ»Ї Я«цЯ»єЯ«░Я«┐Я«»Я»ЂЯ««Я«Й?
Я«ЁЯ««Я«┐Я«▓Я«ЋЯ»Ї Я«ЋЯ«░Я»ѕЯ«џЯ«▓Я«┐Я«▓Я»Ї Я«еЯ»ђЯ«░Я«┐Я«ЕЯ»Ї Я«фЯ«ЎЯ»ЇЯ«ЋЯ»Ђ
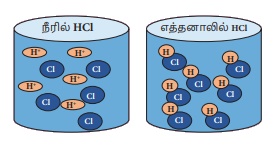
Я«ЁЯ««Я«┐Я«▓Я«ЎЯ»ЇЯ«ЋЯ«│Я»Ї Я«еЯ»ђЯ«░Я«┐Я«▓Я»Ї Я«ЋЯ«░Я»ѕЯ«»Я»ЂЯ««Я»Ї Я«фЯ»ІЯ«цЯ»Ђ Я««Я«ЪЯ»ЇЯ«ЪЯ»ЂЯ««Я»Є Я«цЯ«ЎЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«фЯ«БЯ»ЇЯ«фЯ»ЂЯ«ЋЯ«│Я»ѕ Я«хЯ»єЯ«│Я«┐Я«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ»ЂЯ««Я»Ї. Я«еЯ»ђЯ«░Я«┐Я«▓Я»Ї Я«ЋЯ«░Я»ѕЯ«»Я»ЂЯ««Я»Ї Я«фЯ»ІЯ«цЯ»Ђ Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я«юЯ«ЕЯ»Ї (H+) Я«ЁЯ«»Я«ЕЯ«┐Я«ЋЯ«│Я»ѕЯ«цЯ»Ї Я«цЯ«░Я»ЂЯ«хЯ«цЯ«ЙЯ«▓Я»Ї, Я«ЁЯ«цЯ»Ђ Я«ЁЯ««Я«┐Я«▓Я««Я»Ї Я«јЯ«Е Я«ЁЯ«▒Я«┐Я«»Я««Я»ЂЯ«ЪЯ«┐Я«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«ЁЯ«цЯ»Є Я«џЯ««Я«»Я««Я»Ї Я«ЋЯ«░Я«┐Я««Я«ЋЯ»Ї Я«ЋЯ«░Я»ѕЯ«фЯ»ЇЯ«фЯ«ЙЯ«ЕЯ«┐Я«▓Я»Ї Я«ЁЯ««Я«┐Я«▓Я«ЎЯ»ЇЯ«ЋЯ«│Я»Ї Я«ЁЯ«»Я«ЕЯ«┐Я«»Я»ЂЯ«▒Я»ЂЯ«хЯ«цЯ«┐Я«▓Я»ЇЯ«▓Я»ѕ.
Я«ј.Я«ЋЯ«Й: Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я«юЯ«ЕЯ»Ї Я«ЋЯ»ЂЯ«│Я»ІЯ«░Я»ѕЯ«ЪЯ»Ђ Я«еЯ»ђЯ«░Я«┐Я«▓Я»Ї Я«ЋЯ«░Я»ѕЯ«»Я»ЂЯ««Я»ЇЯ«фЯ»ІЯ«цЯ»Ђ H+, CI- Я«ЁЯ«»Я«ЕЯ«┐Я«ЋЯ«│Я»ѕЯ«цЯ»Ї Я«цЯ«░Я»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«ЁЯ«цЯ»Є Я«џЯ««Я«»Я««Я»Ї Я«јЯ«цЯ»ЇЯ«цЯ«ЕЯ«ЙЯ«▓Я»Ї Я«фЯ»ІЯ«ЕЯ»ЇЯ«▒ Я«ЋЯ«░Я«┐Я««Я«ЋЯ»Ї Я«ЋЯ«░Я»ѕЯ«фЯ»ЇЯ«фЯ«ЙЯ«ЕЯ«┐Я«▓Я»Ї Я«ЁЯ«»Я«ЕЯ«┐Я«»Я»ЂЯ«▒Я«ЙЯ««Я«▓Я»Ї Я««Я»ѓЯ«▓Я«ЋЯ»ЇЯ«ЋЯ»ѓЯ«▒Я»ЂЯ«ЋЯ«│Я«ЙЯ«ЋЯ«хЯ»Є Я«ЄЯ«░Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї.
4. Я«ЄЯ«░Я«ЙЯ«юЯ«цЯ«┐Я«░Я«ЙЯ«хЯ«ЋЯ««Я»Ї
Я«ЅЯ«▓Я»ІЯ«ЋЯ«ЎЯ»ЇЯ«ЋЯ«│Я«┐Я«▓Я»Ї Я«цЯ«ЎЯ»ЇЯ«ЋЯ««Я»Ї Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«хЯ»єЯ«│Я»ЇЯ«│Я«┐ Я««Я«ЪЯ»ЇЯ«ЪЯ»ЂЯ««Я»Є HCI
Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї HNO3 Я«ЅЯ«ЪЯ«ЕЯ»Ї Я«хЯ«┐Я«ЕЯ»ѕЯ«фЯ»ЂЯ«░Я«┐Я«»Я«ЙЯ«цЯ»Ђ Я«јЯ«ЕЯ»ЇЯ«фЯ«цЯ»Ђ Я«еЯ«ЙЯ««Я»Ї Я«ЁЯ«▒Я«┐Я«еЯ»ЇЯ«ц Я«њЯ«ЕЯ»ЇЯ«▒Я»Ђ. Я«єЯ«ЕЯ«ЙЯ«▓Я»Ї Я«ЄЯ«еЯ»ЇЯ«ц Я«ЄЯ«░Я«БЯ»ЇЯ«ЪЯ»Ђ Я«ЁЯ««Я«┐Я«▓Я«ЎЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«ЋЯ«▓Я«хЯ»ѕ Я«цЯ«ЎЯ»ЇЯ«ЋЯ«цЯ»ЇЯ«цЯ»ѕЯ«ЋЯ»Ї Я«ЋЯ«░Я»ѕЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«цЯ«┐Я«▒Я«ЕЯ»ЂЯ«│Я»ЇЯ«│Я«цЯ»Ђ. Я«ЁЯ«еЯ»ЇЯ«ц Я«ЋЯ«▓Я«хЯ»ѕЯ«»Я«┐Я«ЕЯ»Ї Я«фЯ»єЯ«»Я«░Я»Ї Я«ЄЯ«░Я«ЙЯ«юЯ«цЯ«┐Я«░Я«ЙЯ«хЯ«ЋЯ««Я»Ї Я«јЯ«ЕЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї. Я«ЄЯ«░Я«ЙЯ«юЯ«цЯ«┐Я«░Я«ЙЯ«хЯ«ЋЯ««Я»Ї Я«јЯ«ЕЯ»ЇЯ«фЯ«цЯ»Ђ Я««Я»ѓЯ«ЕЯ»ЇЯ«▒Я»Ђ Я«фЯ«ЎЯ»ЇЯ«ЋЯ»Ђ Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я»ІЯ«ЋЯ»ЂЯ«│Я»ІЯ«░Я«┐Я«ЋЯ»Ї Я«ЁЯ««Я«┐Я«▓Я««Я»Ї, Я«њЯ«░Я»Ђ Я«фЯ«ЎЯ»ЇЯ«ЋЯ»Ђ Я«еЯ»ѕЯ«ЪЯ»ЇЯ«░Я«┐Я«ЋЯ»Ї Я«ЁЯ««Я«┐Я«▓Я««Я»Ї Я«ЋЯ«▓Я«еЯ»ЇЯ«ц Я«ЋЯ«▓Я«хЯ»ѕ Я«єЯ«ЋЯ»ЂЯ««Я»Ї. Я«ЄЯ«цЯ«ЕЯ»Ї Я««Я»ІЯ«▓Я«ЙЯ«░Я»Ї Я«хЯ«┐Я«ЋЯ«┐Я«цЯ««Я»Ї 3
: 1. Я«ЄЯ«цЯ»Ђ Я««Я«ъЯ»ЇЯ«џЯ«│Я»Ї - Я«єЯ«░Я«ъЯ»ЇЯ«џЯ»Ђ Я«еЯ«┐Я«▒Я««Я»ЂЯ«ЪЯ»ѕЯ«» Я«фЯ»ЂЯ«ЋЯ»ѕЯ«»Я«ЋЯ»ЇЯ«ЋЯ»ѓЯ«ЪЯ«┐Я«» Я«цЯ«┐Я«░Я«хЯ««Я»Ї Я«єЯ«ЋЯ»ЂЯ««Я»Ї. Я«ЄЯ«цЯ»Ђ Я«цЯ«ЎЯ»ЇЯ«ЋЯ««Я»Ї Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«џЯ«┐Я«▓ Я«ЋЯ«ЪЯ«┐Я«Е Я«ЅЯ«▓Я»ІЯ«ЋЯ«ЎЯ»ЇЯ«ЋЯ«│Я»ѕЯ«»Я»ЂЯ««Я»Ї Я«ЁЯ«цЯ«┐Я«Ћ Я«ЁЯ«│Я«хЯ«┐Я«▓Я»Ї Я«ЁЯ«░Я«┐Я««Я«ЙЯ«ЕЯ««Я»Ї Я«џЯ»єЯ«»Я»ЇЯ«»Я«ЋЯ»Ї Я«ЋЯ»ѓЯ«ЪЯ«┐Я«» Я«цЯ«┐Я«▒Я«ЕЯ»Ї Я«ЋЯ»іЯ«БЯ»ЇЯ«ЪЯ«цЯ»Ђ.
Я«ЄЯ«░Я«ЙЯ«ю Я«цЯ«┐Я«░Я«ЙЯ«хЯ«ЋЯ««Я»Ї Я«јЯ«ЕЯ»ЇЯ«▒ Я«џЯ»іЯ«▓Я»Ї Я«ЄЯ«▓Я«цЯ»ЇЯ«цЯ»ђЯ«ЕЯ»Ї Я««Я»іЯ«┤Я«┐Я«»Я«┐Я«▓Я«┐Я«░Я»ЂЯ«еЯ»ЇЯ«цЯ»Ђ Я«фЯ»єЯ«▒Я«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«ЪЯ«цЯ»Ђ. Я«ЄЯ«цЯ«ЕЯ»Ї Я«фЯ»іЯ«░Я»ЂЯ«│Я»Ї Я«цЯ«┐Я«░Я«хЯ«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»Ї Я«ЁЯ«░Я«џЯ«ЕЯ»ЇЯ«јЯ«ЕЯ»ЇЯ«фЯ«цЯ«ЙЯ«ЋЯ»ЂЯ««Я»Ї. Я«ЄЯ«цЯ»ЂЯ««Я«┐Я«ЋЯ»ЂЯ«еЯ»ЇЯ«ц Я«єЯ«▒Я»ЇЯ«▒Я«▓Я»Ї Я«ЋЯ»іЯ«БЯ»ЇЯ«ЪЯ«цЯ»Ђ. Я«ЄЯ«░Я«ЙЯ«юЯ«цЯ«┐Я«░Я«ЙЯ«хЯ«ЋЯ««Я»Ї Я««Я«┐Я«Ћ Я«ЅЯ«ЕЯ»ЇЯ«ЕЯ«цЯ««Я«ЙЯ«Е Я«еЯ«┐Я«▓Я»ѕЯ«»Я«┐Я«▓Я»Ї Я«ЅЯ«│Я»ЇЯ«│ Я«цЯ«ЎЯ»ЇЯ«ЋЯ««Я»Ї,
Я«фЯ«┐Я«│Я«ЙЯ«ЪЯ»ЇЯ«ЪЯ«┐Я«ЕЯ««Я»Ї Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«фЯ»єЯ«▓Я»ЇЯ«▓Я»ЄЯ«ЪЯ«┐Я«»Я««Я»Ї Я«фЯ»ІЯ«ЕЯ»ЇЯ«▒ Я«ЅЯ«▓Я»ІЯ«ЋЯ«ЎЯ»ЇЯ«ЋЯ«│Я»ѕЯ«ЋЯ»Ї Я«ЋЯ»ѓЯ«Ъ Я«ЋЯ«░Я»ѕЯ«ЋЯ»ЇЯ«ЋЯ«хЯ«▓Я»ЇЯ«▓Я«цЯ»Ђ.
Я«хЯ»ЄЯ«цЯ«┐ Я«хЯ«ЙЯ«»Я»ЇЯ«фЯ«ЙЯ«ЪЯ»Ђ :
3
HCl + HNO3
Я«еЯ»ђЯ«░Я«┐Я«▓Я»Ї Я«ЋЯ«░Я»ѕЯ«цЯ«┐Я«▒Я«ЕЯ»Ї :
Я«ЋЯ«░Я»ѕЯ«»Я»ЂЯ««Я»Ї
Я«ЅЯ«░Я»ЂЯ«ЋЯ»Ђ Я«еЯ«┐Я«▓Я»ѕ :
- 42┬░C
(- 44┬░E, 231K)
Я«ЋЯ»іЯ«цЯ«┐ Я«еЯ«┐Я«▓Я»ѕ :
108┬░C
(226┬░E, 381K)
Я«ЄЯ«░Я«ЙЯ«юЯ«цЯ«┐Я«░Я«ЙЯ«хЯ«ЋЯ«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»Ї Я«фЯ«»Я«ЕЯ»ЇЯ«ЋЯ«│Я»Ї
1.
Я«цЯ«ЎЯ»ЇЯ«ЋЯ««Я»Ї Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«фЯ«┐Я«│Я«ЙЯ«ЪЯ»ЇЯ«ЪЯ«┐Я«ЕЯ««Я»Ї Я«фЯ»ІЯ«ЕЯ»ЇЯ«▒ Я«ЅЯ«▓Я»ІЯ«ЋЯ«ЎЯ»ЇЯ«ЋЯ«│Я»ѕЯ«ЋЯ»Ї Я«ЋЯ«░Я»ѕЯ«фЯ»ЇЯ«фЯ«цЯ«▒Я»ЇЯ«ЋЯ»Ђ Я««Я»ЂЯ«цЯ«ЕЯ»ЇЯ««Я»ѕЯ«»Я«ЙЯ«ЋЯ«фЯ»Ї Я«фЯ«»Я«ЕЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
2. Я«цЯ«ЎЯ»ЇЯ«ЋЯ«цЯ»ЇЯ«цЯ»ѕ Я«џЯ»ЂЯ«цЯ»ЇЯ«цЯ««Я»Ї Я«џЯ»єЯ«»Я»ЇЯ«»Я«хЯ»ЂЯ««Я»Ї, Я«џЯ»ЂЯ«цЯ»ЇЯ«цЯ«┐Я«ЋЯ«░Я«┐Я«ЋЯ»ЇЯ«ЋЯ«хЯ»ЂЯ««Я»Ї Я«фЯ«»Я«ЕЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.