வேதியியல் - அசாதாரண மோலார் நிறை | 11th Chemistry : UNIT 9 : Solutions
11 வது வேதியியல் : அலகு 9 : கரைசல்கள்
அசாதாரண மோலார் நிறை
அசாதாரண மோலார் நிறை
சோதனை மூலம் கண்டறியப்பட்ட தொகைசார் பண்புகளைப் பயன்படுத்தி, எளிதில் ஆவியாகாத கரைபொருளின் மோலார் நிறைகளை துல்லியமாக கணக்கிட முடியும். இந்த முறையில், கரைசலானது மிக நீர்த்த கரைசல் எனவும், கரைசலில் கரைபொருள் மூலக்கூறுகள் பிரிகையடைவதோ அல்லது இணைவதோ இல்லை எனவும் கருதப்படுகிறது.
செறிவு மிகுந்த கரைசலில், கரைபொருள் மற்றும் கரைப்பான் இடையீடுகள் முக்கியத்துவம் பெறுகின்றன, மேலும் இது அளவிடப்பட்ட தொகைசார் பண்புகளின் மதிப்புகளை பாதிக்கிறது. இதேபோல, கரைபொருள் மூலக்கூறுகள் பிரிகையடைதல் அல்லது இணைதல் ஆகியவற்றின் காரணமாக கரைசலில் உள்ள கரைபொருள் துகள்களின் எண்ணிக்கை மாறலாம், இந்நிகழ்வும் அளவிடப்பட்ட தொகைசார் பண்புகளின் மதிப்புகளை பாதிக்கிறது. இத்தகைய கரைசல்களில், கரைபொருளின் கணக்கிடப்பட்ட மோலார் நிறையின் மதிப்பானது, உண்மையான மோலார் நிறை மதிப்பிலிருந்து மாறுபடுகிறது. மேலும் இது அசாதாரண மோலார் நிறை என்றழைக்கப்படுகிறது.
கரைபொருள் மூலக்கூறுகள் இணைதல் அல்லது பிரிகையடைதல்:
பொதுவாக, அளவிடப்பட்ட தொகைசார் பண்புகளிலிருந்து மோலார் நிறைகளை கணக்கிடும் முறைகளில், கரைபொருள் மூலக்கூறுகள் பிரிகையடைவதோ அல்லது இணைவதோ இல்லை என கருத்திற்கொள்ளப்படுகிறது. சில கரைப்பான்களில், கரைபொருள் மூலக்கூறுகள் இணைந்து இருமடி அல்லது மும்மடி போன்றவைகளை உருவாக்குகின்றன. இது கரைசலில் உள்ள துகள்களின் (மூலக்கூறுகள்) எண்ணிக்கையை குறைக்கிறது. இதன் விளைவாக உண்மையான மூலக்கூறு நிறையை விட, கணக்கிடப்பட்ட மூலக்கூறு நிறையானது அதிகமாக உள்ளது. பென்சீனில் கரைந்த அசிட்டிக் அமில கரைசலைக் கருதுவோம். அசிட்டிக் அமிலமானது மூலக்கூறுகளுக்கிடையே ஹைட்ரஜன் பிணைப்பை உருவாக்கும் (படம் 9.9), மேலும் இது இருமடி மூலக்கூறாக உள்ளது எனும் கருத்து ஏற்கனவே விளக்கப்பட்டது.
2CH3COOH → (CH3COOH)2
தொகைசார் பண்புகளைக் கொண்டு கணக்கிடப்பட்ட, அசிட்டிக் அமிலத்தின் மோலார் நிறையானது 120 g mol-1 , இது உண்மையான மோலார் நிறையைப் (60 g mol -1) போல இருமடங்காகும்.
KCl அல்லது NaCl போன்ற மின்பகுளிகள், அவற்றின் நீர்க்கரைசல்களில், முழுமையாக, அவற்றின் அயனிக் கூறுகளாக பிரிகையடைகின்றன. இது. கரைசல்களில் உள்ள மொத்த துகள்களின் (அயனிகள்) எண்ணிக்கையை அதிகரிக்கச் செய்கிறது. இவ்வகை கரைசல்களின், தொகைசார் பண்புகளைப் பயன்படுத்தி கணக்கிடப்பட்ட மோலார் நிறையானது, உண்மையான மோலார் நிறையை விட குறைவாக உள்ளது. எடுத்துக்காட்டாக, சோடியம் குளோரைடானது அதன் நீர்க்கரைசலில், பின்வருமாறு Na+ மற்றும் Cl- அயனிகளாக பிரிகையடைகிறது.
NaCl (s) → Na+ (aq) + Cl- (aq)
ஒரு மோல் (58.4 g) சோடியம் குளோரைடை நீரில் கரைக்கும்போது, அது பிரிகையடைந்து 1 மோல் Na+ அயனியை, l மோல் Cl- அயனியை தருகிறது. எனவே கரைசலானது, 2 மோல்கள் துகள்களைக் கொண்டிருக்கும். அதாவது, தொகைசார்பண்புகளின் மதிப்புகள், எதிர்பார்க்கப்பட்ட மதிப்பைவிட இருமடங்கு இருக்கும்.
வாண்ட் ஹாஃப் காரணி
கரைபொருள் மூலக்கூறுகள் பிரிகையடைதல் அல்லது இணைதலினால் கணக்கிடப்பட்ட தொகைசார் பண்புகளின் மதிப்புகள் அதிகரிக்கவோ அல்லது குறையவோ செய்யும் என்பதை நாம் கற்றறிந்தோம். இந்த மாறுபாடானது, இணைதல் அல்லது பிரிகையடைதலின் வீதத்திற்கு நேர்விகிதத்திலிருக்கும், கரைசலில், கரைபொருளின் இணைதல் அல்லது பிரிகையடைதலின் வீதத்தை கணக்கிடுவதற்காக, வாண்ட் ஹாஃப் ‘i’ எனும் சொற்கூற்றை அறிமுகப்படுத்தினார். அது இப்பொழுது, வாண்ட் ஹாஃப் காரணி என்றழைக்கப்படுகிறது. இது, கரைபொருளின் உண்மையான மோலார் நிறைக்கும், அசாதாரண (கணக்கிடப்பட்டது) மோலார் நிறைக்கும் இடையே உள்ள விகிதம் என வரையறுக்கப்படுகிறது. இங்கு அசாதாரண மோலார் நிறை என்பது, சோதனை மூலம் கண்டறியப்பட்ட தொகைசார் பண்புகளை பயன்படுத்தி கணக்கிடப்பட்ட மோலார் நிறை ஆகும்.
i = சாதாரண (உண்மையான) மோலார் நிறை / அசாதாரண (அளவிடப்பட்ட) மோலார் நிறை
i = அளவிடப்பட்ட தொகைசார் பண்பு / கணக்கிடப்பட்ட தொகைசார் பண்பு

பென்சீனில், அசிட்டிக் அமிலம் கரைந்துள்ள கரைசலின் கணக்கிடப்பட்ட வாண்ட் ஹாஃப் காரணி மதிப்பு 0.5. மேலும் சோடியம் குளோரைடின் நீர்க்கரைசலுக்கு இதன் மதிப்பு 2. பிரிகையடைதல் அல்லது இணைதல் வீதங்களை வாண்ட் ஹாஃப் காரணியுடன் (i) பின்வரும் சமன்பாட்டை பயன்படுத்தி, தொடர்புபடுத்த முடியும்.
αபிரிகையடைதல் = i-1/n-1
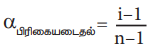
(இங்கு n என்பது ஒரு மூலக்கூறு பிரிகையடைந்து உருவாகும் அயனிகள்/ துகள்களின் எண்ணிக்கை)
αஇணைதல் = (l-i)n /n-1
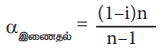
(இங்கு n என்பது ஒரு இணைப்பு முலக்கூறை உருவாக்குவதற்காக இணையும் கரைபொருள் மூலக்கூறுகளின் எண்ணிக்கை)
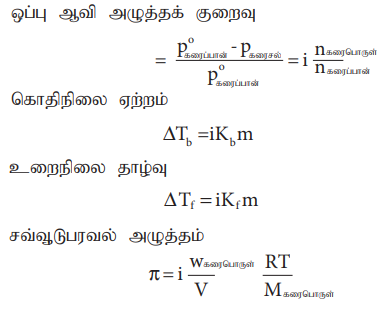
நான்கு தொகைசார் பண்புகளை, கரைபொருளின் செறிவுகளுடன் தொடர்புபடுத்தும் சமன்பாடுகளுடன் வாண்ட் ஹாஃப் காரணியை இணைத்து, பின்வருமாறு எழுத முடியும்.
ஒப்பு ஆவி அழுத்தக் குறைவு
= (Poகரைப்பான் – Pகரைசல் / Pகரைப்பான்) = i (nகரைபொருள் / nகரைப்பான்)
கொதிநிலை ஏற்றம்
ΔTb = iKb m
உறைநிலை தாழ்வு
ΔTf = iKf m
சவ்வூடுபரவல் அழுத்தம்
π = i Wகரைபொருள் / V (RT/Mகரைபொருள்)
பிரிகையடைதல் அல்லது இணைதல் நிகழாத கரைபொருளுக்கு வாண்ட் ஹாஃப் காரணி மதிப்பு 1. மேலும், அதன் கண்டறியப்பட்ட மோலார் நிறையானது, உண்மையான மோலார் நிறைக்கு அருகாமை மதிப்பைப் பெற்றிருக்கும்.
கரைசலில், இணைந்து உயர்படி ஒலிகோமரைத் தரும் கரைபொருள்களின் வாண்ட் ஹாஃப் காரணி மதிப்பு ஒன்றைவிடக் குறைவு (i < 1) மேலும், அளவிடப்பட்ட மோலார் நிறையானது, உண்மையான மோலார் நிறையைவிட அதிகமாக இருக்கும்.
பிரிகையடைந்து அவற்றின் உட்கூறு அயனிகளை உருவாக்கும் கரைபொருள்களின் வாண்ட் ஹாஃப் காரணி மதிப்பு ஒன்றைவிடக் அதிகம் (i > 1) மேலும், அளவிடப்பட்ட மோலார் நிறையானது, உண்மையான மோலார் நிறையைவிட குறைவாக இருக்கும்.
கணக்கு - 7
200 கிராம் நீரில் 1 கிராம் NaCl ஐ கரைப்பதன்மூலம், 0.24 K உறைநிலைத் தாழ்வு ஏற்படுத்தப்பட்டது. வாண்ட்ஹாஃப் கரணியைக் கணக்கிடுக. மோலால் உறைநிலைத் தாழ்வு மாறிலி மதிப்பு 1.86 K Kg mol-1
கரைபொருளின் மோலார் நிறை

= 38.75g mol-1
= 38.75g mol-
NaCl யின் கருத்தியலான மோலார் நிறை = 58.5
i = கருத்தியலான மோலார் நிறை / அளவிடப்பட்ட மோலார் நிறை = 58.5 / 38.75
= 1.50