கரைசல்கள் | வேதியியல் - தொகைசார் பண்புகள் | 11th Chemistry : UNIT 9 : Solutions
11 வது வேதியியல் : அலகு 9 : கரைசல்கள்
தொகைசார் பண்புகள்
தொகைசார் பண்புகள்
தூய நீர் சுவையற்றது. நீங்கள் சர்க்கரையை சேர்க்கும்போது, அது இனிப்பு சுவையுடையதாகிறது, உப்பை சேர்த்தால் உவர்ப்பாகிறது. இதிலிருந்து கரைசலிலுள்ள கரைபொருள் துகள்களின் தன்மையை பொருத்து கரைசலின் பண்புகள் அமைகின்றன என்பதை அறியலாம். எனினும், ஒரு நீர்த்த நல்லியல்புக் கரைசலுக்கு, அதன் ஒப்பு ஆவிஅழுத்தக் குறைவு கொதிநிலை ஏற்றம், உறைநிலைத் தாழ்வு மற்றும் சவ்வூடுபரவல் அழுத்தம் போன்ற பண்புகள் கரைபொருளின் வேதித் தன்மையை சார்ந்து அமையாமல், கரைசலில் உள்ள கரைபொருள் துகள்களின் (அயனிகள் / மூலக்கூறுகள்) எண்ணிக்கையினை மட்டுமே சார்ந்து அமைகின்றன. இந்த நான்கு பண்புகளும் தொகைசார் பண்புகள் என அறியப்படுகின்றன. இந்த பண்புகளின் அளவீட்டு மதிப்புகள் குறைவு எனினும், அவைகள் அதிகளவிலான நடைமுறைப்பயன்பாடுகளைப் பெற்றுள்ளன. எடுத்துக்காட்டாக, சவ்வூடு பரவல் அழுத்தமானது சில முக்கிய உயிரியல் அமைப்புகளில் இன்றியமையாததாகும்.
ஒப்பு ஆவி அழுத்தக்குறைவு (ΔP)
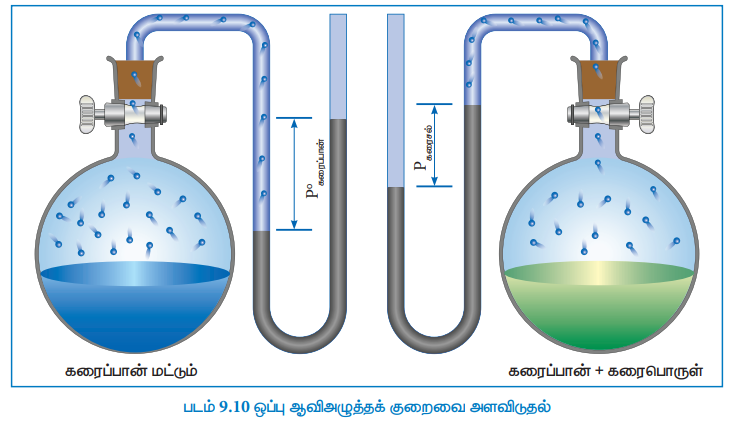
மின்பகுளியல்லாத எளிதில் ஆவியாகாத தன்மையுடைய, கரைபொருளைக் கொண்டுள்ள கரைசல்களின் ஆவிஅழுத்தமானது, எப்பொழுதும், தூய கரைப்பானின் ஆவி அழுத்தத்தைவிட குறைவாகவே இருக்கும். தூய கரைப்பான் அதன் ஆவி நிலைமையுடன் சமநிலையில் இருக்கும் ஒரு மூடிய அமைப்பைக் கருதுவோம். சமநிலையில், திரவ மற்றும் ஆவி ஆகிய இரு நிலைமைகளிலும் காணப்படும் கரைப்பானின், கிப்ஸ் கட்டிலா ஆற்றல் மதிப்பு சமமாக இருக்கும் (ΔG = 0). இந்த கரைப்பானுடன், கரைபொருளைச் சேர்க்கும்போது, கரைதல் நிகழ்கிறது. இந்நிகழ்வில் என்ட்ரோபி அதிகரிப்பதால் அதன் கட்டிலா ஆற்றல் (G) குறைகிறது. சமநிலையை பராமரிக்க, ஆவி நிலைமையின் கட்டிலா ஆற்றலும் குறைய வேண்டும். கொடுக்கப்பட்ட ஒரு வெப்பநிலையில், ஆவி நிலைமையின் கட்டிலா ஆற்றல் குறைய வேண்டுமெனில் அதன் அழுத்தம் குறைவது மட்டுமே சாத்தியமான ஒன்றாகும். அதாவது, சமநிலையை பராமரிக்க கரைசலின் ஆவிஅழுத்தம் கண்டிப்பாக குறைய வேண்டும்.
ரௌல்ட் விதிப்படி, ஒப்பு ஆவிஅழுத்தக்குறைவானது, கரைபொருளின் மோல் பின்னத்திற்கு சமம் என்பதை நாம் அறிவோம். (சமன்பாடு 9.16)
மேற்காண் சமன்பாட்டிலிருந்து, ஒப்பு ஆவிஅழுத்தக்குறைவானது கரைபொருளின் மோல் பின்னத்தை (xB) மட்டுமே சார்ந்திருக்கும், மேலும் அதன் தன்மையைச் சார்ந்திருக்காது என்பது தெளிவாகிறது. எனவே, ஒப்பு ஆவிஅழுத்தக்குறைவானது ஒரு தொகைசார் பண்பாகும்.
ஒப்பு ஆவிஅழுத்தக் குறைவிலிருந்து மோலார் நிறைகளை கணக்கிடுதல்
எளிதில் ஆவியாகாத கரைபொருளின் மோலார் நிறையை நிர்ணயிக்க ஒப்பு ஆவி அழுத்தக் குறைவு அளவீடுகளைப் பயன்படுத்த முடியும். இம்முறையில், நிறை தெரிந்த ஒரு கரைபொருளானது, ஒரு குறிப்பிட்ட அளவு நிறையுள்ள கரைப்பானில் கரைக்கப்படுகிறது. ஒப்பு ஆவிஅழுத்தக்குறைவானது சோதனை மூலம் அளவிடப்படுகிறது. ரௌல்ட் விதிப்படி ஒப்பு ஆவிஅழுத்தக்குறைவானது.
(P0கரைப்பான் – Pகரைசல் / P0கரைப்பான்) = XB
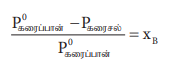
கரைப்பான் மற்றும் கரைபொருளின் எடைகள் முறையே WA மற்றும் WB என்க. மேலும் அவற்றின் மோலார் நிறைகள் முறையே MA மற்றும் MB எனில் கரைபொருளின் மோல் பின்னம் XB
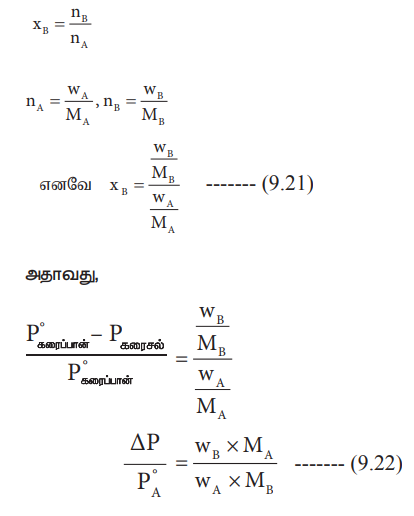
xB = nB / nA + nB --------- (9.20)
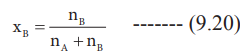
இங்கு, nA & nB என்பன முறையே கரைப்பான் மற்றும் கரைபொருளின் மோல்களின் எண்ணிக்கை நீர்த்த கரைசல்களுக்கு nA >> nB எனவே nA + nB ≈ nA இப்போது
xB = nB / nA
சமன்பாடு 9.35 லிருந்து, WA, WB, MA போன்ற தெரிந்த மதிப்புகளையும், அளவிடப்பட்ட ஒப்பு ஆவிஅழுத்தக்குறைவு மதிப்பையும் பயன்படுத்தி கரைபொருளின் மோலார் நிறையை MB கணக்கிட முடியும்.
கணக்கு:
2% எளிதில் ஆவியாகாத கரைபொருளை கொண்டுள்ள நீர்க் கரைசலானது, கரைப்பானின் கொதிநிலையில், 1.004 bar அழுத்தத்தை கொண்டுள்ளது. PAo மதிப்பு 1.013 bar ஆக இருக்கும்போது கரைபொருளின் மோலார் நிறை என்ன?
ΔΡ / PoA = WB × MA / MB × WA
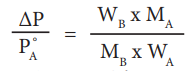
2 % கரைசலில் கரைபொருளின் எடை 2 கிராம், மற்றும் கரைப்பானின் எடை 98 கி.
ΔΡ = PoA - Ρகரைசல் = 1.013- 1.004 bar = 0.009 bar
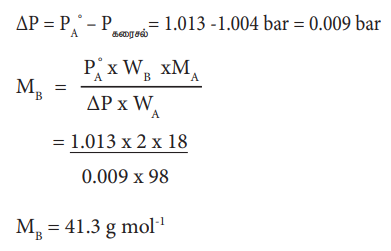
MB = 41.3g mol-1
தன் மதிப்பீடு
10. 27°C வெப்பநிலையில் A எனும் தூய திரவத்தின் ஆவிஅழுத்தம் 10.0 torr. 20 கிராம் A இல் 1 கிராம் B ஐ கரைப்பதால் ஆவிஅழுத்தம் 9.0 torr க்கு குறைகிறது. A யின் மோலார் நிறை 200 g mol-1 எனில், B யின் மோலார் நிறையை கணக்கிடுக.
தீர்வு:
PoA = 10 torr, Pகரைசல் = 9 torr
WA = 20g WB = 1g
MA = 200g mol-1 MB = ?
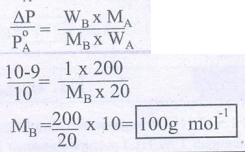
கொதிநிலை ஏற்றம்
கொதிநிலை என்பது ஒரு திரவத்தின் முக்கியமான இயற் பண்பாகும். எந்த ஒரு குறிப்பிட்ட வெப்பநிலையில், ஒரு திரவத்தின் ஆவி அழுத்தமானது வளிமண்டல அழுத்தத்திற்கு 1 atm க்குச் சமமாகிறதோ அவ்வெப்பநிலையானது, அத்திரவத்தின் கொதிநிலை ஆகும். எளிதில் ஆவியாகாத கரைபொருளை தூய கரைப்பானுடன், அதன் கொதிநிலையில் சேர்க்கும்போது. அதன் ஆவிஅழுத்தம் 1 atm க்கு கீழாக குறைகிறது. மீண்டும் ஆவிஅழுத்தத்தை 1 atm க்கு கொண்டு வர வேண்டுமெனில், கரைசலின் வெப்பநிலை உயர்த்தப்பட வேண்டும். இதன் விளைவாக, கரைசலானது, தூய கரைப்பானின் கொதிநிலையைவிட (Tbo) அதிக கொதிநிலையில் (Tb) கொதிக்கிறது. கொதிநிலையில் ஏற்படும் இந்த உயர்வானது, கொதிநிலை ஏற்றம் என அழைக்கப்படுகிறது. வெப்பநிலைக்கு எதிராக தூய கரைப்பான் (நீர்), நீர்க்கரைசல் ஆகியனவற்றின் ஆவிஅழுத்த வரைபடம் படம் 9.11ல் கொடுக்கப்பட்டுள்ளது.
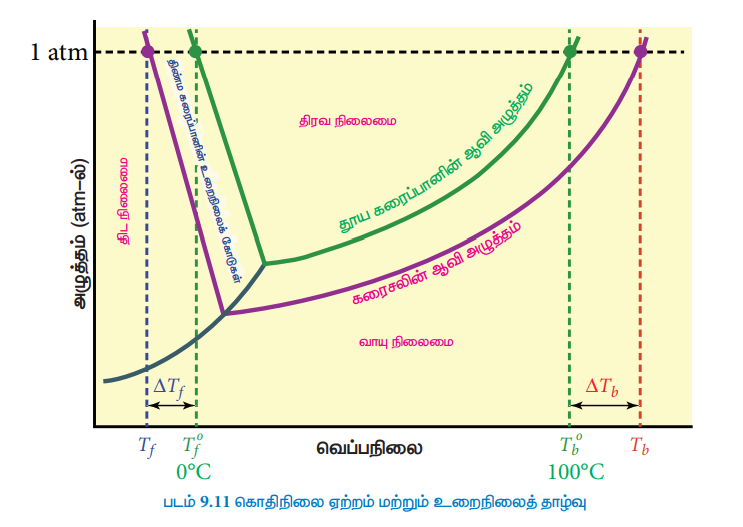
படம்-9.11ல் காட்டியுள்ளவாறு, 0oC லிருந்து வெப்பநிலை அதிகரிக்கும்போது, கரைசலின் ஆவிஅழுத்தமும் அதிகரிக்கிறது. வெப்பநிலையை பொறுத்து தூய நீரின் ஆவிஅழுத்தத்தில் ஏற்படும் மாறுபாடானது பச்சைநிற வளைகோடாக கொடுக்கப்பட்டுள்ளது. 100°C வெப்பநிலையில், நீரின் ஆவி அழுத்த மதிப்பு 1 atm க்குச் சமம். எனவே நீரின் கொதிநிலை 100 °C (Tbo). நீருடன் கரைபொருளை சேர்க்கும்போது, கிடைக்கும் கரைசலின் ஆவிஅழுத்தம் குறைகிறது. வெப்பநிலையை பொறுத்து கரைசலின் ஆவிஅழுத்தத்தில் ஏற்படும் மாறுபாடானது ஊதா நிற வளைகோடாக கொடுக்கப்பட்டுள்ளது. வரைப்படத்திலிருந்து கரைசலின் ஆவி அழுத்தமானது Tb வெப்ப நிலையில் 1 atm க்குச் சமமாக உள்ளது என அறிய முடிகிறது. இவ்வெப்பநிலையானது (Tbo) ஐவிட அதிகம். இந்த இரு வெப்பநிலைகளுக்கு இடையேயான வேறுபாடு (Tb - Tbo) கொதிநிலை ஏற்றத்தை தருகிறது.
கொதிநிலை ஏற்றம் (ΔTb) = Tb -Tb°
கொதிநிலை ஏற்றமானது, கரைபொருள் துகள்களின் செறிவிற்கு நேர்விகிதத்திலிருக்கும்
ΔTb α m --------- (9.23)
m என்பது மோலாலிட்டி அலகில் கரைசலின் செறிவு.
ΔTb = Kb m ------- (9.24)
இங்கு Kb = மோலால் கொதிநிலை ஏற்ற மாறிலி.
m = 1, எனில் ΔTb = Kb ;
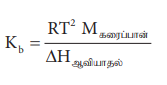
எனவே, Kb என்பது, 1 மோலால் கரைசலின் கொதிநிலை ஏற்றமாகும். Kb மதிப்புகள் பின்வரும் சமன்பாட்டின்படி கணக்கிடப்படுகிறது.
Kb = RT2 Mகரைப்பான் / ΔHஆவியாதல்
கொதிநிலை ஏற்ற மதிப்புகளிலிருந்து கரைபொருளின் மோலார் நிறையை கணக்கிடல்
WA கிராம் கரைப்பானில், WB கிராம் கரைபொருளை கரைத்து கரைசல் தயாரிக்கப்பட்டால், அதன் மோலாலிட்டி
m = கரைபொருளின் மோல் எண்ணிக்கை / கரைப்பானின் எடை (g) கரைபொருளின் × 1000 -----(9.25)
மோல் எண்ணிக்கை WB / MB -----(9.26)

இங்கு, MB = கரைபொருளின் மோலார் நிறை
எனவே,
m = WB × 1000 / MB × WA ------- (9.27)

மதிப்பை சமன்பாடு (9.24) ல் பிரதியிட
ΔTb = Kb × WB × 1000 / MB × WA ------ (9.28)

சமன்பாடு (9.28) ஐ பயன்படுத்தி மோலார் நிறையைக் கண்டறிய முடியும்.
MB = Kb × WB × 1000 / ΔTb × WA ------ (9.29)

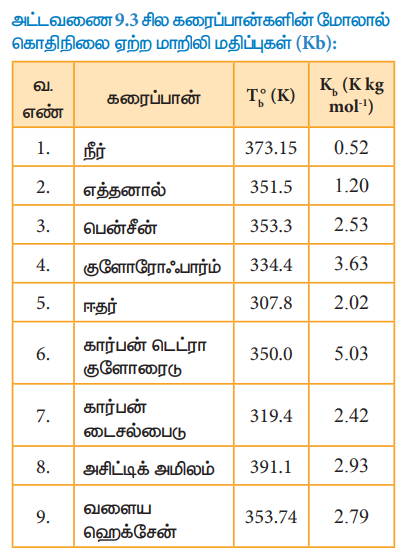
அட்டவணை 9.3 சில கரைப்பான்களின் மோலால் கொதிநிலை ஏற்ற மாறிலி மதிப்புகள் (Kb):
கணக்கு- 4
0.75 கிராம் எடையுடைய பெயர் தெரியாத சேர்மமானது 200 கிராம் கரைப்பானில் கரைக்கப்படுகிறது. கொதிநிலை ஏற்ற மதிப்பு 0.15 K மற்றும் மோலால் கொதிநிலை ஏற்ற மாறிலி மதிப்பு 7.5 K Kg mol-1 எனில், அச்சேர்மத்தின் மோலார் நிறையை கணக்கிடுக.
ΔTb = Kb m
= Kb × W2 × 1000 / M2 × W1
M2 = Kb × W2 × 1000 / ΔTb × W1
= 7.5 × 0.75 × 1000 / 0.15 × 200
= 187.5 g mol-1
தன் மதிப்பீடு
11) 100 கிராம் கார்பன் டை சல்பைடில் 2.56 கிராம் சல்பர் கரைக்கப்பட்டுள்ளது. இந்த கரைசல் 319. 692 K இல் கொதிக்கிறது. கரைசலில் சல்பரின் மோலார் நிறை என்ன? CS2 இன் கொதிநிலை 319. 450K. CS2 இன் Kb மதிப்பு 2.42 K Kg mol-1 என கொடுக்கப்பட்டுள்ளது.
தீர்வு:
W2 = 2.56 g T = 319.692 K
W1 = 100 g = 100/1000 Kg ∆Tb = (319.692 – 319.450) K = 0.242 K
K b = 2.42 K Kg mol-1
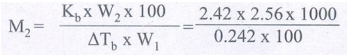
M2 = 256 g mol-1
கரைசலில் சல்பரின் மூலக்கூறு நிறை = 256g mol-1
ஒரு மோல் சல்பர் அணுவின் நிறை = 32
ஒரு மூலக்கூறு சல்பரில் உள்ள அணுக்களின் எண்ணிக்கை = 256/32 = 8
எனவே சல்பரின் மூலக்கூறு வாய்ப்பாடு = S8.
உறைநிலைத் தாழ்வு
கொதிநிலையைப் போலவே, ஒரு பொருளின் உறைநிலையானது, அதன் மற்றொரு முக்கியமான இயற் பண்பாகும். வளிமண்டல அழுத்தத்தில் (1 atm-ல்) எந்த ஒரு வெப்பநிலையில், ஒரு பொருளின் திட மற்றும் திரவ நிலைமைகள் ஆகிய இரண்டும் சமமான ஆவி அழுத்தத்தை பெற்றுள்ளனவோ அவ்வெப்பநிலை உறைநிலை என வரையறுக்கப்படுகிறது. உறைநிலையில், ஒரு வொருளின், திட மற்றும் திரவ நிலைகள் சமநிலையில் உள்ளன. எடுத்துக்காட்டாக, நீரின் உறைநிலை 0oC. இந்த வெப்பநிலையில், பனிக்கட்டியும் நீரும் சமநிலையில் உள்ளன. எளிதில் ஆவியாகாத கரைபொருளை நீருடன் அதன் உறைநிலையில் சேர்க்கும்போது, கரைசலின் உறைநிலையானது 0°C க்கும் கீழே குறைகிறது. கரைபொருளை சேர்க்கும்போது கரைப்பானின் உறைநிலை குறைவது, உறைநிலைத் தாழ்வு (ΔTf) என்றழைக்கப்படுகிறது.
0°C-யில் நீரின் ஆவிஅழுத்தம் 1atm ஆக உள்ளதால் அதன் உறைநிலை (Tof)ன் மதிப்பு 0°C என அறிகிறோம். மேலும், படம் 9.11-யில் இருந்து நீருடன் கரைப் பொருளைச் சேர்க்கும் பொழுது கரைசலின் ஆவிஅழுத்தம் குறைகிறது (ஊதா நிற வரைக்கோடு) எனவும், 1 atm அழுத்ததில் கரைசலின் உறைநிலை 0oC ஐ விட குறைவான (Tf) மதிப்பினை அதாவது உறைநிலை தாழ்வு ஏற்ப்பட்டுள்ளது என்பதனையும் அறியலாம். இந்த உறைநிலைத்தாழ்வை (ΔTf) கீழ்காணுமாறு எழுத முடியும்.
ΔTf = Tof - Tf
சோதனை மதிப்புகளிலிருந்து உறைநிலைத் தாழ்வானது, கரைபொருள் துகள்களின் மோலார் செறிவுக்கு நேர்விகிதத்திலிருக்கும் என அறிய முடிகிறது.
எனவே
ΔTf αm
ΔTf = Kf m -------- (9.30)
இங்கு ‘m’ = கரைசலின் மோலாலிட்டி
Kf என்பது மோலால் உறைநிலைத் தாழ்வு மாறிலியாகும்.
m = 1 எனில் ΔTf = Kf
“Kf ஒரு மோலால் கரைசலின் உறைநிலை தாழ்விற்கு சமம்”.
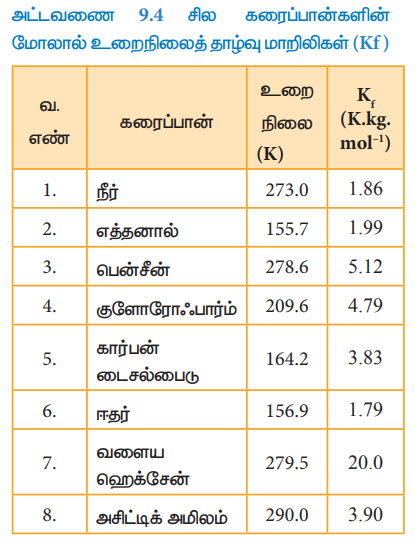
அட்டவணை 9.4 சில கரைப்பான்களின் மோலால் உறைநிலைத் தாழ்வு மாறிலிகள் (Kf)
உறைநிலைத் தாழ்விலிருந்து, கரைபொருளின் மோலார் நிறையை கணக்கிடல்
ΔTf = Kf × WB × 1000 / MB × WA -------- (9.31)
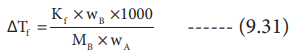
சமன்பாடு (9.31) ஐ பயன்படுத்தி மோலார் நிறையை கண்டறிய முடியும்.
MB = Kf × WB × 1000 / ΔTf × WA
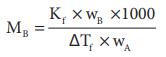
கணக்கு – 5
குளிர்பிரதேசங்களில் பயணிக்கும் கார்களின் ரேடியேட்டர்களில், உறைதடுப்பானாக எத்திலீன் கிளைக்காலை (C2H6O2) பயன்படுத்த முடியும். ஒரு கார் ரேடியேட்டரில், பயன்படுத்தப்பட்டுள்ள, 20 நிறை சதவீத கிளைக்காலின் நீர்க் கரைசலிலிருந்து பனிக்கட்டி படிகங்கள் உருவாகிபிரியும்போது உள்ள வெப்பநிலையை கணக்கிடுக. நீரின் Kf மதிப்பு 1.86 K Kg mol-1 மற்றும் எத்திலீன் கிளைக்காலின் மோலார் நிறை 62 g mol-1
கரைசலின் 20 நிறை சதவீதம் என்பதற்க்கு 20 கிராம் எத்திலீன் கிளைக்கால் 100 கிராம் கரைசலில் உள்ளது எனப்பொருள்.
கரைபொருளின் எடை (W2) = 20கி
கரைப்பானின் எடை (நீர்) W1 = 100 - 20 = 80கி
ΔTf = Kf m
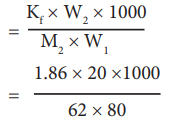
= 7.5 K
எந்த வெப்பநிலையில், பனிக்கட்டி படிகங்கள் உருவாகி பிரிகின்றனவோ அதுவே, கரைபொருளை சேர்த்த பின்னர் நீரின் உறைநிலை ஆகும். அதாவது, சாதாரண உறைநிலையை விட 7.5 K குறைவு. (273-7.5K) = 265.5 K
தன் மதிப்பீடு
12) 2 கிராம் மின்பகுளி அல்லாத கரைபொருளை 75 கிராம் பென்சீனில் கரைக்கும்போது, பென்சீனின் உறைநிலையானது 0.20 K குறைகிறது. பென்சீனின் உறைநிலைத் தாழ்வு மாறிலி 5.12K Kg mol-1. கரைபொருளின் மோலார் நிறையைக் காண்க.
தீர்வு:
W2 = 2g W1 = 75 g = 75/1000 Kg
∆Tf = 0.2 K Kf = 5.12 K Kg mol-1
M2 = ?
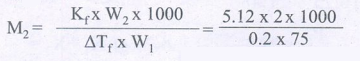
= 682.66 g mol-1
சவ்வூடு பரவல் மற்றும் சவ்வூடுபரவல் அழுத்தம்
பல்வேறு உயிரியல் செயல்முறைகள் சவ்வூடுபரவலைச் சார்ந்துள்ளன. சவ்வூடு பரவல் என்பது ஒரு கூறு புகவிடும் சவ்வின் வழியாக, செறிவு குறைந்த கரைசலிலிருந்து, செறிவு மிகுந்த கரைசலுக்கு கரைப்பான் மூலக்கூறுகள் விரவிச் செல்லும் தன்னிச்சையான நிகழ்வு ஆகும். சவ்வூடு பரவல் எனும் சொல் கிரேக்க மொழியில் ‘osmos’ என்ற சொல்லிலிருந்து வருவிக்கப்பட்டதாகும். இதன் பொருள் "தள்ளு (to push)" என்பதாகும். மேலும் ஒருகூறு புகவிடும் சவ்வானது கரைசலிலுள்ள அனைத்து மூலக்கூறுகளையும் தன் வழியே புகுந்து செல்ல அனுமதிப்பதில்லை. மாறாக சில மூலக்கூறுகளை மட்டும் அனுமதித்து, தேர்ந்தெடுத்து செயலாற்றும் பண்புடையது என்பதனை அறிந்து கொள்ளுதல் முக்கியமானதாகும்.
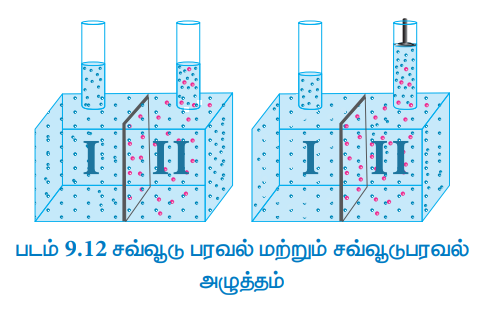
மேற்கண்டுள்ள படம் 9.12 ல் காட்டப்பட்டுள்ளவாறு எளிய சோதனை அமைப்பைக் கருதுவோம். ஒருகூறு புகவிடும் கலனானது இரு பகுதிகளாக பிரிக்கப்படுகிறது. இருபுறமும் உள்ள நீர்மட்டங்கள் சமமாக இருக்கும் வகையில், ஒரு பகுதியில் கரைப்பானும் (நீர்) மறு பகுதியில் நீர்த்த NaCl கரைசலும் எடுத்துக்கொள்ளப்படுகிறது. இரண்டு பகுதிகளிலும் உள்ள திரவங்களுக்கிடையே செறிவு வேறுபாடு இருப்பதினால், நீர் மூலக்கூறுகள், ஒருகூறு புகவிடும் சவ்வின் வழியாக, முதல் பகுதியிலிருந்து இரண்டாம் பகுதிக்கு விரவிச் செல்கிறது. ஒருகூறுபுகவிடும் சவ்வானது, நீர் மூலக்கூறுகளை இருபுறமும் புகந்து செல்ல அனுமதிக்கின்றது. ஆனால் NaCl ஐ அதன் வழியே செல்ல அனுமதிப்பதில்லை. சோடியம் குளோரைடு கரைசலினுள் நீர் புகுவதால் அதன் கனஅளவு அதிகரிக்கிறது. இதனால் கரைசலின் செறிவு குறைகிறது, மேலும் இரண்டு பகுதிகளுக்கிடையே அழுத்த வேறுபாடு உருவாகிறது. இந்த அழுத்த வேறுபாடானது, சமநிலை உருவாகும்வரை சில நீர் மூலக்கூறுகளை மீண்டும் ஒருகூறு புகவிடும் சவ்வின் வழியாக, கரைப்பான் பகுதிக்கு தள்ளுகிறது. சமநிலையில், இரண்டு திசைகளிலும், கரைப்பான் மூலக்கூறுகளின் இயக்க வேகம் சமம். சமநிலையில் உள்ள இந்த வேறுபாடானது சவ்வூடு பரவல் அழுத்தம் (π) என்றழைக்கப்படுகிறது. அதாவது, சவ்வூடு பரவல் அழுத்தத்தை “ஒருகூறுபுகவிடும் சவ்வின் வழியே, கரைப்பான் புகுதலை தடுப்பதற்காக, (சவ்வூடுபரவலை தடுக்க) கரைசலின் மீது செலுத்தப்படவேண்டிய அழுத்தம்" என வரையறுக்கலாம்.
வாண்ட் ஹாஃப் எனும் அறிவியலாளர், நீர்த்த கரைசல்களுக்கு, சவ்வூடு பரவல் அழுத்தமானது. கரைபொருளின் மோலார் செறிவு மற்றும் கரைசலின் வெப்பநிலை ஆகியவற்றிற்கு நேர்விகிதத்திலிருக்கும் என்பதை கண்டறிந்தார். சவ்வூடுபரவல் அழுத்தத்தை கணக்கிடுவதற்காக அவர் பின்வரும் சமன்பாட்டை முன்மொழிந்தார். தற்போது அது, வாண்ட் ஹாஃப் சமன்பாடு என்றழைக்கப்படுகிறது.
π = CRT ----- (9.32)
இங்கு
C = கரைசலின் மோலார் செறிவு
T = வெப்பநிலை
R = வாயு மாறிலி
சவ்வூடு பரவல் அழுத்தத்திலிருந்து மோலார் நிறையை கணக்கிடல்.
வாண்ட் ஹாஃப் சமன்பாட்டின்படி
π = CRT
C = n/V
இங்கு n என்பது 'V' லிட்டர் கரைசலில் கரைக்கப்பட்டுள்ள மோல்களின் எண்ணிக்கை.
எனவே, π = (n/v) RT or
π V = nRT ------- (9.33)
WA கிராம் கரைப்பானில், WB கிராம் எளிதில் ஆவியாகாத கரைபொருளை கரைத்து, கரைசல் தயாரிக்கப்பட்டால், கரைபொருளின் மோல் எண்ணிக்கை (n) என்பது
n = WB / MB
இங்கு, MB = கரைபொருளின் மோலார் நிறை
இந்த 'n' மதிப்பை சமன்பாடு (9.33) ல் பிரதியிட, நமக்கு கிடைப்பது
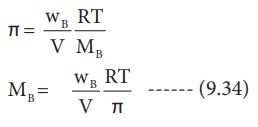
சமன்பாடு (9.34) ஐ பயன்படுத்தி, கரைபொருளின் மோலார் நிறையை கணக்கிட முடியும்.
பிற தொகைசார் பண்புகளைக் காட்டிலும் சவ்வூடுபரவல் அழுத்தத்தின் முக்கியத்துவம்.
1. கொதிநிலை ஏற்றம் (1 மோலால் கரைசலுக்கு நீரின் கொதிநிலை ஏற்ற மதிப்பு 0.512°C) மற்றும் உறைநிலைத் தாழ்வு (1 மோலால் கரைசலுக்கு நீரின் உறைநிலை தாழ்வு மதிப்பு 1.86 °C), ஆகியவற்றைப் போன்று இல்லாமல், சவ்வூடு பரவல் அழுத்தம் அதிக எண்மதிப்பினைக் கொண்டுள்ளது.
2. நீர்த்த கரைசல்களுக்குக் கூட, சவ்வூடு பரவல் அழுத்த மதிப்பின் அளவு அதிகமாக உள்ளது.
3. சவ்வூடு பரவல் அழுத்தத்தை, அறை வெப்பநிலையிலேயே அளவிட முடியும் என்பதால், உயர் வெப்பநிலைகளில் நிலைப்புத்தன்மையற்ற உயரி-மூலக்கூறுகளின் மூலக்கூறு எடையை இதனைப் பயன்படுத்தி தீர்மானிக்க இயலும்.
ஐசோடானிக் கரைசல்கள்
கொடுக்கப்பட்ட வெப்பநிலையில், ஒத்த சவ்வூடுபரவல் அழுத்தங்களைக் கொண்ட கரைசல்கள், ஐசோடானிக் கரைசல்கள் என்றழைக்கப்படுகின்றன. இத்தகைய கரைசல்களை ஒருகூறு புகவிடும் சவ்வைக் கொண்டு பிரித்துவைக்கும்போது, ஒன்றிலிருந்து மற்றொன்றிற்கான, கரைப்பான் நகர்வு இரண்டு திசைகளிலும் சமமாக இருக்கும். அதாவது, இரண்டு ஐசோடானிக் கரைசல்களுக்கிடையே, நிகர கரைப்பான் நகர்வானது பூஜ்ஜியம் ஆகும்.
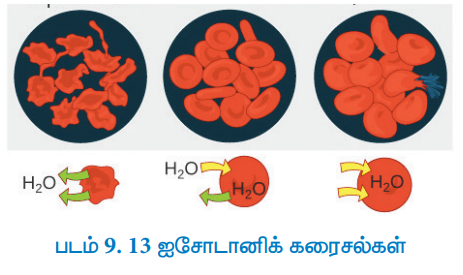
37 °C வெப்பநிலையில், இரத்த செல்களின் சவ்வூடுபரவல் அழுத்தம் தோராயமாக 7 atm ஆகும். நரம்பு (சிரை) வழியாக செலுத்தப்படும் மருந்துகள், இரத்தத்தின் சவ்வூடுபரவல் அழுத்தத்திற்கு சமமான மதிப்புகளை கண்டிப்பாக கொண்டிருக்க வேண்டும் (இரத்தத்துடன் ஐசோடானிக்). நரம்பு (சிரை) வழியாக செலுத்தப்படும் கரைசல்கள் மிக நீர்த்த, அதாவது ஹைப்போடானிக் கரைசல்களாக இருந்தால், சவ்வூடுபரவல் அழுத்தத்தை சீராக்குவதற்காக செல்களுக்கு வெளியே உள்ள கரைப்பான் ஆனது செல்களுக்குள் நுழையும் இந்நிகழ்வு" இரத்த சிதைவு (hemolysis)" என்றழைக்கப்படுகிறது, இதனால் இரத்த செல்கள் வெடிக்கின்றன. மாறாக, சிரைவழி செலுத்தும் கரைசல்கள் செறிவு மிகுந்த, அதாவது ஹைட்பர்டானிக் கரைசல்களாக இருந்தால், கரைப்பான் ஆனது செல்லுக்கு உள்ளிருந்து வெளியே பாய்கிறது, இது செல்களை சுருங்கச் செய்கிறது, மேலும் செல்கள் அழிந்து விடுகின்றன. இதன் காரணமாக, சிரைவழி செலுத்து திரவங்களானவை, இரத்தத்துடன் ஐசோடானிக்காக இருக்கும் வகையில் தயாரிக்கப்படுகின்றன. (உ-ம் 0.9 % நிறை / கனஅளவு உள்ள சோடியம் குளோரைடு கரைசல்).