பல்வேறு வினாக்களுக்கான கேள்வி பதில்கள் - சரியான விடையினைத் தேர்வு செய்க | 11th Chemistry : UNIT 9 : Solutions
11 வது வேதியியல் : அலகு 9 : கரைசல்கள்
சரியான விடையினைத் தேர்வு செய்க
மதிப்பீடு
சரியான விடையினைத் தேர்வு செய்க
1. 250 கிராம் நீரில் 1.8 கிராம் குளுக்கோஸ் கரைக்கப்பட்டுள்ள கரைசலின் மோலாலிட்டி
அ) 0.2 M
ஆ) 0.01 M
இ) 0.02 M
ஈ) 0.04 M
[விடை : ஈ) 0.04 M]
தீர்வு:
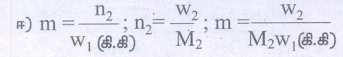
W2 = 1.8 .கி W1 = 250 கி = 0.250 கி.கி
M2 = 180 கி மோல்-1
ஃ m = 1.8 / 180 × 0.250 = 0.04m
2. பின்வரும் செறிவு அலகுகளில், வெப்பநிலையை சார்ந்து அமையாதவை எவை?
அ) மோலாலிட்டி
ஆ) மோலாரிட்டி
இ) மோல் பின்னம்
ஈ) (அ) மற்றும் (இ)
[விடை : ஈ) (அ) மற்றும் (இ)]
தீர்வு:
ஈ) வெப்பநிலையை பொறுத்து கனஅளவு மாறுவதால், மோலாரிட்டி வெப்பநிலையை சார்ந்து அமைகிறது; M = n/v
3. வயிற்றில் சுரக்கும், நீர்த்த HCl அமிலத்தை அலுமினியம் ஹைட்ராக்சைடு கொண்டு நடுநிலையாக்க முடியும்
Al (OH)3 + 3HCl (aq) → AlCl3 + 3 H2O
21 mL கனஅளவுடைய 0.1M HCl ஐ நடு நிலையாக்குவதற்கு தேவைப்படும், 0.1 M Al(OH) 3 கரைசலின் கனஅளவு
அ) 14 mL
ஆ) 7 mL
இ) 21 mL
ஈ) இவற்றில் எதுவுமில்லை
[விடை : ஆ) 7 mL]
தீர்வு:
ஈ) N = M × காரத்துவம்;
N = M × அமிலத்துவம்;
0.1 M HCl = 0.1 × 1 = 0.1 N HCl = N1
0.1 M Al (OH)3 = 0.1 × 3
= 0.3 NAl (OH)3 = N2
HCl கனஅளவு V1 = 21 mL;
Al(OH)3 கனஅளவு V2
V1N1 = V2N2 ; V2 = V1N1 / N2 = 21× 0.1 / 0.3 = 7mL
4. காற்றில் உள்ள நைட்ரஜனின் பகுதி அழுத்தம் 0.76 atm மற்றும் 300K வெப்பநிலையில் அதன் ஹென்றி விதி மாறிலி மதிப்பு 7.6 × 104 atm. 300 K வெப்பநிலையில், காற்றை நீரின் வழியாக குமிழிகளாக செலுத்தும்போது, கிடைக்கும் கரைசலில், நைட்ரஜன் வாயுவின் மோல் பின்ன மதிப்பு என்ன?
அ) 1 × 10-4
ஆ) 1 × 10-6
இ) 2 × 10-5
ஈ) 1 × 10-5
[விடை : ஈ) 1 × 10-5]
தீர்வு:
ஈ) PN2 = 0.76 atm ; KH = 7.6 × 104 × ?
P N2 = KH . X ; x = Pn2 / KH = 0.76 / 7.6 × 104
x = 1 × 10-5
5. 350 K வெப்பநிலையில் நீரில், நைட்ரஜன் வாயுவின் கரைதிறனுக்கு ஹென்றி விதி மாறிலி மதிப்பு 8 × 104 atm. காற்றில் நைட்ரஜனின் மோல் பின்னம் 0.5 ஆகும். 350K வெப்பநிலை மற்றும் 4 atm அழுத்தத்தில் 10 மோல்கள் நீரில் கரையும் காற்றிலுள்ள நைட்ரஜனின் மோல் எண்ணிக்கை
அ) 4 × 10-4
ஆ) 4 × 104
இ) 2 × 10-2
ஈ) 2.5 × 10-4
[விடை : ஈ) 2.5 × 10-4]
தீர்வு:
ஈ) KH = 8 × 104 ; (Xn2) காற்றில் = 0.5
மொத்த அழுத்தம் = 4 atm
நைட்ரஜனின் பகுதி அழுத்தம் = மோல் பின்னம் × மொத்த அழுத்தம் = 0.5 × 4 = 2
(Pn2) = KH × கரைசலில் N2 ன் மோல் பின்னம்

6. நல்லியல்புக் கரைசலுக்கு பின்வருவனவற்றுள் எந்த ஒன்று தவறானது
அ) ∆Hகலத்தல் = 0
ஆ) ∆Uகலத்தல் = 0
இ) ∆P = P கண்டறியப்பட்டது – P ரௌல்ட் விதி மூலம் கணக்கிடப்பட்டது = 0
ஈ) ∆Gகலத்தல் = 0
[விடை : ஈ) ∆Gகலத்தல் = 0]
தீர்வு:
ஈ) நல்லியல்பு கரைசலுக்கு,
∆Sகலத்தல் ≠ 0; எனவே ∆Gகலத்தல் ≠ 0
ஃ தவறானது ∆Gகலத்தல் = 0
7. பின்வருவனவற்றுள் எந்த ஒரு வாயுவானது மிகக்குறைந்த ஹென்றி விதி மாறிலி மதிப்பைப் பெற்றுள்ளது?
அ) N2
ஆ) He
இ) CO2
ஈ) H2
[விடை : இ) CO2]
தீர்வு:
இ) கார்பன் டை ஆக்ஸைடு, அதிக அளவு நிலைப்புத் தன்மையுடைய வாயு மேலும் குறைவான ஹென்றி விதி மாறிலியை உடையது.
8. ஒரு இருகூறு நல்லியல்புக் கரைசலில், தூய திரவக் கூறுகள் 1 மற்றும் 2 இன் ஆவிஅழுத்தங்கள் முறையே P1 மற்றும் P2 ஆகும். x1 என்பது கூறு 1 இன் மோல் பின்னம் எனில், கூறுகள் 1 மற்றும் 2 ஆகியவற்றால் உருவாக்கப்பட்ட கரைசலின் மொத்த அழுத்தம்
அ) P1 + x1 (P2 – P1)
ஆ) P2 – x1 (P2 + P1)
இ) P1 - x2 (P1 - P2)
ஈ) P1 + x2 (P1- P2)
[விடை : இ) P1 - x2 (P1 - P2)]
தீர்வு:
X1 + X2 = 1
X1 = 1 – X2
இ) Pமொத்தம் = P1 + P2
= P1 X1 + P2X 2
= P1 (1 - X 2) + P2X 2
= P1 – P1X 2 + P2X 2
= P1 – X2 (P1 – P2 )
9. கரைசலின் சவ்வூடு பரவல் அழுத்தத்தை (π) தரும் சமன்பாடு
அ) π = nRT
ஆ) π V = nRT
இ) π RT = n
ஈ) இவற்றில் ஏதுமில்லை
[விடை : ஆ) π V = nRT]
தீர்வு:
ஆ) π = CRT
π = n / V RT; πV = nRT
10. பின்வரும் இருகூறு திரவ கலவைகளில் எது, ரௌல்ட் விதியிலிருந்து நேர்குறி விலக்கத்தை காட்டுகிறது?
அ) அசிட்டோன் + குளோரோஃபார்ம்
ஆ) நீர் + நைட்ரிக் அமிலம்
இ) HCl + நீர்
ஈ) எத்தனால் + நீர்
[விடை : ஈ) எத்தனால் + நீர்]
11. A மற்றும் B எனும் இரண்டு வாயுக்களின் ஹென்றி விதி மாறிலி மதிப்புகள் முறையே x மற்றும் y. A உடனான B யின் மோல் பின்ன விகிதம் 0.2. நீரில் கரையும் B மற்றும் A யின் மோல் பின்ன விகிதம்
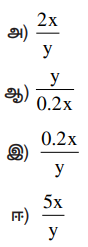
[விடை : ஈ) 5x/y]
தீர்வு:
ஈ) கொடுக்கப்பட்டவை, (KH)A = x (KH)B = y

12. 100°C வெப்பநிலையில், 100 கிராம் நீரில், 6.5 கிராம் கரைபொருள் கரைந்துள்ள கரைசலின் ஆவி அழுத்தம் 732mm Kb = 0.52, எனில், அந்த கரைசலின் கொதிநிலை மதிப்பு
அ) 102°C
ஆ) 100°C
இ) 101°C
ஈ) 100.52°C
[விடை : இ) 101°C]
தீர்வு:

Tb – 100 = 1.06
Tb = 100 + 1.06
= 101.06 ≈ 101oC
13. ரௌல்ட் விதிப்படி, ஒரு கரைசலின் ஒப்பு ஆவிஅழுத்தக்குறைவானது. ------ க்கு சமம்
அ) கரைப்பானின் மோல் பின்னம்
ஆ) கரைபொருளின் மோல் பின்னம்
இ) கரைபொருளின் மோல் எண்ணிக்கை
ஈ) கரைப்பானின் மோல் எண்ணிக்கை
[விடை : ஆ) கரைபொருளின் மோல் பின்னம்]
தீர்வு:
ஆ) Po – P / Po = x2
14. ஒரே வெப்பநிலையில், பின்வரும் கரைசல்களுள் எந்த இணை ஐசோடானிக் இணையாகும்?
அ) 0.2 M BaCl2 மற்றும் 0.2M யூரியா
ஆ) 0.1 M குளுக்கோஸ் மற்றும் 0.2 M யூரியா
இ) 0.1 M NaCl மற்றும் 0.1 M K2SO4
ஈ) 0.1 M Ba (NO3) 2 மற்றும் 0.1 M Na2 SO4
[விடை : ஈ) 0.1 M Ba (NO3) 2 மற்றும் 0.1 M Na2 SO4]
தீர்வு:
Ba(NO3)2 , Na2 SO4 ன்
செறிவு = 0.1 M
Ba(NO3)2 → Ba2+ + 2NO-3 ⇒ அயனிகள்
Na2 SO4 → 2Na+ + SO2-4 ⇒ அயனிகள்
செறிவு மற்றும் அயனிகளின் எண்ணிக்கையை சமமாக பெற்றுள்ள கரைசல்களின் சவ்வூடு பரவல் அழுத்தம் சமமாகும்.
சம சவ்வூடு பரவல் அழுத்தத்தை பெற்றுள்ள கரைசல்கள் ஐசோடோனிக் கரைசல்களாகும்.
15. ஒரு மின்பகுளியில்லா சேர்மம் (X) இன் எளிய விகித வாய்ப்பாடு CH2O. 0.025M குளுக்கோஸ் கரைசல் பெற்றுள்ள சவ்வூடு பரவல் அழுத்தத்தை, அதே வெப்பநிலையில் 6 கிராம் X ஐ கொண்டுள்ள கரைசலும் பெற்றுள்ளது. X ன் மூலக்கூறு வாய்ப்பாடு
அ) C2H4O2
ஆ) C8H16O8
இ) C4H8O4
ஈ) CH2O
[விடை : ஆ) C8H16O8]
தீர்வு:
ஆ) 1 = மின்பகுளியல்லா சேர்மம்
2 = குளுக்கோஸ்
π1 = π2
C1 RT = C2 RT
C1 = C2
n1/V = n2/V
n1 = n2
W1 / M1 = W2 / M2
மூலக்கூறு நிறை
= n எளிய விகித வாய்ப்பாடு நிறை
W1 = 6 கி
M1 = n × 30; CH2O 12 + 2 + 16 = 30
n2 = 0.025
ஃ 6/n × 30 = 0.025
ஃ n = 6 / 0.025 × 30 = 8
மூலக்கூறு வாய்ப்பாடு = n × எளிய விகித வாய்ப்பாடு
= 8 × (CH2O) = C8H16O8
16. கொடுக்கப்பட்ட வெப்பநிலையில், நீரில் ஆக்ஸிஜன் கரைந்த கரைசலின் KH மதிப்பு 4×104 atm. காற்றில் ஆக்ஸிஜனின் பகுதி அழுத்தம் 0.4 atm, எனில், கரைசலில் ஆக்ஸிஜனின் மோல் பின்னம்
அ) 4.6 × 103
ஆ) 1.6 × 104
இ) 1 × 10-5
ஈ) 1 × 105
[விடை : இ) 1 × 10-5]
17. 1.25M கந்தக அமிலத்தின் நார்மாலிட்டி
அ) 1.25 N
ஆ) 3.75 N
இ) 2.5 N
ஈ) 2.25 N
[விடை : இ) 2.5 N]
தீர்வு:
N = M × காரத்துவம்
N = 1.25 × 2 = 2.5N
காரத்துவம் = ஒரு மூலக்கூறு அமிலத்திலிருந்து இடம் பெயரும் H+ அயனிகள்.
18. இரண்டு திரவங்கள் X மற்றும் Y ஆகியன கலக்கப்படும்போது வெதுவெதுப்பான கரைசலைத் தருகின்றன. அந்தக் கரைசலானது
அ) நல்லியல்புக் கரைசல்
ஆ) நல்லியல்புக் கரைசல் மற்றும் ரௌல்ட் விதியிலிருந்து நேர்க்குறி விலக்கத்தை காட்டுகிறது.
இ) நல்லியல்புக் கரைசல் மற்றும் ரௌல்ட் விதியிலிருந்து எதிர்குறி விலக்கத்தை காட்டுகிறது.
ஈ) இயல்புக் கரைசல் மற்றும் ரௌல்ட் விதியிலிருந்து எதிர்குறி விலக்கத்தை காட்டுகிறது.
[விடை : ஈ) இயல்புக் கரைசல் மற்றும் ரௌல்ட் விதியிலிருந்து எதிர்குறி விலக்கத்தை காட்டுகிறது.]
தீர்வு:
ΔHகலவை எதிர்க்குரியுடையது மேலும் ரௌல்ட் விதியிலிருந்து விலகல் அடைகிறது.
19. நீரில் சர்க்கரைக் கரைசலின் ஒப்பு ஆவி அழுத்தக்குறைவு 3.5 × 10-3. அந்த கரைசலில் நீரின் மோல் பின்னம்
அ) 0.0035
ஆ) 0.35
இ) 0.0035/18
ஈ) 0.9965
[விடை : ஈ) 0.9965]
தீர்வு:
ஈ) ΔP / Po = Xசர்க்கரை
3.5 × 10-3 = Xசர்க்கரை
Xசர்க்கரை + XH2O = 1
ஃ XH2O = 1 – 0.0035 = 0.9965
20. 92 கிராம் டொலுயீனின், ஆவிஅழுத்தத்தை 90% க்கு குறைப்பதற்கு, அதில் கரைக்கத் தேவையான எளிதில் ஆவியாகாத கரைபொருளின் நிறை (மோலார் நிறை 80 g mol-1)
அ) 10g
ஆ) 20g
இ) 9.2 g
ஈ) 8.89g
[விடை : ஈ) 8.89g]
தீர்வு:
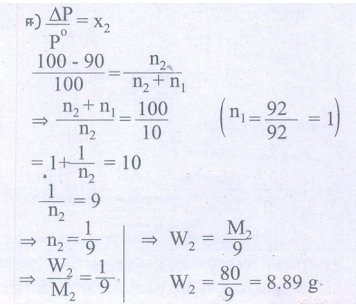
21. ஒரு கரைசலின், செறிவிற்கு (செறிவு அலகு mol L-1) எதிரான சவ்வூடு பரவல் அழுத்தம் (π) வரைபடம் நேர்க்கோட்டை தருகிறது. இதன் சாய்வு 310R. இங்கு 'R' என்பது வாயு மாறிலி. சவ்வூடுபரவல் அழுத்தம் அளவிடப்பட்ட வெப்பநிலையின் மதிப்பு
அ) 310 × 0.082 K
ஆ) 310°C
இ) 37°C
ஈ) (310 / 0.082) K
[விடை : இ) 37°C]
தீர்வு:
இ) π = CRT
y = x(m)
m = RT
310 R = RT
ஃ T = 310 K = 37oC
22. 200 mL புரதநீர்க் கரைசலானது, 1.26g புரதத்தை கொண்டுள்ளது. 300K வெப்பநிலையில், இந்த கரைசலின் சவ்வூடுபரவல் அழுத்த மதிப்பு 2.52 × 10-3 bar என கண்டறியப்பட்டுள்ளது. புரதத்தின் மோலார் நிறை (R = 0.083 L bar mol-1K-1)
அ) 62.22 Kg mol-1
ஆ) 12444g mol-1
இ) 300g mol-1
ஈ) இவற்றில் ஏதுமில்லை
[விடை : அ) 62.22 Kg mol-1 ]
தீர்வு:
அ) π = CRT
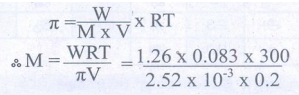
= 62250 g mol-1 = 62.22 Kg mol-1
23. வலிமைமிகு மின்பகுளியான பேரியம் ஹைட்ராக்சைடின் நீர்த்த நீர்க்கரைசலுக்கு வாண்ட் ஹாஃப் காரணி (i) மதிப்பு (NEET)
அ) 0
ஆ) 1
இ) 2
ஈ) 3
[விடை : ஈ) 3]
தீர்வு:
ஈ) Ba(OH)2 → Ba2+ + 2OH-
n = 3 அயனிகள்
α ≈ l Ba (OH)2 வலிமை மிகு மின்பகுளி
α = (I – l) / n – l
i = α (n – 1) + 1 = 1 (3 – l) + l = 1 (2) + l = 3
24. 10% w/w செறிவுடைய சோடியம் ஹைட்ராக்சைடு நீர்க்கரைசலின் மோலாலிட்டி என்ன?
அ) 2.778
ஆ) 2.5
இ) 10
ஈ) 0.4
[விடை : ஆ) 2.5]
தீர்வு:
ஆ) 10% W/W என்பது 100g கரைசலில் 10g சோடியம் ஹைட்ராக்சைடு உள்ளதைக் குறிக்கிறது.
M2 (NaOH) = 40g mol-1
w2 = 10g ; w1 = 100 g = 0.1 Kg;
m = n2/w1 = n2/ M2W1(கி.கி) = 10/ 40 × 0.1 = 2.5m
25. கரைசலில் n கரைப்பான் மூலக்கூறுகள் ஒன்றிணையும்போது, இணைதல் வீதத்திற்கான சரியான சமன்பாடு
அ) α = n(i-1)/n-1
ஆ) α2 = n(l-i)/(n-1)
இ) α = n(i-1)/l-n
ஈ) α = n(l-i)/n(l-i)
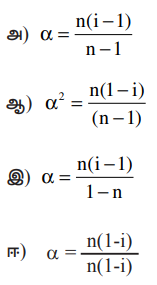
[விடை : இ) α = n(i-1)/l-n]
26. பின்வருவனவற்றுள் எந்த நீர்க்கரைசல், அதிக கொதிநிலையைக் கொண்டுள்ளது?
அ) 0.1 M KNO3
ஆ) 0.1 M Na3 PO4
இ) 0.1 M BaCl2
ஈ) 0.1 M K2SO4
[விடை : ஆ) 0.1 M Na3 PO4]
தீர்வு:
Na3PO4 → 3Na+ + PO43-
n = 4 அயனிகள்.
ஒரே செறிவினை கொண்ட வெவ்வேறு கரைசல்களில் அயனிகளின் எண்ணிக்கை அதிகம் உள்ள கரைசலின் கொதிநிலை ஏற்றம் அதிகம். எனவே அதன் கொதிநிலையும் அதிகம்.
27. நீரின் உறைநிலைத் தாழ்வு மாறிலி மதிப்பு 1.86 K Kgmol-1 . 45 கிராம் நீரில், 5g Na2SO4 ஐ கரைக்கும்போது, உறைநிலையில் ஏற்படும் தாழ்வு 3.64oC. Na2SO4 இன் வாண்ட் ஹாஃப் காரணி மதிப்பு
அ) 2.5
ஆ) 2.63
இ) 3.64
ஈ) 5.50
[விடை : அ) 2.5]
தீர்வு:
அ) Kf = 1.86 ; W2 = 5g ; W1 = 45g = 0.045 Kg
ΔTf = 3.64 ; M2 = 142
ΔTf = i Kf M ;
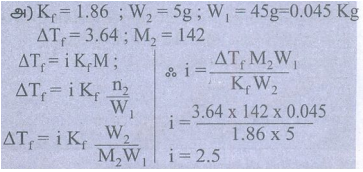
i = 2.5
28. சமமோலார் NaCl மற்றும் KCl கரைசல்கள் தயாரிக்கப்பட்டன. NaCl கரைசலின் உறைநிலை −2°C,எனில் KCl கரைசலின் எதிர்பார்க்கப்படும் உறைநிலை மதிப்பு
அ) −2°C
ஆ) -4°C
இ) - 1°C
ஈ) 0°C
[விடை : அ) −2°C]
தீர்வு:
அ) செறிவும், அயனிகளின் எண்ணிக்கையும் சமமாக உள்ள கரைசல்களின் உறைநிலை தாழ்வும் சமம். எனவே அவற்றின் நீர்கரைசல்களின் உறை நிலையும் சமம்.
29. வாண்ட் ஹாஃப் காரணி மதிப்பு 0.54 கொண்ட பென்சீனில், பீனால் மூலக்கூறுகள் இரட்டையாகின்றன. இணைதல் வீதம் என்ன?
அ) 0.46
ஆ) 92
இ) 46
ஈ) 0.92
[விடை : ஈ) 0.92]
தீர்வு:
ஈ) i = 0.54 ; n = 2 ; α = ?
α = (l – i)n / (n – 1) = (1 – 0.54)2 / (2 – 1)
α = 0.46 × 2 = 0.92
30. கூற்று: ஒரு நல்லியல்பு கரைசலானது ரௌல்ட் விதிக்கு கீழ்படிகிறது.
காரணம் : ஒரு நல்லியல்பு கரைசலில், கரைப்பான் - கரைப்பான் இடையீடுகள் மற்றும், கரைபொருள் - கரைபொருள் இடையீடுகள், ஆகியன கரைபொருள் - கரைப்பான் இடையீடுகளை ஒத்துள்ளன.
அ) கூற்று மற்றும் காரணம் இரண்டும் சரி, மேலும் காரணமானது, கூற்றிற்கான சரியான விளக்கமாகும்
ஆ) கூற்று மற்றும் காரணம் இரண்டும் சரி, ஆனால் காரணமானது, கூற்றிற்கான சரியான விளக்கமல்ல
இ) கூற்று சரி ஆனால் காரணம் தவறு
ஈ) கூற்று மற்றும் காரணம் இரண்டும் தவறு
[விடை : அ) கூற்று மற்றும் காரணம் இரண்டும் சரி, மேலும் காரணமானது, கூற்றிற்கான சரியான விளக்கமாகும்]