11 வது வேதியியல் : அலகு 9 : கரைசல்கள்
உறைநிலைத் தாழ்விலிருந்து, கரைபொருளின் மோலார் நிறையை கணக்கிடல்
உறைநிலைத் தாழ்வு
கொதிநிலையைப் போலவே, ஒரு பொருளின் உறைநிலையானது, அதன் மற்றொரு முக்கியமான இயற் பண்பாகும். வளிமண்டல அழுத்தத்தில் (1 atm-ல்) எந்த ஒரு வெப்பநிலையில், ஒரு பொருளின் திட மற்றும் திரவ நிலைமைகள் ஆகிய இரண்டும் சமமான ஆவி அழுத்தத்தை பெற்றுள்ளனவோ அவ்வெப்பநிலை உறைநிலை என வரையறுக்கப்படுகிறது. உறைநிலையில், ஒரு வொருளின், திட மற்றும் திரவ நிலைகள் சமநிலையில் உள்ளன. எடுத்துக்காட்டாக, நீரின் உறைநிலை 0oC. இந்த வெப்பநிலையில், பனிக்கட்டியும் நீரும் சமநிலையில் உள்ளன. எளிதில் ஆவியாகாத கரைபொருளை நீருடன் அதன் உறைநிலையில் சேர்க்கும்போது, கரைசலின் உறைநிலையானது 0°C க்கும் கீழே குறைகிறது. கரைபொருளை சேர்க்கும்போது கரைப்பானின் உறைநிலை குறைவது, உறைநிலைத் தாழ்வு (ΔTf) என்றழைக்கப்படுகிறது.
0°C-யில் நீரின் ஆவிஅழுத்தம் 1atm ஆக உள்ளதால் அதன் உறைநிலை (Tof)ன் மதிப்பு 0°C என அறிகிறோம். மேலும், படம் 9.11-யில் இருந்து நீருடன் கரைப் பொருளைச் சேர்க்கும் பொழுது கரைசலின் ஆவிஅழுத்தம் குறைகிறது (ஊதா நிற வரைக்கோடு) எனவும், 1 atm அழுத்ததில் கரைசலின் உறைநிலை 0oC ஐ விட குறைவான (Tf) மதிப்பினை அதாவது உறைநிலை தாழ்வு ஏற்ப்பட்டுள்ளது என்பதனையும் அறியலாம். இந்த உறைநிலைத்தாழ்வை (ΔTf) கீழ்காணுமாறு எழுத முடியும்.
ΔTf = Tof - Tf
சோதனை மதிப்புகளிலிருந்து உறைநிலைத் தாழ்வானது, கரைபொருள் துகள்களின் மோலார் செறிவுக்கு நேர்விகிதத்திலிருக்கும் என அறிய முடிகிறது.
எனவே
ΔTf αm
ΔTf = Kf m -------- (9.30)
இங்கு ‘m’ = கரைசலின் மோலாலிட்டி
Kf என்பது மோலால் உறைநிலைத் தாழ்வு மாறிலியாகும்.
m = 1 எனில் ΔTf = Kf
“Kf ஒரு மோலால் கரைசலின் உறைநிலை தாழ்விற்கு சமம்”.
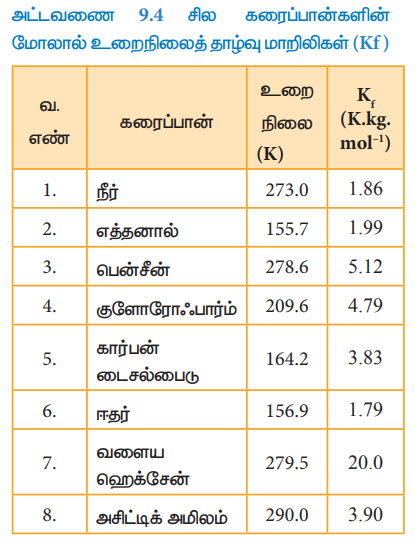
அட்டவணை 9.4 சில கரைப்பான்களின் மோலால் உறைநிலைத் தாழ்வு மாறிலிகள் (Kf)
உறைநிலைத் தாழ்விலிருந்து, கரைபொருளின் மோலார் நிறையை கணக்கிடல்
ΔTf = Kf × WB × 1000 / MB × WA -------- (9.31)
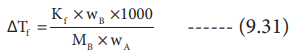
சமன்பாடு (9.31) ஐ பயன்படுத்தி மோலார் நிறையை கண்டறிய முடியும்.
MB = Kf × WB × 1000 / ΔTf × WA
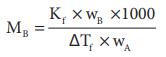
கணக்கு – 5
குளிர்பிரதேசங்களில் பயணிக்கும் கார்களின் ரேடியேட்டர்களில், உறைதடுப்பானாக எத்திலீன் கிளைக்காலை (C2H6O2) பயன்படுத்த முடியும். ஒரு கார் ரேடியேட்டரில், பயன்படுத்தப்பட்டுள்ள, 20 நிறை சதவீத கிளைக்காலின் நீர்க் கரைசலிலிருந்து பனிக்கட்டி படிகங்கள் உருவாகிபிரியும்போது உள்ள வெப்பநிலையை கணக்கிடுக. நீரின் Kf மதிப்பு 1.86 K Kg mol-1 மற்றும் எத்திலீன் கிளைக்காலின் மோலார் நிறை 62 g mol-1
கரைசலின் 20 நிறை சதவீதம் என்பதற்க்கு 20 கிராம் எத்திலீன் கிளைக்கால் 100 கிராம் கரைசலில் உள்ளது எனப்பொருள்.
கரைபொருளின் எடை (W2) = 20கி
கரைப்பானின் எடை (நீர்) W1 = 100 - 20 = 80கி
ΔTf = Kf m
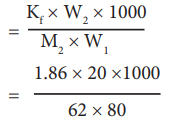
= 7.5 K
எந்த வெப்பநிலையில், பனிக்கட்டி படிகங்கள் உருவாகி பிரிகின்றனவோ அதுவே, கரைபொருளை சேர்த்த பின்னர் நீரின் உறைநிலை ஆகும். அதாவது, சாதாரண உறைநிலையை விட 7.5 K குறைவு. (273-7.5K) = 265.5 K