11 வது வேதியியல் : அலகு 9 : கரைசல்கள்
ஒப்பு ஆவிஅழுத்தக் குறைவிலிருந்து மோலார் நிறைகளை கணக்கிடுதல்
ஒப்பு ஆவி அழுத்தக்குறைவு (ΔP)
மின்பகுளியல்லாத எளிதில் ஆவியாகாத தன்மையுடைய, கரைபொருளைக் கொண்டுள்ள கரைசல்களின் ஆவிஅழுத்தமானது, எப்பொழுதும், தூய கரைப்பானின் ஆவி அழுத்தத்தைவிட குறைவாகவே இருக்கும். தூய கரைப்பான் அதன் ஆவி நிலைமையுடன் சமநிலையில் இருக்கும் ஒரு மூடிய அமைப்பைக் கருதுவோம். சமநிலையில், திரவ மற்றும் ஆவி ஆகிய இரு நிலைமைகளிலும் காணப்படும் கரைப்பானின், கிப்ஸ் கட்டிலா ஆற்றல் மதிப்பு சமமாக இருக்கும் (ΔG = 0). இந்த கரைப்பானுடன், கரைபொருளைச் சேர்க்கும்போது, கரைதல் நிகழ்கிறது. இந்நிகழ்வில் என்ட்ரோபி அதிகரிப்பதால் அதன் கட்டிலா ஆற்றல் (G) குறைகிறது. சமநிலையை பராமரிக்க, ஆவி நிலைமையின் கட்டிலா ஆற்றலும் குறைய வேண்டும். கொடுக்கப்பட்ட ஒரு வெப்பநிலையில், ஆவி நிலைமையின் கட்டிலா ஆற்றல் குறைய வேண்டுமெனில் அதன் அழுத்தம் குறைவது மட்டுமே சாத்தியமான ஒன்றாகும். அதாவது, சமநிலையை பராமரிக்க கரைசலின் ஆவிஅழுத்தம் கண்டிப்பாக குறைய வேண்டும்.
ரௌல்ட் விதிப்படி, ஒப்பு ஆவிஅழுத்தக்குறைவானது, கரைபொருளின் மோல் பின்னத்திற்கு சமம் என்பதை நாம் அறிவோம். (சமன்பாடு 9.16)
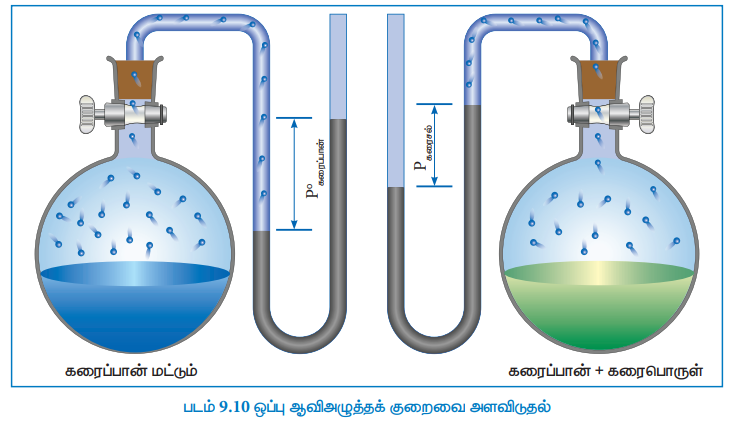
மேற்காண் சமன்பாட்டிலிருந்து, ஒப்பு ஆவிஅழுத்தக்குறைவானது கரைபொருளின் மோல் பின்னத்தை (xB) மட்டுமே சார்ந்திருக்கும், மேலும் அதன் தன்மையைச் சார்ந்திருக்காது என்பது தெளிவாகிறது. எனவே, ஒப்பு ஆவிஅழுத்தக்குறைவானது ஒரு தொகைசார் பண்பாகும்.
ஒப்பு ஆவிஅழுத்தக் குறைவிலிருந்து மோலார் நிறைகளை கணக்கிடுதல்
எளிதில் ஆவியாகாத கரைபொருளின் மோலார் நிறையை நிர்ணயிக்க ஒப்பு ஆவி அழுத்தக் குறைவு அளவீடுகளைப் பயன்படுத்த முடியும். இம்முறையில், நிறை தெரிந்த ஒரு கரைபொருளானது, ஒரு குறிப்பிட்ட அளவு நிறையுள்ள கரைப்பானில் கரைக்கப்படுகிறது. ஒப்பு ஆவிஅழுத்தக்குறைவானது சோதனை மூலம் அளவிடப்படுகிறது. ரௌல்ட் விதிப்படி ஒப்பு ஆவிஅழுத்தக்குறைவானது.
(P0கரைப்பான் – Pகரைசல் / P0கரைப்பான்) = XB
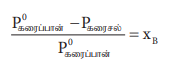
கரைப்பான் மற்றும் கரைபொருளின் எடைகள் முறையே WA மற்றும் WB என்க. மேலும் அவற்றின் மோலார் நிறைகள் முறையே MA மற்றும் MB எனில் கரைபொருளின் மோல் பின்னம் XB
xB = nB / nA + nB --------- (9.20)
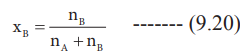
இங்கு, nA & nB என்பன முறையே கரைப்பான் மற்றும் கரைபொருளின் மோல்களின் எண்ணிக்கை நீர்த்த கரைசல்களுக்கு nA >> nB எனவே nA + nB ≈ nA இப்போது
xB = nB / nA
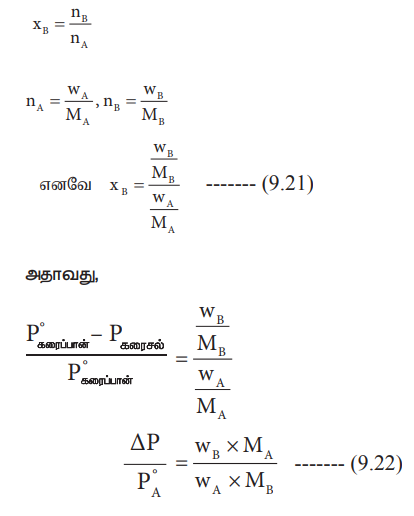
சமன்பாடு 9.35 லிருந்து, WA, WB, MA போன்ற தெரிந்த மதிப்புகளையும், அளவிடப்பட்ட ஒப்பு ஆவிஅழுத்தக்குறைவு மதிப்பையும் பயன்படுத்தி கரைபொருளின் மோலார் நிறையை MB கணக்கிட முடியும்.
கணக்கு:
2% எளிதில் ஆவியாகாத கரைபொருளை கொண்டுள்ள நீர்க் கரைசலானது, கரைப்பானின் கொதிநிலையில், 1.004 bar அழுத்தத்தை கொண்டுள்ளது. PAo மதிப்பு 1.013 bar ஆக இருக்கும்போது கரைபொருளின் மோலார் நிறை என்ன?
ΔΡ / PoA = WB × MA / MB × WA
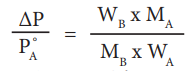
2 % கரைசலில் கரைபொருளின் எடை 2 கிராம், மற்றும் கரைப்பானின் எடை 98 கி.
ΔΡ = PoA - Ρகரைசல் = 1.013- 1.004 bar = 0.009 bar
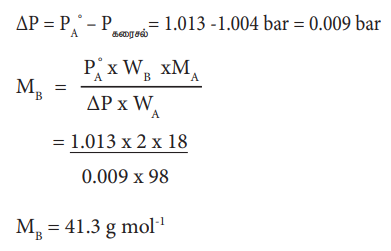
MB = 41.3g mol-1