11 வது வேதியியல் : அலகு 9 : கரைசல்கள்
கொதிநிலை ஏற்றம்
கொதிநிலை ஏற்றம்
கொதிநிலை என்பது ஒரு திரவத்தின் முக்கியமான இயற் பண்பாகும். எந்த ஒரு குறிப்பிட்ட வெப்பநிலையில், ஒரு திரவத்தின் ஆவி அழுத்தமானது வளிமண்டல அழுத்தத்திற்கு 1 atm க்குச் சமமாகிறதோ அவ்வெப்பநிலையானது, அத்திரவத்தின் கொதிநிலை ஆகும். எளிதில் ஆவியாகாத கரைபொருளை தூய கரைப்பானுடன், அதன் கொதிநிலையில் சேர்க்கும்போது. அதன் ஆவிஅழுத்தம் 1 atm க்கு கீழாக குறைகிறது. மீண்டும் ஆவிஅழுத்தத்தை 1 atm க்கு கொண்டு வர வேண்டுமெனில், கரைசலின் வெப்பநிலை உயர்த்தப்பட வேண்டும். இதன் விளைவாக, கரைசலானது, தூய கரைப்பானின் கொதிநிலையைவிட (Tbo) அதிக கொதிநிலையில் (Tb) கொதிக்கிறது. கொதிநிலையில் ஏற்படும் இந்த உயர்வானது, கொதிநிலை ஏற்றம் என அழைக்கப்படுகிறது. வெப்பநிலைக்கு எதிராக தூய கரைப்பான் (நீர்), நீர்க்கரைசல் ஆகியனவற்றின் ஆவிஅழுத்த வரைபடம் படம் 9.11ல் கொடுக்கப்பட்டுள்ளது.
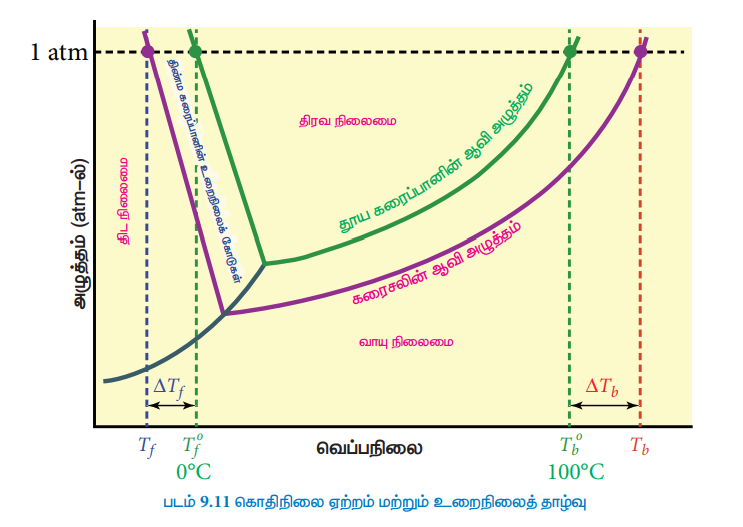
படம்-9.11ல் காட்டியுள்ளவாறு, 0oC லிருந்து வெப்பநிலை அதிகரிக்கும்போது, கரைசலின் ஆவிஅழுத்தமும் அதிகரிக்கிறது. வெப்பநிலையை பொறுத்து தூய நீரின் ஆவிஅழுத்தத்தில் ஏற்படும் மாறுபாடானது பச்சைநிற வளைகோடாக கொடுக்கப்பட்டுள்ளது. 100°C வெப்பநிலையில், நீரின் ஆவி அழுத்த மதிப்பு 1 atm க்குச் சமம். எனவே நீரின் கொதிநிலை 100 °C (Tbo). நீருடன் கரைபொருளை சேர்க்கும்போது, கிடைக்கும் கரைசலின் ஆவிஅழுத்தம் குறைகிறது. வெப்பநிலையை பொறுத்து கரைசலின் ஆவிஅழுத்தத்தில் ஏற்படும் மாறுபாடானது ஊதா நிற வளைகோடாக கொடுக்கப்பட்டுள்ளது. வரைப்படத்திலிருந்து கரைசலின் ஆவி அழுத்தமானது Tb வெப்ப நிலையில் 1 atm க்குச் சமமாக உள்ளது என அறிய முடிகிறது. இவ்வெப்பநிலையானது (Tbo) ஐவிட அதிகம். இந்த இரு வெப்பநிலைகளுக்கு இடையேயான வேறுபாடு (Tb - Tbo) கொதிநிலை ஏற்றத்தை தருகிறது.
கொதிநிலை ஏற்றம் (ΔTb) = Tb -Tb°
கொதிநிலை ஏற்றமானது, கரைபொருள் துகள்களின் செறிவிற்கு நேர்விகிதத்திலிருக்கும்
ΔTb α m --------- (9.23)
m என்பது மோலாலிட்டி அலகில் கரைசலின் செறிவு.
ΔTb = Kb m ------- (9.24)
இங்கு Kb = மோலால் கொதிநிலை ஏற்ற மாறிலி.
m = 1, எனில் ΔTb = Kb ;
எனவே, Kb என்பது, 1 மோலால் கரைசலின் கொதிநிலை ஏற்றமாகும். Kb மதிப்புகள் பின்வரும் சமன்பாட்டின்படி கணக்கிடப்படுகிறது.
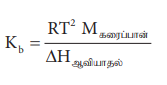
Kb = RT2 Mகரைப்பான் / ΔHஆவியாதல்
கொதிநிலை ஏற்ற மதிப்புகளிலிருந்து கரைபொருளின் மோலார் நிறையை கணக்கிடல்
WA கிராம் கரைப்பானில், WB கிராம் கரைபொருளை கரைத்து கரைசல் தயாரிக்கப்பட்டால், அதன் மோலாலிட்டி
m = கரைபொருளின் மோல் எண்ணிக்கை / கரைப்பானின் எடை (g) கரைபொருளின் × 1000 -----(9.25)
மோல் எண்ணிக்கை WB / MB -----(9.26)

இங்கு, MB = கரைபொருளின் மோலார் நிறை
எனவே,
m = WB × 1000 / MB × WA ------- (9.27)

மதிப்பை சமன்பாடு (9.24) ல் பிரதியிட
ΔTb = Kb × WB × 1000 / MB × WA ------ (9.28)

சமன்பாடு (9.28) ஐ பயன்படுத்தி மோலார் நிறையைக் கண்டறிய முடியும்.
MB = Kb × WB × 1000 / ΔTb × WA ------ (9.29)

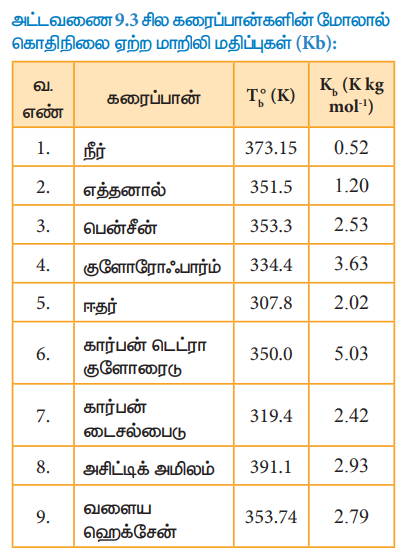
அட்டவணை 9.3 சில கரைப்பான்களின் மோலால் கொதிநிலை ஏற்ற மாறிலி மதிப்புகள் (Kb):
கணக்கு- 4
0.75 கிராம் எடையுடைய பெயர் தெரியாத சேர்மமானது 200 கிராம் கரைப்பானில் கரைக்கப்படுகிறது. கொதிநிலை ஏற்ற மதிப்பு 0.15 K மற்றும் மோலால் கொதிநிலை ஏற்ற மாறிலி மதிப்பு 7.5 K Kg mol-1 எனில், அச்சேர்மத்தின் மோலார் நிறையை கணக்கிடுக.
ΔTb = Kb m
= Kb × W2 × 1000 / M2 × W1
M2 = Kb × W2 × 1000 / ΔTb × W1
= 7.5 × 0.75 × 1000 / 0.15 × 200
= 187.5 g mol-1