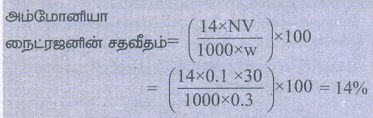செய்முறை, கணக்கீடு, எடுத்துக்காட்டு - கார்பன் மற்றும் ஹைட்ரஜனை அளந்தறிதல் | 11th Chemistry : UNIT 11 : Fundamentals of Organic Chemistry
11 வது வேதியியல் : அலகு 11 : கரிம வேதியியலின் அடிப்படைகள்
கார்பன் மற்றும் ஹைட்ரஜனை அளந்தறிதல்
தனிமங்களை அளந்தறிதல்
பண்பறி பகுப்பாய்வின் மூலம், கொடுக்கப்பட்டுள்ள கரிம சேர்மத்திலுள்ள தனிமங்களைக் கண்டறிந்த பின்னர் அவற்றின் நிறைச் சதவீதத்தினை நிர்ணயிப்பது அவசியமாகிறது. கரிம சேர்மங்களில் காணப்படும் கார்பன், ஹைட்ரஜன், நைட்ரஜன், சல்பர் மற்றும் ஹாலஜன்கள் ஆகியனவற்றை அளந்தறிதல் இங்கு விவரிக்கப்படுகிறது. ஆக்ஸிஜனை அளந்தறியத்தகுந்த முறை ஏதும் இல்லாததால் அதன் அளவானது பிற தனிமங்களின் நிறைச் சதவீதக் கூடுதலிலிருந்து தீர்மானிக்கப்படுகிறது.
கார்பன் மற்றும் ஹைட்ரஜனை அளந்தறிதல்:
கார்பன் மற்றும் ஹைட்ரஜனை ஒரே முறையில் அளந்தறியலாம். எடை தெரிந்த கரிம சேர்மத்தை, அதிக அளவு ஆக்ஸிஜனுடன் எரிக்கும் போது, கார்பன் மற்றும் ஆக்ஸிஜன் முறையே கார்பன் - டை - ஆக்சைடு மற்றும் நீராக ஆக்ஸிஜனேற்றமடைகின்றன.
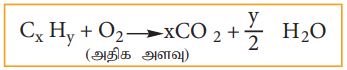
உருவான கார்பன் - டை - ஆக்சைடு மற்றும் நீரின் எடை கண்டறியப்படுகிறது. அதிலிருந்து, கார்பன் மற்றும் ஹைட்ரஜனின் அளவினை கணக்கிடலாம். இம்முறையில் எடையறிய பயன்படும் உபகரணம் மூன்று பகுதிகளை கொண்டது (i) ஆக்ஸிஜன் வழங்கும் அமைப்பு (ii) எரிகுழாய் (iii) உறிஞ்சும் உபகரணம்
i) ஆக்ஸிஜன் வழங்கும் அமைப்பு :
ஆக்ஸிஜனிலுள்ள ஈரப்பதத்தை நீக்குவதற்காக அது முதலில் கந்தக அமிலத்தின் வழியே குமிழிகள் ஏற்படுத்துமாறு செலுத்தப்படுகிறது. பின்னர் CO2 வாயுவை நீக்குவதற்காக, சோடா சுண்ணாம்பு வைக்கப்பட்டுள்ள U வடிவ குழாயின் வழியே செலுத்தப்படுகிறது. ஈரப்பதம் மற்றும் கார்பன் டை ஆக்சைடு நீக்கப்பட்ட ஆக்ஸிஜன் வாயு பின்னர் எரிகுழாயினுள் செல்கிறது.
ii) எரிகுழாய் : கரிம சேர்மத்தினை எரிப்பதற்கு இருபுறமும் திறந்த அமைப்புடைய, கடினமான கண்ணாடியால் ஆன எரிகுழாய் பயன்படுகிறது. இக்குழாயானது, i) ஆக்ஸிஜனேற்றம் செய்யப்பட்ட காப்பர் சுருள்களைக் கொண்டுள்ளது. இது எரிதலால் உருவாகும் விளை பொருட்கள் மீளவும் பின்னோக்கி விரவுதலை தடுக்கிறது. ii) எடை தெரிந்த கரிமச் சேர்மத்தை கொண்ட பீங்கான் படகு. iii) இருபுறமும் சொரசொரப்பான காப்பர் சுருள்கள் மற்றும் iv) ஆக்ஸிஜனேற்றம் செய்யட்பட்ட காப்பர் சுருள் எரிகுழாயின் இறுதி முனைப் பகுதியில் வைக்கப்பட்டுள்ளது. இந்த எரிகுழாய் முழுவதும் ஒரு உலையினுள் வைக்கப்பட்டு, எரிவாயு பர்னர் மூலம் வெப்பப்படுத்தப்படுகிறது.
iii) உறிஞ்சும் உபகரணம் : எரிதலின் மூலம் உண்டான விளை பொருள்களில் உள்ள ஈரப்பதம் மற்றும் கார்பன் டை ஆக்சைடு ஆகியன உறிஞ்சும் உபகரணம் வழியே செலுத்தப்படுகிறது. அந்த உபகரணம் 3 பகுதிகளாக உள்ளது. அவையாவன i) நீரை உறிஞ்சுவதற்காக அடர் H2SO4 இல் நனைக்கப்பட்ட நுரைக்கல் (pumice) வைக்கப்பட்டுள்ள நிறை அறியப்பட்ட U வடிவக் குழாய் ii) CO2 உறிஞ்சுவதற்காக செறிவு மிகுந்த KOH யை கொண்ட இரு குமிழ்கள் மற்றும் இறுதியாக (iii) காற்றிலுள்ள ஈரப்பதம் உள்நுழைவதை தடுக்க நீரற்ற CaCl2 நிரப்பப்பட்டுள்ள பாதுகாப்பு குழாய் (படம்: 11.1)
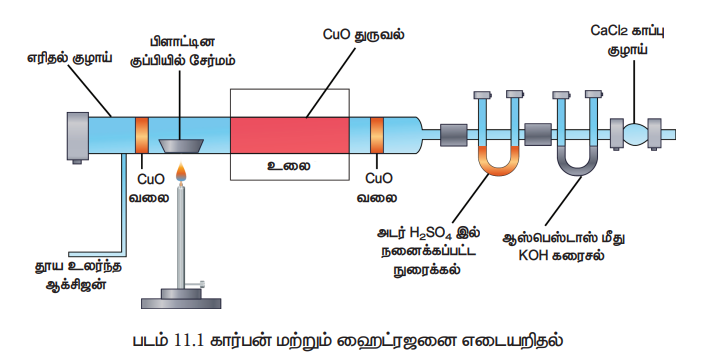
செய்முறை :
எரிகுழாயினை உலர்த்தும் பொருட்டு நன்கு வெப்பப்படுத்தப்படுகிறது. பின்னர் சிறிது குளிர்விக்கப்பட்டு, உறிஞ்சும் உபகரணத்துடன் இணைக்கப்படுகிறது. எரிகுழாயின் மறுமுனை வழியே எடையறியப்பட்ட கரிம சேர்மம் அடங்கிய பீங்கான் தட்டு வைக்கப்படுகிறது. பின்னர் எரிகுழாயில் உள்ள கரிமச் சேர்மம் முற்றிலும் எரிந்து ஆவியாகும் வரை மீளவும் எரிகுழாய் வெப்பப்படுத்தபடுகிறது. இந்நிகழ்விற்கு தோராயமாகக் இரண்டு மணி நேரம் தேவைப்படும். இறுதியாக, ஈரப்பதம் அல்லது CO2 ஏதேனும் எரிகுழாயில் இருப்பின் அதனை வெளியேற்றும் பொருட்டு அதிகளவு ஆக்ஸிஜன் விரைவாக செலுத்தப்படுகிறது. இதன் பின்னர் U வடிவ குழாய் மற்றும் பொட்டாஷ் அடங்கிய குமிழிகள் உபகரணத்திலிருந்து அகற்றப்பட்டு, அவை ஒவ்வொன்றின் எடை அதிகரிப்பு கண்டறியப்படுகிறது.
கணக்கீடு:
எடுத்துக் கொள்ளப்பட்ட கரிம சேர்மத்தின் எடை = wg
H2O ஆல் அதிகரித்த எடை = xg
CO2 ஆல் அதிகரித்த எடை = yg
18 g H2O ல் 2g ஹைட்ரஜன் உள்ளது.
ஃ x g H2O ல் (2x /18) g ஹைட்ரஜன் உள்ளது
எனவே w g கரிம சேர்மத்திலுள்ள ஹட்ரஜனின்
சதவீதம் = (2/18 × x/w × 100) %
44g CO2 ல் 12g கார்பன் உள்ளது.
ஃ y g CO2 ல் (12y/44) g கார்பன் உள்ளது.
என்வே w g கரிம சேர்மத்திலுள்ள கார்பனின்
சதவீதம் = (12/44 × y/w × 100)%
குறிப்பு :
1. ஆய்வுக்கு உட்பட்ட கரிமச்சேர்மத்தில், N காணப்படின், சேர்மம் எரிக்கப்படும்போது நைட்ரஜனின் ஆக்சைடுகள் உருவாகும். எனவே எரிகுழாயில் காப்பர் சுருள்கள் வெப்பப்படுத்தப்பட்டு நைட்ரஜனின் ஆக்சைடுகள், நைட்ரஜனாக ஒடுக்கப்படுகின்றன. நைட்ரஜன் உறிஞ்சப்படாமல் வெளியேறுகிறது.
2. கரிமச் சேர்மத்தில் ஹாலஜன்கள் கலந்திருந்தால், சில்வர் சுருளும் எரிகுழாயில் வைக்கப்படும். இது ஹேலஜன்களை ஹேலைடுகளாக மாற்றுகிறது.
3. சேர்மத்தில் சல்பர் இருந்தால், எரிகுழாயில் காப்பர் ஆக்சைடிற்கு பதிலாக லெட்குரோமேட் வைக்கப்படும். இதனால் எரிதலின் போது உருவான SO2 ஆனது லெட்சல்பேட்டாக மாற்றப்பட்டு, SO2 உறிஞ்சு குழாயில் செல்வது தடுக்கப்படுகிறது.
எடுத்துக்காட்டு கணக்கு: 1
0.26g நிறையுள்ள கரிமசேர்மம் எரிக்கப்படும்போது 0.039g நீரினையும், 0.245g கார்பன் டை ஆக்சைடினையும் தருகிறது. அச்சேர்மத்திலுள்ள C மற்றும் H ன் சதவீதத்தினை கணக்கிடுக.
கரிம சேர்மத்தின் எடை = 0.26 g
நீரின் எடை = 0.039g
CO2 ன் எடை = 0.245g
ஹைட்ரஜனின் சதவீதம்
18g நீரில் உள்ள ஹைட்ரஜனின் எடை = 2g
0.39 நீரில் உள்ள ஹைட்ரஜனின் எடை = 2/18 × 0.039
எனவே 0.26 g கரிம சேர்மத்திலுள்ள ஹைட்ரஜனின் சதவீதம்
= 0.039/0.26 × 2/18 × 100 = 1.66%
கார்பனின் சதவீதம்
44g CO2 ல் உள்ள Cன் எடை = 12
0.245 g of CO2 ல் உள்ள Cன் எடை = 12/44 × 0.245g
எனவே 0.26 g கரிம சேர்மத்திலுள்ள C ன் சதவீதம்
= 12/44 × 0.245/0.26 × 100 = 25.69%
தன்மதிப்பீடு
5. C H மற்றும் O ஆகியனவற்றை கொண்டுள்ள 0.2346g எடையுள்ள கரிமச்சேர்மம் எரிக்கப்படும்போது, 0.2754g நீர் மற்றும் 0.4488g CO2 யை ஆகியவற்றை தருகிறது எனில் அச்சேர்மத்திலுள்ள CH மற்றும் O ன் % இயைபினைக் காண்க.
தீர்வு:
கரிம சேர்மத்தின் நிறை (w) = 0.2346g
நீரின் நிறை (x) = 0.2754g CO2 ன் நிறை (y) = 0.4488g
கார்பனின் சதவிகிதம் = 12/44 × y/w × 100
= 12/44 × 0.4488/0.2346 × 100 = 52.17%
நைட்ரஜனின் சதவிகிதம் = 2/18 × x/w × 100
= 2/18 × 0.2754/0.2346 × 100 = 13.04%
ஆக்ஸிஜனின் சதவிகிதம் = [100-(52.17 + 13.04)]
= 100 - 65.21 = 34.79%
சல்பரை அளந்தறிதல்:
காரியஸ்முறை: எடை அறிந்த கரிமச்சேர்மம் புகையும் HNO3 - உடன் நன்கு வெப்பப்படுத்தப்படுகிறது. C மற்றும் H ஆகியன முறையே CO2 மற்றும் H2O ஆக ஆக்ஸிஜனேற்றம் அடைகின்றன. அதே நேரத்தில் சல்பர் பின்வரும் வினையின் குறிப்பிட்டுள்ளவாறு சல்பியூரிக் அமிலமாக ஆக்ஸிஜனேற்றம் அடைகிறது.
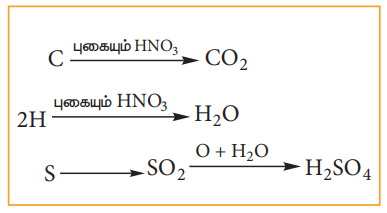
உருவான கரைசலுடன் அதிகளவு BaCl2 கரைசல் சேர்க்கப்படுகிறது. கரைசலில் உள்ள H2SO4 ஆனது BaSO4, ஆக மாற்றப்படுகிறது. BaSO4 - ன் எடையிலிருந்து, சல்பரின் எடை மற்றும் அதன் சதவீதம் கணக்கிடப்படுகிறது.
செய்முறை எடை தெரிந்த கரிமச்சேர்மத்துடன் சில துளிகள் புகையும் HNO3 சேர்க்கப்பட்டு தூய காரியஸ் குழாயில் எடுத்து கொள்ளப்படுகிறது. குழாய் மூடப்பட்டு பின்னர் இரும்பு குழாயில் வைக்கப்பட்டு 5 மணி நேரம் வரை வெப்பபப்படுத்தப்படுகிறது. பிறகு, காரியஸ் குழாய் குளிர்விக்கப்பட்டு சிறு துளையிடப்படுகிறது. இத்துளையின் வழியே குழாயின் உள்ளே உருவான வாயுக்கள் வெளியேற்றப்படுகின்றன. பின்பு காரியஸ் குழாய் உடைக்கப்பட்டு அதில் உள்ள விளைபொருட்கள் பீக்கரில் சேகரிக்கப்படுகின்றது. இவ்வினையில் உருவான H2SO4 உள்ள பீக்கரில் BaCl2 கரைசல் சேர்க்கப்படுகிறது. BaSO4 ஆனது வீழ்படிவாகிறது. வீழ்படிவான BaSO4 ஆனது வடிகட்டப்பட்டு, கழுவப்பட்டு உலர்த்தி பின் எடையறிப்படுகிறது. BaSO4 ன் எடையிலிருந்து, கந்தகத்தின் (S) சதவீதம் கணக்கிடப்படுகிறது.
கரிம சேர்மத்தின் எடை = w g
உருவான BaSO4 ன் எடை = x g
233g BaSO4 ல் உள்ள சல்பரின் எடை = 32 g
x g BaSO4 ல் (32/233 × x) g S உள்ளது
எனவே w g கரிம சேர்மத்திலுள்ள சல்பரின் (S) %
= (32/233 × x/w × 100)%
எடுத்துக்காட்டு – 2
காரியஸ் முறைப்படி அளந்தறிதலில், 0.2175 g நிறையுள்ள சல்பரைக் கொண்டுள்ள கரிமச் சேர்மம் ஆனது 0.5825g BaSO4 யைக் கொடுக்கிறது எனில் அச்சேர்மத்தில் உள்ள S ன் சதவீதத்தினை கணக்கிடுக.
கரிம சேர்மத்தின் எடை= 0.2175 g
BaSO4 ன் எடை = 0.5825 g
233 g BaSO4 ல் உள்ள S ன் எடை = 32 g
0.5825 g BaSO4 ல் உள்ள
S ன் எடை = (32/233) × 0.5825
S ன்% = (32/233) × ( 0.5825/0.2175) × 100
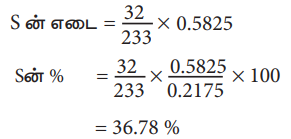
= 36.78 %
தன்மதிப்பீடு
6. 0.16g எடையுள்ள கரிமச் சேர்மம், காரியஸ் குழாயில் சூடுபடுத்தப்படுகிறது. உருவான H2SO4 ஆனது BaCl2 உடன் சேர்த்து வீழ்படிவாக்கப்படுகிறது. வீழ்படிவான BaSO4 ன் நிறை 0.35g. சல்பரின் நிறை சதவீதத்தை காண்க.
தீர்வு:
கரிம சேர்மத்தின் நிறை (W) = 0.16g
பேரியம் சல்பேட்டின் நிறை (x) = 0.35g
சல்பரின் சதவீதம் = 32/233 × x/w × 100
= 32/233 × 0.35/0.16 × 100 = 30.04%
ஹாலஜன்களை அளந்தறிதல்: காரியஸ் முறை:
எடை அறிந்த கரிமச்சேர்மம், புகையும் HNO3 மற்றும் AgNO3 வுடன் சேர்த்து வெப்பப்படுத்தப்படுகிறது. C, H மற்றும் S ஆகியன முறையே CO2, H2O மற்றும் SO2 ஆக ஆக்ஸிஜனேற்றம் அடைகின்றன. ஹாலஜன்கள் AgNO3 உடன் சேர்ந்து சில்வர் ஹாலைடுகளாக வீழ்படிவாகின்றன.
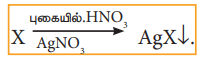
AgX வீழ்படிவு வடிகட்டப்பட்டு, கழுவி, உலர்த்தி எடையறியப்படுகிறது, AgXன் மற்றும் கரிமச்சேர்மத்தின் எடை ஆகியவற்றில் இருந்து ஹாலஜன்களின் சதவீதம் கணக்கிடப்படுகிறது. ஒரு தூய்மையான கேரியஸ் குழாயில் துல்லியமாக எடையறியப்பட்ட கரிமச் சேர்மம் புகையும் HNO3 மற்றும் AgNO3 ஆகியவனவற்றுடன் எடுத்துக்கொள்ளப்படுகிறது. குழாயின் திறந்த முனை மூடப்பட்டு, இரும்பு குழாயினுள் 530- 540 K வெப்பநிலையில் ஏறத்தாழ 5 மணி நேரம் வைக்கப்படுகிறது. பின்னர் குழாயானது குளிர்விக்கப்படுகிறது. இக்குழாயில் சிறிய துளையிடப்பட்டு உருவான வாயுக்கள் வெளியேற்றப்படுகின்றன. அதன்பின்னர் குழாய் உடைக்கப்பட்டு வீழ்படிவு வடிகட்டப்பட்டு, கழுவப்பட்டு, உலர்த்தப்பட்டு எடை கண்டறியப்படுகிறது. உருவான AgXன் நிறையிலிருந்து, கரிமச் சேர்மத்திலுள்ள ஹாலஜனின் சதவீதம் கணக்கிடப்படுகிறது.
கரிமசேர்மத்தின் எடை: w g
AgCl வீழ்ப்படிவின் எடை = a g
143.5 g AgCl ல் உள்ள குளோரினின் எடை = 35.5 g
a g AgCl ல் உள்ள குளோரினின் எடை = 35.5/143.5 × a
W g கரிமச் சேர்மம் a g AgCl யை தருகிறது.
w g கரிமச் சேர்மத்திலுள்ள குளோரினின் சதவீதம் = (35.5/143.5 × a/w × 100)%
சில்வர் புரோமைடின் எடை 'b'g என கருதுக.
188g AgBr ல் 80 g Br உள்ளது
ஃ b g AgBrல் (80b/188) g Br உள்ளது
W g கரிமச் சேர்மம் b g AgBr யை தருகிறது.
கரிமச் சேர்மத்தில்
Br ன் சதவீதம் = (80/188 × b/w × 100) %
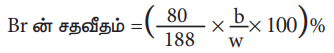
சில்வர் ஐயோடைடு எடை 'c'g என கருதுக.
235g AgI ல் 127 g L
C g AgI ல் (127c/235)g I உள்ளது.
W g கரிமச் சேர்மத்தில் c g AgI யை தருகிறது.
கரிமச் சேர்மத்தில் I ன் சதவீதம்
= (127/235 × c/w × 100) %
எடுத்துக்காட்டு :
காரியஸ் முறைப்படி அளந்தறிதலில், 0.284 g எடையுள்ள கரிமச்சேர்மம் 0.287 g எடையுள்ள AgCl யை தருகிறது எனில், Cl ன் சதவீதத்தைக் காண்க.
கரிமச் சேர்மத்தின் எடை = 0.284 g
AgCl ன் எடை = 0.287 g
143.5 g AgCl ல் உள்ள குளோரின் எடை = 35.5 g
0.287 g AgCl ல் உள்ள குளோரின் எடை = 35.5 / 143.5 × 0.287 g
Cl ன் சதவீதம் = 35.5/143.5 × 0.287/0.284 × 100 = 24.98%
தன்மதிப்பீடு
1) 0.185g எடையுள்ள கரிமச்சேர்மம், அடர் HNO3 மற்றும் சில்வர் நைட்ரேட்டுன் சேர்ந்து 0.320g வெள்ளி புரோமைடை தந்தது எனில், அதில் உள்ள புரோமினின் % காண்க (Ag = 108, Br = 80)
தீர்வு:
கரிம சேர்மத்தின் நிறை (w) = 0.185g
சில்வர் புரோமைடின் நிறை (x) = 0.320g
புரோமினின் சதவீதம் =
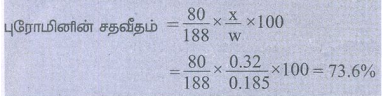
2) காரியஸ் முறையில் 0.40g எடையுள்ள அயோடினால் பதிலீடு செய்யப்பட்ட கரிம சேர்மம் 0.125g AgI யை தருகிறது எனில், அயோடினின் நிறை சதவீதத்தைக் காண்க.
தீர்வு:
கரிம சேர்மத்தின் நிறை (w) = 0.40g
சில்வர் அயோடைடின் நிறை (x) = 0.235g
அயோடினின் சதவீதம் = 127/235 × x/w × 100
= 127/235 × 0.235/0.40 × 100 = 31.75%
பாஸ்பரஸை அளந்தறிதல்
பாஸ்பரஸ் உள்ள எடை தெரிந்த கரிமச்சேர்மம் புகையும் HNO3 உடன் சீல் வைக்கப்பட்ட குழாயில் வெப்பப்படுத்தப்படுகிறது. C, ஆனது CO2 ஆகவும் H ஆனது H2 O ஆகவும் மாற்றப்படுகிறது. கரிமச்சேர்மத்திலுள்ள பாஸ்பரஸ், பாஸ்பாரிக் அமிலமாக ஆக்ஸிஜனேற்றமடைகிறது. இதனை அடர் HNO3 உடன் வெப்பப்படுத்தி, அம்மோனியம் மாலிப்டேட்டை சேர்க்கும்போது அம்மோனியம் பாஸ்போ மாலிப்டேட் வீழ்படிவு உருவாகிறது.
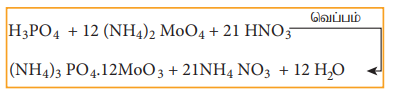
வீழ்படிவான அம்மோனியம் பாஸ்போமாலிப்டேட் வடிகட்டப்பட்டு கழுவப்பட்டு, உலர்த்தி எடையறியப்படுகிறது.
மற்றொரு முறையில், பாஸ்பாரிக் அமிலம் மெக்னீசியா கலவையால் மெக்னீசியம் அம்மோனியம் பாஸ்பேட்டாக மாற்றப்படுகிறது. (மெக்னீசியா கலவையில் MgCl2, NH4Cl மற்றும் அம்மோனியா உள்ளது). இவ்வீழ்படிவு கழுவப்பட்டு, உலர்த்தப்பட்டு, எரிக்கப்பட்டு மெக்னீசியம் பைரோ பாஸ்பேட்டாக மாற்றப்படுகிறது. வீழ்படிவு கழுவப்பட்டு, உலர்த்தப்பட்டு எடை அறியப்படுகிறது.
கரிம சேர்மத்தின் எடை, அம்மோனியம் பாஸ்போமாலிப்டேட் (அ) மெக்னீசியம் பைரோ பாஸ்போட்டின் எடை ஆகியவற்றிலிருந்து, P ன் % கணக்கிடப்படுகிறது.
கரிம சேர்மத்தின் எடை = wg
அம்மோனியம் பாஸ்போ மாலிப்டேட்டின் எடை = x g
மெக்னீசியம் பைரோ பாஸ்பேட்டின் எடை = y g
(NH4)3 PO4 .12MoO3 ன் மூலக்கூறு எடை = 1877 g
[3 × (14 + 4) + 31 + 4(16)] + 12 (96 + 3×16)
Mg2P2O7 ன் மூலக்கூறு எடை = 222g
(2 × 24) + (31 × 2) + (7 × 16)
1877g (NH4)3 PO4.l2MoO3 ல் உள்ள Pன் எடை = 31 g
w g கரிம சேர்மத்திலிருந்து பெறப்பட்ட x g ((NH4)3 PO4.12MoO3 ல் (31/1877 × x/w)g பாஸ்பரஸ் உள்ளது.
w g கரிம சேர்மத்திலுள்ள Pன் சதவீதம் = 31/1877 × x/w × 100%
(அல்லது)
222 Mg2P2O7 ல் உள்ள Pன் எடை = 62g
yg Mg2P2O7 ல் உள்ள Pன் எடை = 62/222 × y
Pன் சதவீதம் = 62/222 × y/w × 100%
எடுத்துக்காட்டு 4: 0.24 g எடையுள்ள பாஸ்பரஸை கொண்டுள்ள கரிமச் சேர்மம் 0.66g Mg2P2O7 யை தந்தது. இச்சேர்மத்தில் உள்ள பாஸ்பரஸின் சதவீதத்தினை கணக்கிடுக.
கரிம சேர்மத்தின் எடை = 0.24 g
Mg2P2O7 ன் எடை = 0.66 g
222g Mg2P2O7 ல் 62 g P உள்ளது
0.66gல் (62/222 × 0.66) g P உள்ளது.
w g கரிமச் சேர்மத்திலுள்ள P ன் சதவீதம் = 62/222 × 0.66/0.24 × 100% = 76.80%
தன்மதிப்பீடு
9. பாஸ்பரஸை கொண்டுள்ள 0.33g எடையுள்ள கரிமச் சேர்மம் 0.397g Mg2P2O7 வீழ்படிவைத் தந்தது எனில், அச்சேர்மத்தில் உள்ள P இன் சதவீதத்தினைக் கணக்கிடுக.
தீர்வு:
கரிம சேர்மத்தின் நிறை (w) = 0.33g
Mg2P2O7ன் நிறை (x) = 0.397g
பாஸ்பரஸின் சதவீதம் =
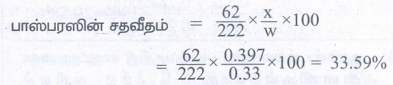
நைட்ரஜனை அளந்தறிதல்: நைட்ரஜனை அளந்தறிய இருமுறைகள் உள்ளன. அவையாவன 1.டுமாஸ் முறை 2. கெல்டால் முறை.
1. டுமாஸ்முறை இம்முறையானது நைட்ரஜனின் சேர்மங்களை, குப்ரிக் ஆக்சைடுடன்,CO2 சூழலில் வெப்படுத்தும்போது தனித்த நைட்ரஜன் வெளிவிடப்படுகிறது என்பதனை அடிப்படையாகக் கொண்டது.
Cx Hy Nz + (2x+y/2) CuO → x CO2 + y/2 H2O + (2x+y/2) Cu + z/2 N2
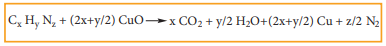
சில நேர்வுகளில் உருவாக வாய்ப்புள்ள சிறிய அளவிலான நைட்ரஜனின் ஆக்சைடுகளை வெப்படுத்தப்பட்ட காப்பர் சுருளின் வழியே செலுத்தி தனிம நிலை நைட்ரஜனாக ஒடுக்கப்படுகிறது.
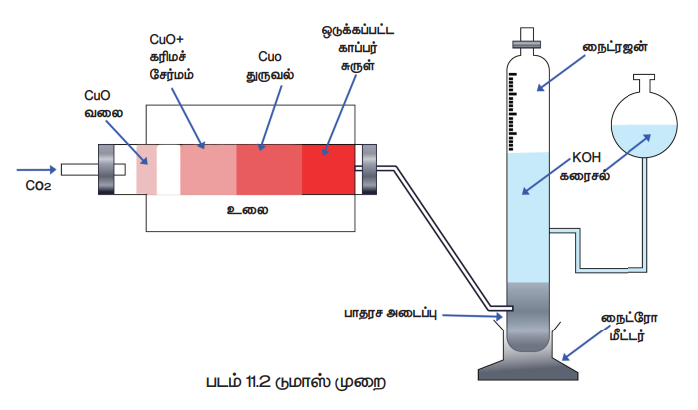
டுமாஸ் முறையில் பயன்படும் உபகரணமானது, CO2 உருவாக்கி, எரிகுழாய், ஷிப்ஸ் நைட்ரோமீட்டர் ஆகியவற்றைக் கொண்டுள்ளது.
CO2 உருவாக்கி:
இம்முறைக்கு தேவைப்படும் கார்பன் டை ஆக்சைடானது மாக்னடைட் அல்லது சோடியம் பை கார்பனேட்டை கடினமான கண்ணாடி குழாயில் வெப்பப்படுத்துவதன் மூலமோ அல்லது கிப்ஸ் உபகரணத்தில் உள்ள சுண்ணாம்பு கல்லின் மீது நீர்த்த HCl ஐ வினைபுரிய செய்வதன் மூலமாகவோ, பெறப்படுகிறது. இந்த CO2 வாயுவானது அடர் H2SO4 வழியே செலுத்தி உலரவைக்கப்பட்டு பின் எரிக்குழாயினுள் செலுத்தப்படுகிறது.
எரிகுழாய்: இக்குழாய் உலையினுள் வைத்து வெப்பபடுத்தப்படுகிறது. இது i) ஆக்ஸிஜனேற்றம் செய்யப்பட்ட காப்பர் சுருளால் நிரப்பப்பட்டுள்ளது. இது எரிதலால் உருவாகும் விளை பொருட்கள் பின்னோக்கி மீளவும் விரவுதலை தடுக்க பயன்படுகிறது. மேலும் கதிர்வீச்சின் மூலம் CuO உடன் சேர்த்து வெப்பப்படுத்த பயன்படுகிறது. ii) எடை அறிந்த கரிமச் சேர்மம் அதிக அளவு CuO உடன் கலக்கப்பட்டு வைக்கப்பட்டுள்ளது. iii) சொரசொரப்பான காப்பர் ஆக்சைடானது குழாயின் நீளத்தில் மூன்றில் இருபங்கு முழுநீளத்திற்கு தளர்வான கல்நாருடன் இருபுறமும் பொதியப்பட்டுள்ளது. இதன் வழி கடந்து செல்லும் கரிம சேர்ம ஆவிகளை இது ஆக்ஸிஜனேற்றம் செய்கிறது. iv) நைட்ரஜன், எரிக்கப்படும்போது ஏதேனும் நைட்ரஜன் ஆக்சைடுகள் உருவானால் அதனை ஒடுக்க ஒடுக்கப்பட்ட காப்பர் சுருள் உள்ளது.
ஷிப்ஸ் நைட்ரோமீட்டர்: எரிகுழாயில் சிதைவுற்ற கரிம சேர்மத்திலிருந்து நைட்ரஜனுடன் குறிப்பிட தகுந்த அதிக அளவு CO2 உடன் கலக்கப்படுகிறது. பின் நைட்ரோ மீட்டரில் செலுத்தும் போது, CO2 ஆனது KOHஆல் உறிஞ்சப்படும். மேற்புறத்திலுள்ள அளவீடுகள் உடைய குழாயில் நைட்ரஜனானது சேகரிக்கப்படுகிறது. (படம்: 11.2)
செய்முறை: முதலில் நைட்ரோ மீட்டர் உள்ளகுழாய் திறக்கப்பட்டு, எரிகுழாயினுள் உள்ள காற்றை நீக்க CO2 செலுத்தப்படுகிறது. வெளியேறும் CO2 ஆனது பொட்டாஷ் கரைசலின் வழியே செல்லும்போது முழுவதும் உறிஞ்சப்படுகிறது. எனவே மேற்பகுதியினை அடைவதில்லை. இதிலிருந்து எரிகுழாயில் உள்ள காற்று முழுவதும் வெளியேறியுள்ளது என அறியலாம். பின் நைட்ரோமீட்டரின் சேமிப்புக்கலன் கீழ் இறக்கப்பட்டு KOH கரைசலால் நிரப்பப்பட்டு குழாய் அடைக்கப்படுகிறது. எரிகுழாய் உலையில் வைத்து சூடுபடுத்தப்பட்டு வெப்பநிலை சீராக உயர்த்தப்படுகிறது. சேர்மத்திலுள்ள வெளியேறும் தனித்த நைட்ரஜன் நைட்ரோ மீட்டரில் சேகரிக்கப்படுகிறது. எரிதல் நிறைவுற்ற பின் குழாயினுள் ஏதேனும் சிறிதளவு நைட்ரஜன் இருப்பின் அதனை நீக்கும் பொருட்டு விரைவாக CO2 செலுத்தப்படுகிறது. அளவீட்டுக் குழாயில் உள்ள அளவீடும், கலவைகள் அளவீடும் சமமாக இருக்கும் வகையில் சேமிப்புக்கலனை சரிசெய்து சேகரிக்கப்பட்ட வாயுவின் கன அளவு குறித்துக்கொள்ளப்படுகிறது.
கணக்கீடு:
கரிமச் சேர்மத்தின் எடை = wg
ஈரமான நைட்ரஜனின் கன அளவு= V1L
அறை வெப்பநிலை = T1 K
வளிமண்டல அழுத்தம் = P mm Hg
அறைவெப்பநிலையில் நீராவி அழுத்தம் = P1 mm Hg
உலர் நைட்ரஜனின் அழுத்தம் = (P-P1) = P1 mm Hg.
STP, உலர் நைட்ரஜனின் அழுத்தம், கனஅளவு மற்றும் வெப்பநிலை முறையே P0 V0 மற்றும் T0 என்க.
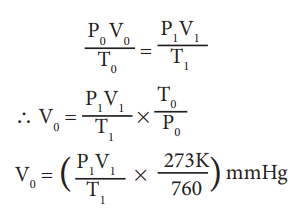
நைட்ரஜனின் சதவீதம் கணக்கிடுதல்
STP ல் 22.4L N2 ன் நிறை 28g
ஃ STP ல் V0 L N2 ன் நிறை 28/22.4 × V0
Wg கரிமச்சேர்மத்தில் (28/22.4 × V0/W)g நைட்ரஜன் உள்ளது
ஃ நைட்ரஜனின் % = (28/22.4 × V0/W) × 100

எடுத்துக்காட்டு: 0.1688g எடையுள்ள சேர்மம் டுமாஸ் முறையில் பகுப்பிற்கு உட்படும்போது 140C, 758 mm Hg யில் 31.7ml ஈரமான நைட்ரஜனை தருகிறது, எனில் அச்சேர்மத்தில் உள்ள நைட்ரஜனின் சதவீதத்தினை கணக்கிடுக.
கரிமச் சேர்மத்தின் எடை = 0.168g
ஈரமான நைட்ரஜனின் கன அளவு (V1) = 31.7mL
= 31.7 × 10-3 L
வெப்பநிலை (T1) = 14°C
= 14 + 273
= 287K
ஈரமான நைட்ரஜனின் அழுத்தம் = 758 mm Hg
14°C யில் நீர்ம அழுத்தம் = 12 mm of Hg
ஃ உலர் நைட்ரஜனின் அழுத்தம் = (P-P1)
= 758 – 12
= 746 mm Hg

= 21.90%
உங்களுக்குத் தெரியுமா?
டுமாஸ்முறை உயர் துல்லியமான முறையாகும். இது கெல்டால் முறையை விட பொதுவாக விரும்பப்படுவதாகும்
கெல்டால்முறை
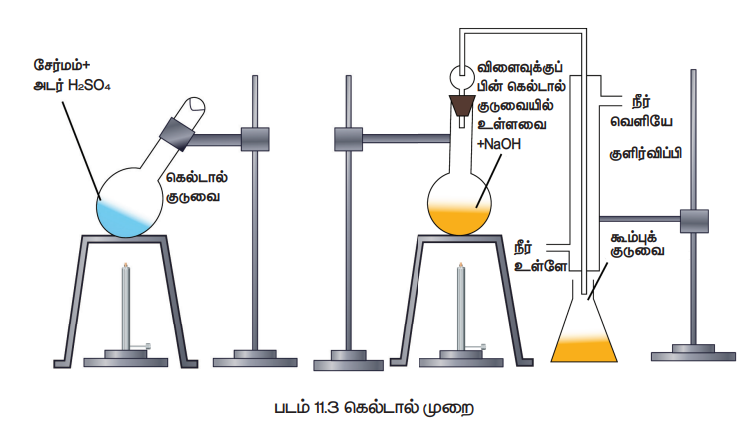
இம்முறை டுமாஸ் முறையை விட எளிதில் கையாளக்கூடியதாகும். உணவுப் பொருள்கள், உரங்கள் போன்றவற்றின் பகுப்பாய்விற்கு பெருமளவில் இம்முறை பயன்படுகிறது. நைட்ரஜன் அடங்கிய கரிமச்சேர்மத்தினை அடர் H2SO4 உடன் சேர்த்து சூடுபடுத்தும் போது, அதிலுள்ள நைட்ரஜன் ஆனது அம்மோனியம் சல்பேட்டாக மாறுகிறது. பின்னர் உருவான கரைசலை அதிக அளவு காரத்துடன் சேர்க்கும் போது வெளிப்படும் அம்மோனியா வாயுவானது அதிக அளவு திட்ட அமிலத்தால் உறிஞ்சப்படுகிறது. பயன்படுத்தப்பட்ட திட்ட காரத்தினை நடுநிலையாக்க தேவைப்படும் அமிலத்தின் கனஅளவினை தரம் பார்த்தலின் மூலம் கண்டறியலாம். இதிலிருந்து வெளியேறிய அம்மோனியாவின் அளவு கண்டறியப்பட்டு நைட்ரஜனின் எடை அறியப்படுகிறது. (படம்:11.3))
செய்முறை:
நீண்ட கழுத்துடைய பைரக்ஸ் கண்ணாடியால் ஆன கெல்டால் குடுவையில் எடைத்தெரிந்த கரிமச்சேர்மம், சிறிது K2SO4 , வினையூக்கியான CuSO4 , சுமார் 25ml அடர் H2SO4 ஆகியன எடுத்துக்கொள்ளப்படுகின்றன. பின் குடுவை கண்ணாடி குமிழியால் தளர்வாக மூடப்பட்டு சாய்வாக வைக்கப்பட்டு, மிதமாக சூடுபடுத்தப்படுகிறது. முதலில் கரைசல் பழுப்பு நிறமாகி, பின் முன்பிருந்தது போன்ற தெளிவான கரைசல் உருவாகும் வரை சூடுபடுத்தப்படுகிறது இந்நிலையில் நைட்ரஜன் முழுவதும் (NH4)2 SO4 ஆக மாற்றப்படுகிறது. பின் கெல்டால் குழாய் குளிர்விக்கப்பட்டு அதிலுள்ளவை நீர்க்கப்பட்டு, பின்னர் ஒரு லிட்டர் கனஅளவுள்ள குடுவைக்கு கரைசல் மாற்றப்படுகிறது. குடுவையின் பக்கவாட்டின் வழியே அதிக அளவு NaOH கரைசல் சேர்க்கப்படுகிறது. பின்குடுவையானது, கெல்டால் சேகரிக்கும் அமைப்பு மற்றும் நீர்க்குளிர்விப்பான் ஆகியவற்றுடன் பொருத்தப்படுகிறது. குளிர்விப்பானின் கீழ்முனை கணக்கிடப்பட்ட கன அளவைக் கொண்ட அதிகளவு N/20 H2SO4 கரைசலில் வைக்கப்படுகிறது. குடுவையிலுள்ள நீர்மம் பின் கொதிக்கவைக்கப்படுகிறது. மேலும் இதனால் வெளியேற்றப்பட்ட அம்மோனியா வாலை வடிக்கப்பட்டு, சல்பியூரிக் அமிலத்தால் உறிஞ்சப்படுகிறது. கரைசல் நன்கு கொதிக்கும் போது, காரம் தெறிக்காமல் கெல்டால் சேகரிக்கும் அமைப்பு தடுக்கிறது.
அம்மோனியா வெளியாவது நிறைவுற்ற பின் (கரைசல், சிவப்பு லிட்மஸால் சோதனை செய்யப்பட வேண்டும்) சேகரிப்பான் நீக்கப்படுகிறது. அதிகப்படியான அமிலம் பீனாப்தலீன் நிறங்காட்டியை பயன்படுத்தி, காரத்துடன் தரம் பார்க்கப்படுகிறது.
கணக்கீடு
கரிம சேர்மத்தின் எடை = Wg.
வெளிவிடப்பட்ட NH3 வாயுவை முழுமையாக நடுநிலையாக்க தேவைப்படும் H2SO4 ன் கன அளவு = V mL.
NH3 யை நடுநிலையாக்க தேவைப்படும் H2SO4 ன் திறன் = N
உருவான NH3 ன் கனஅளவு V1 எனவும் செறிவு N1 எனவும் கொள்க. எனவே V1N1 = VN
கரிமச் சேர்மத்தில் உள்ள நைட்ரஜனின் எடை
= 14 × NV / 1 × 1000 × w
நைட்ரஜனின் சதவீதம் = (14× NV/100× w) × 100%
எடுத்துக்காட்டு - 6;
கெல்டால் முறைக்கு உட்படுத்தப்பட்ட 0.6g எடையுள்ள கரிம சேர்மத்தால் வெளியிடப்பட்ட NH3 வாயு 50ml செமி நார்மல் (semi normal) H2SO4 ஆல் உறிஞ்சப்படுகிறது. மீதமுள்ள அமில கரைசல், வாலை வடிநீரால் நீர்க்கப்பட்டு, கரைசலின் கனஅளவு 150 மிலி ஆக மாற்றப்படுகிறது. 20 மி.லி நீர்க்கப்பட்ட கரைசலை முழுமையாக நடுநிலையாக்க 35 மிலி (N/20) NaOH கரைசல் தேவைப்பட்டது எனில், நைட்ரஜனின் சதவீதத்தை கணக்கீடு.
கரிம சேர்மத்தின் எடை = 0.6g
எடுத்துக்கொண்ட H2SO4 ன் பருமன் = 50 மி.லி
எடுத்துக்கொண்ட H2SO4 ன் திறன் = 0.5 N
வினைபுரியாத, 20ml நீர்த்த H2SO4 அமிலக் கரைசல், 35ml 0.05N சோடியம் ஹைட்ராக்சைடு கரைசலால் நடுநிலையாக்கப்பட்டது எனில்,
நீர்க்கப்பட்ட சல்ஃபியூரிக் அமிலத்தின் திறன்
= 35 × 0.05 / 20
= 0.0875 N
கரிம சேர்மத்துடன் வினைபட்டு எஞ்சிய
H2SO4 ன் பருமன் = V1 mL
H2SO4 ன் திறன் = 0.5N
நீர்க்கப்பட்ட H2SO4 ன் பருமன் = 150 mL
நீர்க்கப்பட்ட சல்ஃபியூரிக் அமிலத்தின் திறன் = 0.0875 N
V1 = 150 × 0.087 / 0.5 = 26.25 mL
அம்மோனியாவால் உறிஞ்சப்பட்ட H2SO4 ன் பருமன் = 23.75 mL
23.75 mL 0.5 N H2SO4 ≡ 23.75 mL 0.5N NH3
0.6g கரிமச் சேர்மத்தில் நைட்ரஜனின் எடை

= 27.66 %
தன்மதிப்பீடு
0.3g எடையுள்ள கரிமச் சேர்மம், கெல்டால் முறையில் தந்த அமோனியா வாயுவை நடுநிலையாக்க 30ml 0.1 N H2SO4 தேவைப்பட்டது எனில் அச்சேர்மத்திலுள்ள நைட்ஜனின் சதவீதத்தினைக் காண்க
தீர்வு:
கரிமச் சேர்மத்தின் நிறை (w) = 0.3 g
சல்ஃபியூரிக் அமிலத்தின் நிறை (N) = 0.1N
சல்ஃபியூரிக் அமிலத்தின் கனஅளவு (V) = 30 mL
30ml 0.1 N சல்ஃபியூரிக் அமிலம் = 30ml 0.1 N அம்மோனியா
அம்மோனியா நைட்ரஜனின் சதவீதம் = (14 × NV/1000 × w) × 100
= (14 × 0.1 × 30/1000 × 0.3) × 100 = 14%