செய்முறை, கணக்கீடு, எடுத்துக்காட்டு - ஹாலஜன்களை அளந்தறிதல் | 11th Chemistry : UNIT 11 : Fundamentals of Organic Chemistry
11 வது வேதியியல் : அலகு 11 : கரிம வேதியியலின் அடிப்படைகள்
ஹாலஜன்களை அளந்தறிதல்
ஹாலஜன்களை அளந்தறிதல்: காரியஸ் முறை:
எடை அறிந்த கரிமச்சேர்மம், புகையும் HNO3 மற்றும் AgNO3 வுடன் சேர்த்து வெப்பப்படுத்தப்படுகிறது. C, H மற்றும் S ஆகியன முறையே CO2, H2O மற்றும் SO2 ஆக ஆக்ஸிஜனேற்றம் அடைகின்றன. ஹாலஜன்கள் AgNO3 உடன் சேர்ந்து சில்வர் ஹாலைடுகளாக வீழ்படிவாகின்றன.
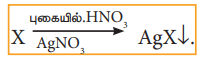
AgX வீழ்படிவு வடிகட்டப்பட்டு, கழுவி, உலர்த்தி எடையறியப்படுகிறது, AgXன் மற்றும் கரிமச்சேர்மத்தின் எடை ஆகியவற்றில் இருந்து ஹாலஜன்களின் சதவீதம் கணக்கிடப்படுகிறது. ஒரு தூய்மையான கேரியஸ் குழாயில் துல்லியமாக எடையறியப்பட்ட கரிமச் சேர்மம் புகையும் HNO3 மற்றும் AgNO3 ஆகியவனவற்றுடன் எடுத்துக்கொள்ளப்படுகிறது. குழாயின் திறந்த முனை மூடப்பட்டு, இரும்பு குழாயினுள் 530- 540 K வெப்பநிலையில் ஏறத்தாழ 5 மணி நேரம் வைக்கப்படுகிறது. பின்னர் குழாயானது குளிர்விக்கப்படுகிறது. இக்குழாயில் சிறிய துளையிடப்பட்டு உருவான வாயுக்கள் வெளியேற்றப்படுகின்றன. அதன்பின்னர் குழாய் உடைக்கப்பட்டு வீழ்படிவு வடிகட்டப்பட்டு, கழுவப்பட்டு, உலர்த்தப்பட்டு எடை கண்டறியப்படுகிறது. உருவான AgXன் நிறையிலிருந்து, கரிமச் சேர்மத்திலுள்ள ஹாலஜனின் சதவீதம் கணக்கிடப்படுகிறது.
கரிமசேர்மத்தின் எடை: w g
AgCl வீழ்ப்படிவின் எடை = a g
143.5 g AgCl ல் உள்ள குளோரினின் எடை = 35.5 g
a g AgCl ல் உள்ள குளோரினின் எடை = 35.5/143.5 × a
W g கரிமச் சேர்மம் a g AgCl யை தருகிறது.
w g கரிமச் சேர்மத்திலுள்ள குளோரினின் சதவீதம் = (35.5/143.5 × a/w × 100)%
சில்வர் புரோமைடின் எடை 'b'g என கருதுக.
188g AgBr ல் 80 g Br உள்ளது
ஃ b g AgBrல் (80b/188) g Br உள்ளது
W g கரிமச் சேர்மம் b g AgBr யை தருகிறது.
கரிமச் சேர்மத்தில்
Br ன் சதவீதம் = (80/188 × b/w × 100) %
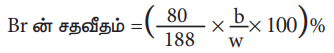
சில்வர் ஐயோடைடு எடை 'c'g என கருதுக.
235g AgI ல் 127 g L
C g AgI ல் (127c/235)g I உள்ளது.
W g கரிமச் சேர்மத்தில் c g AgI யை தருகிறது.
கரிமச் சேர்மத்தில் I ன் சதவீதம்
= (127/235 × c/w × 100) %
எடுத்துக்காட்டு :
காரியஸ் முறைப்படி அளந்தறிதலில், 0.284 g எடையுள்ள கரிமச்சேர்மம் 0.287 g எடையுள்ள AgCl யை தருகிறது எனில், Cl ன் சதவீதத்தைக் காண்க.
கரிமச் சேர்மத்தின் எடை = 0.284 g
AgCl ன் எடை = 0.287 g
143.5 g AgCl ல் உள்ள குளோரின் எடை = 35.5 g
0.287 g AgCl ல் உள்ள குளோரின் எடை = 35.5 / 143.5 × 0.287 g
Cl ன் சதவீதம் = 35.5/143.5 × 0.287/0.284 × 100 = 24.98%