கணக்குகளுக்கான தீர்வுகள் - தன்மதிப்பீடு: கரைசல்கள் | 11th Chemistry : UNIT 9 : Solutions
11 வது வேதியியல் : அலகு 9 : கரைசல்கள்
தன்மதிப்பீடு: கரைசல்கள்
தன் மதிப்பீடு
1. (அ) 500 மி.லி மற்றும் (ஆ) 1 லிட்டர் கரைசலில் 5.6 கிராம் KOH கரைந்துள்ளது எனில், அக்கரைசல்கள் ஒவ்வொன்றின் மோலாரிட்டியைக் கணக்கிடுக.
தீர்வு:
n = W/M = 5.6/56 = 0.1 மோல்
(அ) n = 0.1 மோல் V = 500 மி.லி = 0.5 லி
ஃ M = n/V = 0.1/0.5 = 0.2 M
(ஆ) n = 0.1 மோல் V = 1 லி
ஃ M = n/V = 0.1/1 = 0.1 M
2. 2.82 கிராம் குளுக்கோஸ் ஆனது 30 கிராம் நீரில் கரைக்கப்பட்டுள்ளது. குளுக்கோஸ் மற்றும் நீரின் மோல் பின்னங்களைக் கணக்கிடுக.
தீர்வு:

3. வெளிப்புற பூச்சாக பயன்படும் அயோடோபோவிடோன் புரைதடுப்பான் கரைசலானது 10 % w/v அயோடோபோவிடோனைக் கொண்டுள்ளது. வழக்கமாக ஒருமுறை பயன்படுத்தப்படும் அளவான 1.5 மி.லி உள்ள அயோடோபோவிடோனின் அளவைக் கணக்கிடுக.
தீர்வு:
10% w/v என்பது 10 கி பொருள் 100 மிலி-ல் கரைந்துள்ளதை குறிக்கும்
ஃ 100 மிலி அயோடோபோவிடோனில் உள்ள எடை = 10 கி
ஃ 1 மிலி அயோடோபோவிடோனில் உள்ள எடை = 10/100 கி
ஃ 1.5 மிலி அயோடோபோவிடோனில் உள்ள எடை = 10/100 × 1.5 கி = 0.15 கி
4. 1.05 கி.கி எடையுள்ள 1 லிட்டர் கடல்நீரானது 5 மி.கி கரைந்துள்ள ஆக்சிஜனை (O2) கொண்டுள்ளது, கரைந்துள்ள ஆக்சிஜனின் செறிவை ppm அலகில் குறிப்பிடுக.
தீர்வு:
ஒரு மில்லியனில் உள்ள கரைபொருளின் பகுதிகள் (PPM) = கரைபொருளின் நிறை / கரைசலின் நிறை × 106
(O2) கரைபொருளின் நிறை = 5 மி.கி = 5 × 10-3 கி.
(கடல் நீர்) கரைசலின் நிறை = 1.05 கி.கி = 1.05 × 103 கி
ஃ PPM = 5 × 10-3 / 1.05 × 103 × 106 = 4.76 ppm
தன்மதிப்பீடு
5. தூய கரைபொருள் மற்றும் கரைப்பானிலிருந்து பின்வரும் கரைசல்களை நீ எவ்வாறு தயாரிப்பாய் என்பதை விளக்குக.
(அ) 1L கனஅளவுடைய 1.5 M CoCl2 இன் நீர்க்கரைசல்.
(b) 500 mL கனஅளவுடைய 6.0% (V/V) நீர்ம மெத்தனால் கரைசல்.
தீர்வு:
(அ) V = 1 L ; M = 1.5 M
M2(CoCl2) = 129.9 g mol-1
M = n2/V = W2/M2V ; W2 = MM2V = 1.5 × 129.9 × 1
= 194.85
(ஆ) கன அளவுச் சதவீதம்
(% V/V) = கரைபொருளின் கன அளவு (மி.லி) / கரைசலின் கன அளவு (மி.லி)
%V/V = 6% ; கரைபொருளின் கன அளவு = %V/V × கரைசலின் கன அளவு / 100
= 6 × 500/100 = 30 மி.லி.

30 மிலி மெத்தனாலில் 470மிலி நீர் சேர்க்கப்பட்டு 500மிலி 6% V/V நீர்ம மெத்தனால் கரைசல் தயாரிக்கப்படுகிறது.
6. 500 மி.லி, 0.250 M NaOH கரைசலை தயாரிக்க தேவையான 6M NaOH கரைசலின் கனஅளவு எவ்வளவு?
தீர்வு:
C1 = 6M C2 = 0.250M
V1 = ? V2 = 500 மி.லி
C1 V1 = C2 V2
ஃ V1 = C2 V2 / C1 = 0.250 × 500 / 6 = 20.83 மி.லி
தன்மதிப்பீடு
7. 1 atm அழுத்தத்தில் 20% O2 மற்றும் 80% N2 கனஅளவு வீதத்தை கொண்டுள்ள காற்றானது, நீருடன் சமநிலையில் இருக்கும்போது, 298 K. வெப்பநிலையில், நீரில் கரைந்துள்ள O2 மற்றும் N2 ஆகியவற்றின் கனஅளவு சதவீதத்தை கணக்கிடுக. இவ்விரண்டு வாயுக்களின் ஹென்றி மாறிலிகளின் மதிப்புகள் முறையே KH (O2) = 4.6 × 104 atm மற்றும் KH (N2) = 8.5× 104 atm .
தீர்வு:
மொத்த அழுத்தம் = 1 atm
PN2 = (80/100) × அதிக அழுத்தம் = 80/100 × 1 atm = 0.8 atm
P O2 = (20/100) × 1 = 0.2 atm
ஹென்றி விதிப்படி Pகரைபொருள் = KHX கரைசலில் கரைபொருள்
ஃ PN2 = (KH)நைட்ரஜன் × கரைசலில் நைட்ரஜனின் மோல் பின்னம்
0.8 / 8.5 × 104 = XN2
XN2 = 9.4 × 10-6
இதைப்போலவே
XO2 = 0.2 / 4.6 × 104
= 4.3 × 10-6
8. நீர்வாழ் விலங்குகள் கோடைக்காலத்தில் வெதுவெதுப்பான நீரில் இருப்பதைக் காட்டிலும், குளிர்காலத்தில் குளிர்ந்த நீரில் வசதியாக உணர்கின்றன ஏன் ? விளக்குக.
தீர்வு:
வெப்பநிலை அதிகரிக்கும் போது திரவத்தில் ஒரு வாயுவின் கரைதிறன் குறைகிறது. எனவே வெது வெதுப்பான நீரைக் காட்டிலும் குளிர்ந்த நீரில் ஆக்சிஜனின் கரைதிறன் மற்றும் கரைந்துள்ள ஆக்சிஜனின் அளவு அதிகம். எனவே நீர்வாழ் விலங்குகள் குளிர்ந்த நீரில் வசதியாக உணர்கின்றன.
தன் மதிப்பீடு
9. 128 கிராம் நாஃப்தலினை 39 கிராம் பென்சீனுடன் சேர்த்து, நல்லியல்பு திரவக் கரைசலை உருவாக்கும்போது, ஆவிநிலையிலுள்ள பென்சீன் மற்றும் நாஃப்தலீனின் மோல் பின்னங்களை கணக்கிடுக. 300 K வெப்பநிலையில், தூய பென்சீனின் ஆவிஅழுத்தம் 50.71 mmHg மற்றும் தூய நாஃப்தலீனின் ஆவிஅழுத்தம் 32.06 mmHg
தீர்வு:

தன் மதிப்பீடு
10. 27°C வெப்பநிலையில் A எனும் தூய திரவத்தின் ஆவிஅழுத்தம் 10.0 torr. 20 கிராம் A இல் 1 கிராம் B ஐ கரைப்பதால் ஆவிஅழுத்தம் 9.0 torr க்கு குறைகிறது. A யின் மோலார் நிறை 200 g mol-1 எனில், B யின் மோலார் நிறையை கணக்கிடுக.
தீர்வு:
PoA = 10 torr, Pகரைசல் = 9 torr
WA = 20g WB = 1g
MA = 200g mol-1 MB = ?
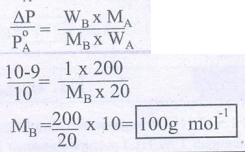
தன் மதிப்பீடு
11) 100 கிராம் கார்பன் டை சல்பைடில் 2.56 கிராம் சல்பர் கரைக்கப்பட்டுள்ளது. இந்த கரைசல் 319. 692 K இல் கொதிக்கிறது. கரைசலில் சல்பரின் மோலார் நிறை என்ன? CS2 இன் கொதிநிலை 319. 450K. CS2 இன் Kb மதிப்பு 2.42 K Kg mol-1 என கொடுக்கப்பட்டுள்ளது.
தீர்வு:
W2 = 2.56 g T = 319.692 K
W1 = 100 g = 100/1000 Kg ∆Tb = (319.692 – 319.450) K = 0.242 K
K b = 2.42 K Kg mol-1
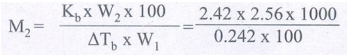
M2 = 256 g mol-1
கரைசலில் சல்பரின் மூலக்கூறு நிறை = 256g mol-1
ஒரு மோல் சல்பர் அணுவின் நிறை = 32
ஒரு மூலக்கூறு சல்பரில் உள்ள அணுக்களின் எண்ணிக்கை = 256/32 = 8
எனவே சல்பரின் மூலக்கூறு வாய்ப்பாடு = S8.
தன் மதிப்பீடு
12) 2 கிராம் மின்பகுளி அல்லாத கரைபொருளை 75 கிராம் பென்சீனில் கரைக்கும்போது, பென்சீனின் உறைநிலையானது 0.20 K குறைகிறது. பென்சீனின் உறைநிலைத் தாழ்வு மாறிலி 5.12K Kg mol-1. கரைபொருளின் மோலார் நிறையைக் காண்க.
தீர்வு:
W2 = 2g W1 = 75 g = 75/1000 Kg
∆Tf = 0.2 K Kf = 5.12 K Kg mol-1
M2 = ?
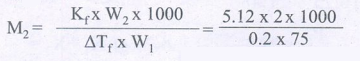
= 682.66 g mol-1
தன்மதிப்பீடு
13) 6g L-1 செறிவு கொண்ட யூரியா (NH2CONH2) கரைசலுடன் ஐசோடானிக் கரைசலாக உள்ள குளுக்கோஸ் கரைசலில், ஒரு லிட்டரில் கரைந்துள்ள குளுக்கோசின் (C6H12O6)நிறை என்ன?
தீர்வு:
ஐசோடானிக் கரைசல்கள் A, B எனில்
πA = πB
CART = CBRT
CA = CB
ஐசோடானிக் கரைசல்கள் A, B க்கு
WA / MAVA = WB/MBVB
A - குளுக்கோஸ்
WA = ? MA = 180கிமோல்-1 VA = 1 லி
B - யூரியா
WB = 6கி MB = 60 கிமோல்-1 VB = 1 லி
ஃ WA = WB / MB VB × MAVA = 6 × 180 × 1 / 60 × 1 = 18கி