வேதியியல் - கரைசல்களின் செறிவுகளை குறிப்பிடுதல் | 11th Chemistry : UNIT 9 : Solutions
11 வது வேதியியல் : அலகு 9 : கரைசல்கள்
கரைசல்களின் செறிவுகளை குறிப்பிடுதல்
கரைசல்களின் செறிவுகளை குறிப்பிடுதல்
நாம் நம்முடைய அன்றாட வாழ்வில், வெவ்வேறு வலிமை அல்லது செறிவுகளைக் கொண்ட, வாய் கழுவும் திரவம் (Mouth wash), புரைதடுப்பான், வீட்டு உபயோக கிருமிநாசினிகள் என பல கரைசல்களை பயன்படுத்துகிறோம். நீங்கள் எப்பொழுதாவது இத்தகைய கரைசல்களில் உள்ள பகுதிப்பொருள்களின் செறிவுகளை கவனித்ததுண்டா? எடுத்துக்காட்டாக, குளோர்ஹெக்ஸிடின் வாய் கழுவும் திரவக் கரைசலானது 0.2% (w/v) குளோர்ஹெக்ஸிடின் குளுக்கோனேட்டைக் கொண்டுள்ளது; வணிக ரீதியில் கிடைக்கும் ஹைட்ரஜன் பெராக்சைடு கரைசலின் செறிவு 3% (w/v) ஆகும். இதேபோல, கரைசல்களின் செறிவுகளை குறிப்பிடுவதற்காக, ppm (நீரின் TDS), மோலார் மற்றும் நார்மல் (ஆய்வக வினைப்பொருள்கள்) போன்ற மற்ற செறிவு அலகுகளும், பயன்படுத்தப்படுகின்றன. கரைசலின் செறிவானது, குறிப்பிட்ட அளவுள்ள கரைப்பானில் கரைந்துள்ள கரைபொருளின் அளவினைக் குறிக்கின்றது. மேற்கண்டுள்ளவாறு, கரைசல்களின் செறிவுகளை குறிப்பிடுவதற்காக பல்வேறு வழிமுறைகள் உள்ளன. செறிவை குறிப்பிடும் வெவ்வேறு செறிவு அலகுகள் மற்றும் குறிப்பிட்ட செறிவுடைய கரைசலை எவ்வாறு தயார் செய்வது போன்றவற்றைப் பற்றி இப்பாடப்பகுதியில் நாம் கற்போம்.
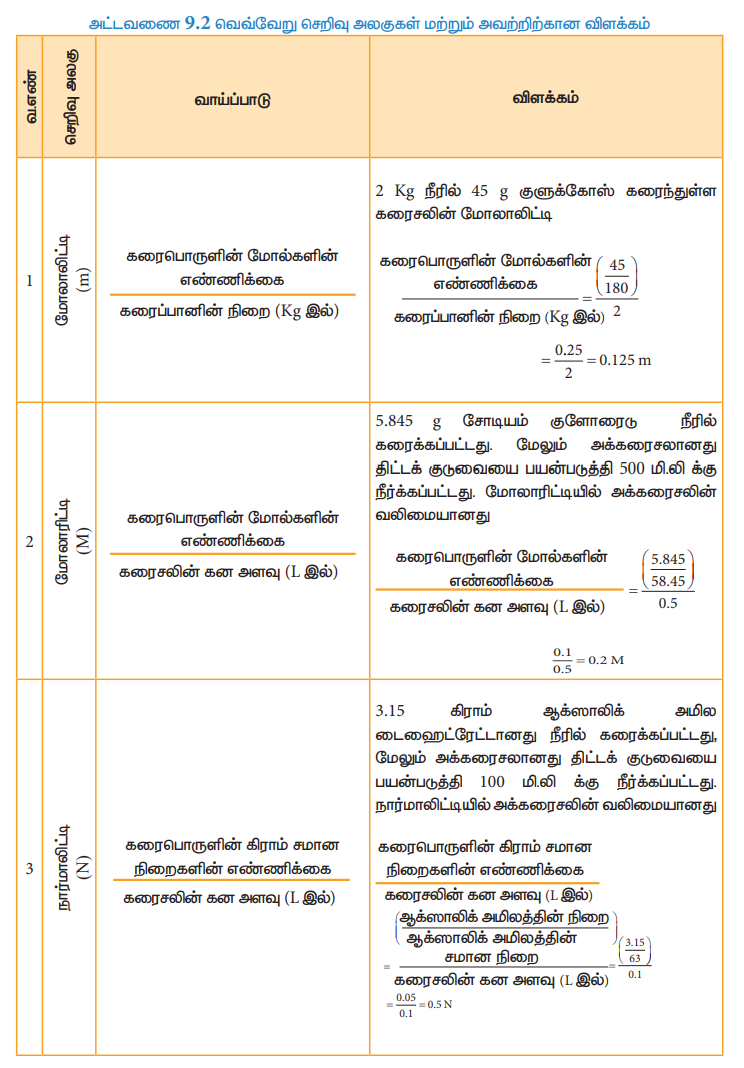
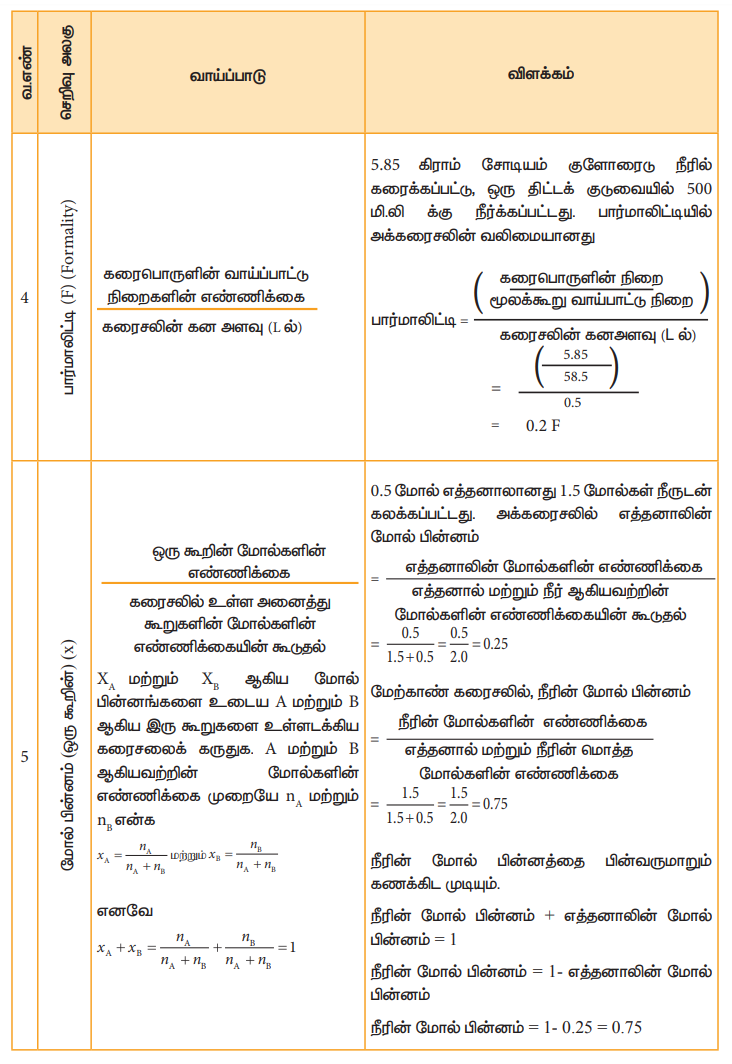
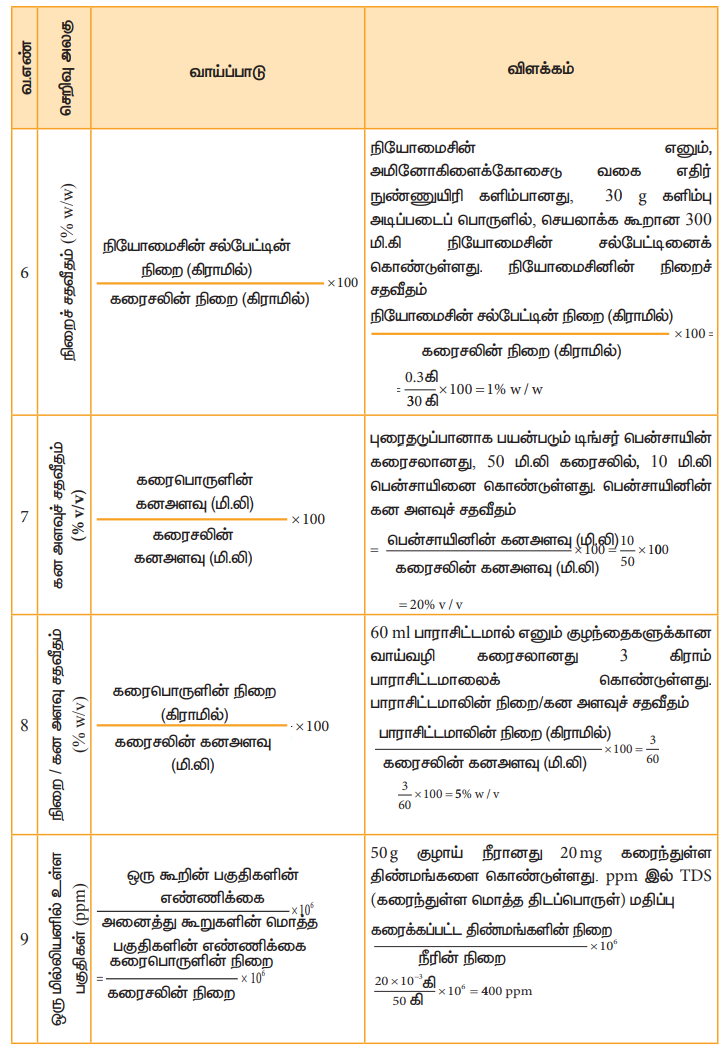
அட்டவணை 9.2 வெவ்வேறு செறிவு அலகுகள் மற்றும் அவற்றிற்கான விளக்கம்
தன் மதிப்பீடு
1. (அ) 500 மி.லி மற்றும் (ஆ) 1 லிட்டர் கரைசலில் 5.6 கிராம் KOH கரைந்துள்ளது எனில், அக்கரைசல்கள் ஒவ்வொன்றின் மோலாரிட்டியைக் கணக்கிடுக.
தீர்வு:
n = W/M = 5.6/56 = 0.1 மோல்
(அ) n = 0.1 மோல் V = 500 மி.லி = 0.5 லி
ஃ M = n/V = 0.1/0.5 = 0.2 M
(ஆ) n = 0.1 மோல் V = 1 லி
ஃ M = n/V = 0.1/1 = 0.1 M
2. 2.82 கிராம் குளுக்கோஸ் ஆனது 30 கிராம் நீரில் கரைக்கப்பட்டுள்ளது. குளுக்கோஸ் மற்றும் நீரின் மோல் பின்னங்களைக் கணக்கிடுக.
தீர்வு:

3. வெளிப்புற பூச்சாக பயன்படும் அயோடோபோவிடோன் புரைதடுப்பான் கரைசலானது 10 % w/v அயோடோபோவிடோனைக் கொண்டுள்ளது. வழக்கமாக ஒருமுறை பயன்படுத்தப்படும் அளவான 1.5 மி.லி உள்ள அயோடோபோவிடோனின் அளவைக் கணக்கிடுக.
தீர்வு:
10% w/v என்பது 10 கி பொருள் 100 மிலி-ல் கரைந்துள்ளதை குறிக்கும்
ஃ 100 மிலி அயோடோபோவிடோனில் உள்ள எடை = 10 கி
ஃ 1 மிலி அயோடோபோவிடோனில் உள்ள எடை = 10/100 கி
ஃ 1.5 மிலி அயோடோபோவிடோனில் உள்ள எடை = 10/100 × 1.5 கி = 0.15 கி
4. 1.05 கி.கி எடையுள்ள 1 லிட்டர் கடல்நீரானது 5 மி.கி கரைந்துள்ள ஆக்சிஜனை (O2) கொண்டுள்ளது, கரைந்துள்ள ஆக்சிஜனின் செறிவை ppm அலகில் குறிப்பிடுக.
தீர்வு:
ஒரு மில்லியனில் உள்ள கரைபொருளின் பகுதிகள் (PPM) = கரைபொருளின் நிறை / கரைசலின் நிறை × 106
(O2) கரைபொருளின் நிறை = 5 மி.கி = 5 × 10-3 கி.
(கடல் நீர்) கரைசலின் நிறை = 1.05 கி.கி = 1.05 × 103 கி
ஃ PPM = 5 × 10-3 / 1.05 × 103 × 106 = 4.76 ppm
கரைசல்களின் செறிவானது வெவ்வேறு அலகுகளில் குறிப்பிடப்படுகின்றன. ஒரு குறிப்பிட்ட கரைசலை பயன்படுத்தி மேற்கொள்ளப்பட இருக்கும் அளவீட்டின் அடிப்படையிலேயே அதன் செறிவு அலகு தெரிவு செய்யப்படுகிறது. எடுத்துக்காட்டாக, EDTA பயன்படுத்தப்படும் அணைவுச்சேர்மமாக்கி தரம்பார்த்தல்களில், வினையானது, EDTA மற்றும் உலோக அயனிகளுக்கிடையே 1:1 என்ற மோல் விகிதத்தில் நிகழ்கிறது, எனவே இத்தகைய தரம்பார்த்தல் வினைகளில், மோலார் கரைசல்கள் பயன்படுத்தப்படுகின்றன. ஆக்ஸிஜனேற்ற - ஒடுக்க மற்றும் நடுநிலையாக்கல் தரம்பார்த்தல்களில், நாம் நார்மல் கரைசல்களைப்- பயன்படுத்துகிறோம். வாயுக்களின் பகுதி அழுத்தங்கள் மற்றும் கரைசல்களின் ஆவிஅழுத்தங்களை கணக்கிடுவதற்கு மோல் பின்னம் பயன்படுத்தப்படுகிறது. நோய் நீக்கும் மருந்துப்பொருள்களில் உள்ள செயல் ஆக்கக்கூறுகளை குறிப்பிடுவதற்காக சதவிகித அலகுகள் பயன்படுத்தப்படுகின்றன, மேலும் கரைசல்களில் கரைந்துள்ள சிறிய அளவிலான கரைபொருள்களை குறிப்பிட ppm பயன்படுத்தப்படுகிறது.
1. திட்டக் கரைசல்கள் மற்றும் பயன்பாட்டு திட்டக் கரைசல்கள் (working standards)
திட்டக் கரைசல் அல்லது இருப்புக் கரைசல் என்பது, துல்லியமாக திறன் தெரிந்த கரைசலாகும். தேவையான அளவு கரைபொருளை, குறிப்பிட்ட அளவு கரைப்பானில் கரைப்பதன் மூலம், தேவையான செறிவுடைய திட்டக்கரைசலை தயாரிக்க முடியும். இதனை பின்வருமாறு தயாரிக்கலாம். (i) எடையறிந்த கரைபொருளை, குறிப்பிட்ட கனஅளவுள்ள திட்டக் குடுவைக்கு மாற்ற வேண்டும்.(ii) கரைபொருளை கரைப்பதற்காக, குடுவையினுள் சிறிதளவு நீர் சேர்த்து குலுக்கப்படுகிறது. (iii) பின்னர், கரைசல் மட்டத்தை குடுவையின் மேல்பாகத்தில் குறிப்பிட்டுள்ள கோடு வரை நிரப்புவதற்காக குடுவையில் நீர் சேர்க்கப்படுகிறது (iv) சீரான செறிவுடைய கரைசலைப்பெற, குடுவையானது மூடியால் அடைக்கப்பட்டு நன்கு குலுக்கப்படுகிறது.
சோதனைகளின் போது, இருப்புக்கரைசலை நீர்க்கச் செய்வதன் மூலமாக, தேவையான செறிவுள்ள கரைசல் தயாரிக்கப்படுகிறது. இந்த நீர்த்த கரைசலானது பொதுவாக "பயன்பாட்டுக் கரைசல்" என்றழைக்கப்படுகிறது. தெரிந்த கனஅளவுள்ள இருப்புக் கரைசலானது, புதிய முகவைக்கு மாற்றப்பட்டு, கணக்கிடப்பட்ட கனஅளவிற்கு நீர்க்கப்படுகிறது. தேவையான, இருப்புக்கரைசலின் கனஅளவு மற்றும் இறுதி கனஅளவு ஆகியவற்றை பின்வரும் சமன்பாட்டினை பயன்படுத்தி கணக்கிட முடியும்.
Cs Vs = Cw Vw ---------- (9.1)
இங்கு Cs & Vs ஆகியன முறையே இருப்புக் கரைசலின் செறிவு மற்றும் கனஅளவு மற்றும் Cw & Vw ஆகியன முறையே பயன்பாட்டுக் கரைசலின் செறிவு மற்றும் கனஅளவு ஆகும்.
2. திட்டக் கரைசல்களை பயன்படுத்துவதன் நன்மைகள்:
1. அதிகளவிலான கரைபொருளைக் கொண்டு தயாரிக்கப்படும் செறிவு மிகுந்த திட்டக் கரைசலை பயன்படுத்துவதால், கரைபொருளை எடையறியும் போது ஏற்படும் பிழைகளை குறைக்க முடியும்.
2. இருப்புக்கரைசலை நீர்க்கச் செய்து வெவ்வேறு செறிவுகளைக் கொண்ட பயன்பாட்டுக் கரைசல்களை நாம் தயாரிக்க முடியும். இம்முறையில் நிலைத்தன்மை பராமரிக்கப்படுவதால் அதிக பயனுடையது.
3. சில செறிவு மிகுந்த கரைசல்கள் அதிக நிலைப்புத்தன்மை கொண்டவை, மேலும், சோதனைகளில் பயன்படுத்தப்படும், பயன்பாட்டு திட்டக்கரைசல்கள் (working standards) போல் அல்லாமல், அவை நுண்ணுயிர் வளர்ச்சிக்கு குறைந்தளவே ஊக்கமளிக்கின்றன.
எடுத்துக்காட்டு கணக்கு
1. 500 மி.லி 2.5 M HCl கரைசலைப் பெறுவதற்கு, 4M HCl மற்றும் 2M HCl கரைசல்களை எந்த கன அளவுகளில் கலக்க வேண்டும்?
தீர்வு: 500 மி.லி 2.5 M HCl கரைசலை தயாரிக்க தேவைப்படும், 4M HCl இன் கன அளவு = x மி.லி. என்க.
எனவே தேவைப்படும் 2M HCl இன் கன அளவு = (500 - x) மி.லி.
சமன்பாடு (9.1) லிருந்து
C1V1 + C2V2 = C3V3
(4x) + 2(500-x) = 2.5 × 500
4x + 1000-2x = 1250
2x = 1250 – 1000
x = 250/2
x = 125 mL
எனவே, தேவைப்படும் 4M HCl இன் கனஅளவு = 125 மி.லி.
தேவைப்படும் 2M HCl இன் கனஅளவு = (500 – 125) மி.லி.

= 375 மி.லி.
தன்மதிப்பீடு
5. தூய கரைபொருள் மற்றும் கரைப்பானிலிருந்து பின்வரும் கரைசல்களை நீ எவ்வாறு தயாரிப்பாய் என்பதை விளக்குக.
(அ) 1L கனஅளவுடைய 1.5 M CoCl2 இன் நீர்க்கரைசல்.
(b) 500 mL கனஅளவுடைய 6.0% (V/V) நீர்ம மெத்தனால் கரைசல்.
தீர்வு:
(அ) V = 1 L ; M = 1.5 M
M2(CoCl2) = 129.9 g mol-1
M = n2/V = W2/M2V ; W2 = MM2V = 1.5 × 129.9 × 1
= 194.85
(ஆ) கன அளவுச் சதவீதம்
(% V/V) = கரைபொருளின் கன அளவு (மி.லி) / கரைசலின் கன அளவு (மி.லி)
%V/V = 6% ; கரைபொருளின் கன அளவு = %V/V × கரைசலின் கன அளவு / 100
= 6 × 500/100 = 30 மி.லி.

30 மிலி மெத்தனாலில் 470மிலி நீர் சேர்க்கப்பட்டு 500மிலி 6% V/V நீர்ம மெத்தனால் கரைசல் தயாரிக்கப்படுகிறது.
6. 500 மி.லி, 0.250 M NaOH கரைசலை தயாரிக்க தேவையான 6M NaOH கரைசலின் கனஅளவு எவ்வளவு?
தீர்வு:
C1 = 6M C2 = 0.250M
V1 = ? V2 = 500 மி.லி
C1 V1 = C2 V2
ஃ V1 = C2 V2 / C1 = 0.250 × 500 / 6 = 20.83 மி.லி