கரைசல்கள் | வேதியியல் - ஹென்றி விதி | 11th Chemistry : UNIT 9 : Solutions
11 வது வேதியியல் : அலகு 9 : கரைசல்கள்
ஹென்றி விதி
ஹென்றி விதி
வில்லியம் ஹென்றி என்பவர், ஒரு குறிப்பிட்ட கரைப்பானில், வாயுநிலைக் கரைபொருளின் கரைதிறன் மற்றும் அழுத்தம் ஆகியவற்றிற்கிடையே உள்ள தொடர்பை ஆய்வு செய்தார். அவரின் கூற்றுப்படி குறைவான செறிவு கொண்ட கரைசல்களில் "ஆவி நிலைமையிலுள்ள வாயுவின் பகுதி அழுத்தமானது (கரைபொருளின் ஆவி அழுத்தம்) கரைசலிலுள்ள வாயுநிலைக் கரைபொருளின் மோல் பின்னத்திற்கு (x), நேர் விகிதத்திலிருக்கும்", இக்கூற்று ஹென்றி விதி என அறியப்படுகிறது.
ஹென்றி விதியை பின்வருமாறு எழுத முடியும்.
Pகரைபொருள் α X கரைசலில் உள்ள கரைபொருள் ------- (9.1)
Pகரைபொருள் = KHX கரைசலில் உள்ள கரைபொருள் ------- (9.2)
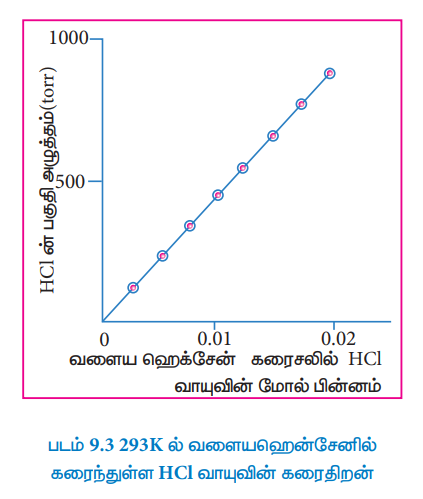
இங்கு Pகரைவொருள் என்பது ஆவிநிலையிலுள்ள வாயுவின் பகுதி அழுத்தத்தைக் குறிக்கிறது. இது பொதுவாக ஆவி அழுத்தம் என்றழைக்கப்படுகிறது. Xகரைபொருள் என்பது, கரைசலில் உள்ள கரைபொருளின் மோல் பின்னத்தை குறிக்கிறது. KH என்பது அழுத்தத்தின் பரிமாணத்தை உடைய சோதனை முடிவின் அடிப்படையிலான மாறிலி KH ன் மதிப்பானது, வாயுநிலை கரைபொருள் மற்றும் கரைப்பானின் தன்மையை பொருத்து அமைகிறது. மேற்காண் சமன்பாடானது y = mx வடிவில் அமைந்த நேர்க்கோட்டின் சமன்பாட்டை ஒத்துள்ளது. படம் 9.3 ல் காட்டப்பட்டுள்ளவாறு கரைசலில் மோல் பின்னத்திற்கு எதிரான வாயுவின் பகுதிஅழுத்தத்தின் வரைபடம் ஆனது ஒரு நேர் கோட்டினைத் தருகிறது. இந்த நேர்க்கோட்டின் சாய்வு, KH மதிப்பைத் தருகிறது.
உங்களுக்குத் தெரியுமா?
CO2 செலுத்தப்பட்டுள்ள பானங்கள் ஏன் அழுத்தப்பட்ட கலன்களில் அடைக்கப்பட்டுள்ளன?
CO2 செலுத்தப்பட்டுள்ள பானங்களில் கார்பன்- டை-ஆக்சைடு கரைந்துள்ளதை நாம் அனைவரும் அறிவோம். இந்த பானங்களில், கார்பன்-டை-ஆக்சைடை கரைப்பதற்காக, அவற்றின் வழியே அதிக அழுத்தத்தில் CO2 வாயு குமிழிகளாக செலுத்தப்படுகின்றன. அழுத்தத்தை பராமரிப்பதற்காக இந்த கலன்கள் சீல் செய்யப்படுகின்றன. வளிமண்டல அழுத்தத்தில், இந்த கலன்களை நாம் திறக்கும்போது, CO2 வாயுவின் அழுத்தமானது, வளிமண்டல அழுத்த அளவிற்கு குறைகிறது, இதனால் CO2 வாயுக்குமிழ்கள் வேகமாக கரைசலிருந்து வெளியேறுகின்றன, மேலும் நுரைத்தலை காண முடிகிறது. சோடா பாட்டில், வெதுவெதுப்பான நிலையிலிருந்தால், குமிழிகள் வெடித்து வெளியேறுவதை நாம் மேலும் கண்டுணர இயலும்.
உங்களுக்குத் தெரியுமா?
ஏன் ஆழ்கடல் நீச்சல் வீரர்கள் ஹீலியம் வாயு சேர்க்கப்பட்ட காற்றுக் கலனைப் பயன்படுத்துகின்றனர்?
தொழில்முறை, ஆழ்கடல் நீச்சல் வீரர்கள், நீருக்கடியில், அதிக அழுத்தத்தில், சுவாசிப்பதற்காக, அழுத்தப்பட்ட காற்று நிரம்பிய கலனை ஏந்திச் செல்கின்றனர். பொதுவாக, அழுத்தப்பட்ட காற்றானது நைட்ரஜன் மற்றும் ஆக்சிஜன் வாயுக்களைக் கொண்டுள்ளன, மேலும் இவை சாதாரண அழுத்தத்தில் இரத்தம் மற்றும் மற்ற உடல் திரவங்களில் அதிகமாக கரைவதில்லை. ஆழ்கடலில், மேற்பரப்பின் வளிமண்டல அழுத்தத்தைப் போல பலமடங்கு அதிக அழுத்தம் அதன் ஆழமான பகுதியில் காணப்படுவதால், நீச்சல்வீரர், கலனிலிருந்து சுவாசிக்கும்போது, இரத்தம் மற்றும் மற்ற உடல்திரவங்களில் அதிகளவு நைட்ரஜன் கரைகிறது. நீச்சல்வீரர், மேற்பரப்பிற்கு திரும்பும்போது, அழுத்தம் குறைகிறது. இதனால் இரத்தம் மற்றும் மற்ற உடல் திரவங்களில் கரைந்துள்ள நைட்ரஜனானது, இரத்த ஓட்டத்தில் குமிழிகளை உருவாக்கிக்கொண்டு வேகமாக வெளியேறுகிறது. இந்த குமிழிகள் இரத்த ஓட்டத்தை தடுக்கின்றன, நரம்பு தூண்டுக் கடத்துதலை பாதிக்கின்றன, மேலும் தந்துகி குழாய்களை வெடிக்கச் செய்யவோ அல்லது அடைப்புகளை உருவாக்கவோ செய்ய முடியும். இந்த வலிநிறைந்த மற்றும் உயிருக்கு ஆபத்தான நிலையானது “the bends" (வளைவு) என்றழைக்கப்படுகிறது. இத்தகைய அபாயகரமான நிலையை தவிர்க்க, தற்பொழுது தொழில்முறை நீச்சல் வீரர்கள், ஹீலியம் வாயு கலந்த காற்றை (ஏறக்குறைய 11.7% ஹீலியம், 56.2% நைட்ரஜன் மற்றும் 32.1% ஆக்சிஜன்) பயன்படுத்துகின்றனர். ஏனெனில் இரத்தத்தில் நைட்ரஜனைக் காட்டிலும் ஹீலியத்தின் கரைதிறன் குறைவாகும். மேலும் ஹீலியம் அணுக்களின் சிறிய உருவளவின் காரணமாக, அவை, செல்சுவரின் வழியாக, அவற்றை பாதிக்காமல் ஊடுருவ முடியும். இரத்தத்தில் அதிகப்படியான ஆக்ஸிஜன் கரைந்திருப்பின் அது வளர்சிதை மாற்றத்திற்கு பயன்படுத்தப்படுகிறது, மேலும் அவை வளைவு நிலையை உருவாக்குவதில்லை
1. ஹென்றி விதியின் வரம்புகள்:
● ஹென்றி விதியானது, மிதமான வெப்பநிலை மற்றும் அழுத்த நிலைகளில் மட்டுமே பொருந்தக்கூடியது.
● குறைந்த கரைதிறன் கொண்ட வாயுக்கள் மட்டுமே ஹென்றி விதிக்கு உட்படுகின்றன.
● கரைப்பான்களுடன் வினைபுரியக்கூடிய வாயுக்கள் ஹென்றி விதிக்கு உட்படுவதில்லை. எடுத்துக்காட்டாக, அம்மோனியா மற்றும் HCl ஆகியவை நீருடன் வினைபுரிவதால், ஹென்றி விதிக்கு உட்படுவதில்லை.
NH3 + H2O ⇌ NH4+ + OH-
● ஹென்றி விதிக்கு உட்படும் வாயுக்கள், கரைப்பானில் கரைக்கப்படும்போது, இணையவோ அல்லது பிரிகையடையவோ கூடாது.
எடுத்துக்காட்டு கணக்கு:
0.24 g வாயுவானது 1.5 atm அழுத்தத்தில் 1 லிட்டர் நீரில் கரைகிறது. மாறாத வெப்பநிலையில், அழுத்தத்தை 6 atm க்கு அதிகரிக்கும்போது கரைக்கப்படும் வாயுவின் எடையை கணக்கிடுக.
Pகரைபொருள் = KHXகரைசலில் உள்ள கரைபொருள்
1.5 atm அழுத்தத்தில்
P1 = KHx1 -------- (1)
6 atm அழுத்தத்தில்
P2 = KHx2 -------- (2)
சமன்பாடு (1) ஐ (2) ஆல் வகுக்க
P1/ P2 = x1/ x2
1.5/6.0 = 0.24/x2
எனவே x2 = 0.24 × 6.0/1.5 = 0.96 g/L
தன்மதிப்பீடு
7. 1 atm அழுத்தத்தில் 20% O2 மற்றும் 80% N2 கனஅளவு வீதத்தை கொண்டுள்ள காற்றானது, நீருடன் சமநிலையில் இருக்கும்போது, 298 K. வெப்பநிலையில், நீரில் கரைந்துள்ள O2 மற்றும் N2 ஆகியவற்றின் கனஅளவு சதவீதத்தை கணக்கிடுக. இவ்விரண்டு வாயுக்களின் ஹென்றி மாறிலிகளின் மதிப்புகள் முறையே KH (O2) = 4.6 × 104 atm மற்றும் KH (N2) = 8.5× 104 atm .
தீர்வு:
மொத்த அழுத்தம் = 1 atm
PN2 = (80/100) × அதிக அழுத்தம் = 80/100 × 1 atm = 0.8 atm
P O2 = (20/100) × 1 = 0.2 atm
ஹென்றி விதிப்படி Pகரைபொருள் = KHX கரைசலில் கரைபொருள்
ஃ PN2 = (KH)நைட்ரஜன் × கரைசலில் நைட்ரஜனின் மோல் பின்னம்
0.8 / 8.5 × 104 = XN2
XN2 = 9.4 × 10-6
இதைப்போலவே
XO2 = 0.2 / 4.6 × 104
= 4.3 × 10-6
8. நீர்வாழ் விலங்குகள் கோடைக்காலத்தில் வெதுவெதுப்பான நீரில் இருப்பதைக் காட்டிலும், குளிர்காலத்தில் குளிர்ந்த நீரில் வசதியாக உணர்கின்றன ஏன் ? விளக்குக.
தீர்வு:
வெப்பநிலை அதிகரிக்கும் போது திரவத்தில் ஒரு வாயுவின் கரைதிறன் குறைகிறது. எனவே வெது வெதுப்பான நீரைக் காட்டிலும் குளிர்ந்த நீரில் ஆக்சிஜனின் கரைதிறன் மற்றும் கரைந்துள்ள ஆக்சிஜனின் அளவு அதிகம். எனவே நீர்வாழ் விலங்குகள் குளிர்ந்த நீரில் வசதியாக உணர்கின்றன.