11 வது வேதியியல் : அலகு 9 : கரைசல்கள்
நல்லியல்பு மற்றும் இயல்புக் கரைசல்கள்
நல்லியல்பு மற்றும் இயல்புக் கரைசல்கள்
1. நல்லியல்புக் கரைசல்கள்:
கரைசலில் உள்ள ஒவ்வொரு கூறும் அதாவது கரைபொருள் மற்றும் கரைப்பான் ஆகியன, செறிவு எல்லை முழுமைக்கும் ரௌல்ட் விதிக்கு உட்பட்டிருக்குமாயின் அக்கரைசலானது நல்லியல்புக் கரைசல் என்றழைக்கப்படுகிறது. நடைமுறையில், எந்த கரைசலும், செறிவு எல்லை முழுமைக்கும், நல்லியல்பு தன்மையைக்கொண்டிருப்பதில்லை. எனினும், கரைபொருளின் செறிவு மிகக்குறைவாக இருக்கும்போது அத்தகைய நீர்த்த கரைசல்கள் நல்லியல்பை பெற்றுள்ளன. கரைசலில் உள்ள இரண்டு கூறுகளும் ஒத்த உருவளவு, ஒத்த வடிமைப்பு, மற்றும் அவற்றிற்கிடையே ஏறத்தாழ ஒரேமாதிரியான மூலக்கூறிடை விசைகளை கொண்டிருக்குமானால் (அதாவது A-A, B-B மற்றும் B-A இடையேயான விசைகள்) அவை நல்லியல்புக் கரைசல்களுக்குரிய பண்புகளை பெற முயல்கின்றன.
ஒரு நல்லியல்பு கரைசலுக்கு,
i) இரண்டு கூறுகளை (கரைபொருள் & கரைப்பான்) கலக்கும்போது கனஅளவில் மாற்றம் இருப்பதில்லை (ΔVகலத்தல் = 0)
ii) கரைபொருளை கரைப்பானில் கரைக்கும்போது, வெப்பப் பரிமாற்றம் நிகழ்வதில்லை. (ΔHகலத்தல் = 0).
iii) தூயதிரவங்களில் உள்ளதைப் போன்றே, கரைசலிலுள்ள கரைபொருள் மற்றும் கரைப்பான் ஆகியவற்றின் தப்பிச்செல்லும் திறன் (Escaping tendency), இருக்க வேண்டும்.
நல்லியல்பு கரைசல்களுக்கு எடுத்துக்காட்டுகள்:
(பென்சீன் & டொலுயீன்); (n-ஹெக்சேன் & n-ஹெப்டேன்); (எத்தில் புரோமைடு & எத்தில் அயோடைடு); (குளோரோபென்சீன் & புரோமோ பென்சீன்)
2. இயல்புக் கரைசல்கள்
செறிவு எல்லை முழுமைக்கும் ரௌல்ட் விதிக்கு உட்படாத கரைசல்கள் இயல்புக்கரைசல்கள் என்றழைக்கப்படுகின்றன. ஒரு இயல்புக் கரைசலுக்கு, கலத்தலின் போது கனஅளவு மற்றும் என்தால்பி மாற்றம் நிகழ்கிறது. அதாவது ΔΗகலத்தல் ≠ 0 & ΔVகலத்தல் ≠ 0 ரௌல்ட் விதியிலிருந்து, இயல்புக்கரைசல்கள் விலக்கமடைதலானது நேர்விலக்கமாகவோ அல்லது எதிர்விலக்கமாகவோ இருக்கும்.
இயல்புக் கரைசல்கள் - ரௌல்ட் விதியிலிருந்து நேர் விலக்கம்:
ரௌல்ட் விதியிலிருந்து விலகலடையும் தன்மையை, கரைப்பான்(A) மற்றும் கரைபொருள்(B) ஆகியனவற்றின் மூலக்கூறுகளுக்கு இடைப்பட்ட இடையீடுகளின் அடிப்படையில் விளக்க முடியும். A ன் மூலக்கூறுகள் மற்றும் Bன் மூலக்கூறுகள் ஆகியவற்றில் காணப்படும் கவர்ச்சி விசைகள் (A-A) மற்றும் (B-B) ஆகியவற்றைவிட A மற்றும் B ஆகிய மூலக்கூறுகளுக்கு இடையே காணப்படும் கவர்ச்சி விசை (A-B) குறைவாக உள்ள ஒரு நேர்வை கருதுவோம். A மற்றும் B ஆகியனவற்றால் உருவாகும் நல்லியல்புக் கரைசலைக் காட்டிலும் மேற்கொண்டுள்ள நேர்வில் உருவாகும். கரைசலில் உள்ள மூலக்கூறுகளின் தப்பிச்செல்லும் தன்மையானது அதிகமாக இருக்கும். இதன் விளைவாக, இத்தகைய இயல்புக்கரைசல்களின் ஆவிஅழுத்தம் அதிகரிக்கிறது. மேலும் இது, ரௌல்ட் விதியின் மூலம் கணிக்கப்பட்ட A மற்றும் B ஆகியவற்றின் ஆவிஅழுத்தங்களின் கூடுதலைவிட அதிகமாக உள்ளது. இந்த வகை விலக்கமானது நேர்குறி விலக்கம் என்றழைக்கப்படுகிறது.
இங்கு, PA > PoA XA மற்றும் PB > PoB XB
எனவே
Pமொத்தம் > PoA XA + PoB XB ------ (9.19)
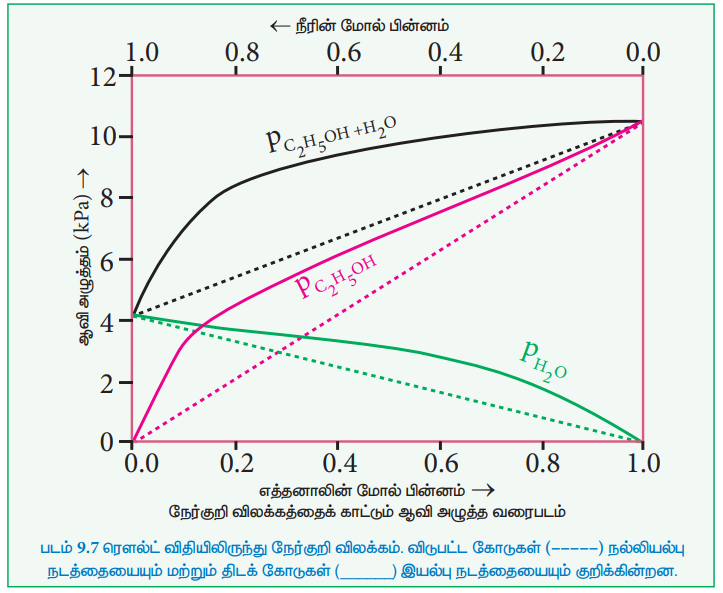
எத்தில் ஆல்கஹால் மற்றும் நீர் அடங்கிய கரைசலை எடுத்துக்காட்டாக கொண்டு நேர்விலக்கத்தை புரிந்து கொள்வோம். இந்த கரைசலில் எத்தனால் மற்றும் நீர் மூலக்கூறுகளுக்கிடையே காணப்படும் ஹைட்ரஜன் பிணைப்பு இடையீடானது அவைகளின் தனித்த மூலக்கூறுகளுக்கிடையே (எத்தில் ஆல்கஹால்- எத்தில் ஆல்கஹால் மற்றும் நீர் -நீர்) காணப்படும் ஹைட்ரஜன் பிணைப்பு இடையீடுகளை விட வலிமை குறைந்தது. இதன்விளைவாக, நீர்த்த எத்தனால் கரைசலில் உள்ள இரண்டு கூறுகளின் (எத்தனால் மற்றும் நீர்) ஆவியாகும் தன்மையையும் அதிகரிக்கிறது. எனவே, கரைசலின் ஆவிஅழுத்தமானது, ரௌலட் விதியின் மூலம் கணிக்கப்பட்ட ஆவிஅழுத்தத்தை விட அதிகமாக உள்ளது. இங்கு, கலத்தல் செயல்முறையானது வெப்பம்கொள் செயல்முறையாகும். அதாவது ΔHகலத்தல் > 0 மேலும் இங்கு சிறிய அளவில் கனஅளவு அதிகரிப்பு ஏற்படுகிறது. (ΔVகலத்தல் > 0).
நேர் விலக்கம் காட்டும் இயல்புக்கரைசல்களுக்கான எடுத்துக்காட்டுகள்:
(எத்தில் ஆல்கஹால் & வளைய ஹெக்சேன்), (பென்சீன் & அசிட்டோன்), (கார்பன் டெட்ரா குளோரைடு & குளோரோஃபார்ம்), (அசிட்டோன் & எத்தில் ஆல்கஹால்), (எத்தில் ஆல்கஹால் & நீர்).
இயல்புக் கரைசல்கள் - ரௌல்ட் விதியிலிருந்து எதிர் விலக்கம்:
தனித்தனி மூலக்கூறுகளுக்கிடையே (A-A & B-B) காணப்படும் கவர்ச்சி விசைகளை விட கரைபொருள் (A) மற்றும் கரைப்பான் (B) ஆகியவற்றிற்கிடையே உள்ள கவர்ச்சிவிசை அதிகமாக உள்ள ஒரு இயல்புக் கரைசலைக் கருதுவோம். A மற்றும் B ஆகியவற்றால் உருவாக்கப்பட்ட நல்லியல்புக் கரைசலுடன் ஒப்பிடும்போது, மேற்கண்டுள்ள இயல்புக் கரைசலில் உள்ள A மற்றும் B ஆகியவற்றின் தப்பித்துச் செல்லும் திறன் குறைவாக உள்ளது. எனவே, இதன் விளைவாக, இத்தகைய இயல்புக்கரைசல்களின் ஆவிஅழுத்தம், A மற்றும் B ஆகியவற்றின் ஆவிஅழுத்தங்களின் கூடுதலைவிட குறைவாக உள்ளது. இந்த வகை விலக்கமானது எதிர்குறி விலக்கம் என்றழைக்கப்படுகிறது.
எதிர்குறி விலக்கத்திற்கு
PA < PoA XA மற்றும் PB < PoB XB
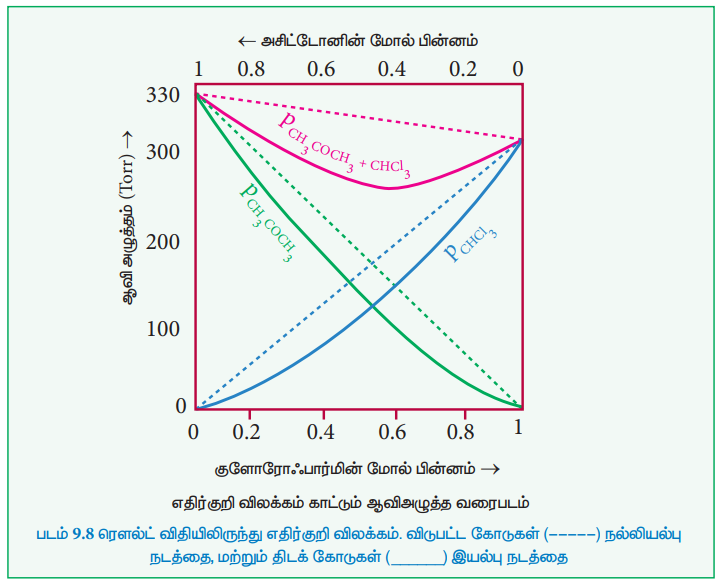
பீனால் மற்றும் அனிலீன் கலந்த கரைசலை நாம் கருதுவோம். பீனால் ம
ற்றும் அனிலீன் ஆகிய இரண்டிலும் மூலக்கூறுகளுக்கு இடையே ஹைட்ரஜன் பிணைப்பு காணப்படுகிறது. எனினும், அனிலீனுடன் கலக்கும்போது, பீனால் மூலக்கூறுகள், தங்களுக்குள் உருவான ஹைட்ரஜன் பிணைப்புகளைவிட வலுவான ஹைட்ரஜன் பிணைப்பிணை அனிலீன் மூலக்கூறுகளுடன் உருவாக்குகின்றன. புதிய ஹைட்ரஜன் பிணைப்பு உருவாக்கமானது, பீனால் மற்றும் அனிலீன் மூலக்கூறுகளின் கரைசலிலிருந்து தப்பித்துச் செல்லும் திறனை கணிசமாக குறைக்கிறது. இதன் விளைவாக, கரைசலின் ஆவிஅழுத்தம் குறைகிறது. மேலும் கலத்தலின் போது கனஅளவு சிறிது குறைகிறது. (ΔVகலத்தல் < 0). இச்செயல்முறையின்போது வெப்பஉமிழ்வு நிகழ்கிறது. அதாவது, ΔH கலத்தல் < 0 (வெப்பம் உமிழ் வினை)
எதிர் விலக்கம் காட்டும் இயல்புக்கரைசல்களுக்கு எடுத்துக்காட்டுகள்:
அசிட்டோன் + குளோரோஃபார்ம், குளோரோஃபார்ம் + டைஎத்தில் ஈதர், அசிட்டோன் + அனிலீன், குளோரோஃபார்ம் + பென்சீன்.
3. ரௌல்ட் விதியிலிருந்து விலகலடைவதற்கு காரணமான காரணிகள்
கரைசல்கள், நல்லியல்பு நடத்தையிலிருந்து விலகலடைவதற்கு பின்வரும் காரணிகள் காரணமாகின்றன.
i) கரைபொருள் -கரைப்பான் இடையீடுகள்
ஒரு நல்லியல்பு கரைசலுக்கு கரைப்பான் மூலக்கூறுகளுக்கிடைப்பட்ட (A-A), கரைபொருள் மூலக்கூறுகளுக்கிடைப்பட்ட(B-B) மற்றும் கரைப்பான், கரைபொருள் மூலக்கூறுகளுக்கிடைப்பட்ட (A-B) இடையீடுகள் ஒரேமாதிரியாக இருக்க வேண்டும் என எதிர்பார்க்கப்படுகிறது. அவ்வாறில்லாமல் இந்த இடையீடுகள் வேறுபட்டிருப்பின், நல்லியல்பு தன்மையிலிருந்து விலக்கமடைதல் நிகழும்.
ii) கரைபொருள் பிரிகையடைதல்
கரைசலிலுள்ள கரைபொருளானது, பிரிகையடைந்து அதன் உட்கூறு அயனிகளை தரும்போது, அந்த அயனிகளானவை, கரைப்பானுடன் வலுவாக இடையீடு செய்கின்றன. இதன் காரணமாக ரௌல்ட் விதியிலிருந்து விலகலடைகிறது எடுத்துக்காட்டாக, பொட்டாசியம் குளோரைடின் நீர்க்கரைசலைக் கருதுவோம். இந்த கரைசலில் கரைபொருள் பிரிகையடைந்து, K+ மற்றும் Cl- அயனிகளை தருகிறது. இவை நீர் மூலக்கூறுகளுடன் வலுவான அயனி - இருமுனை இடையீடுகளை உருவாக்குகிறது. எனவே இக்கரைசல் நல்லியல்புத் தன்மையிலிருந்து விலகலடைகிறது.
KCl (s) + H2O (l) + K+ (aq) + Cl- (aq)
iii) கரைபொருள் இணைதல்
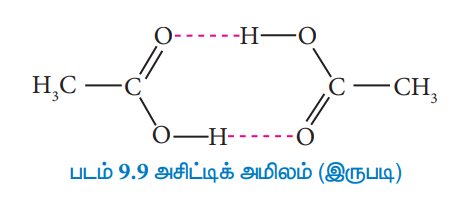
கரைபொருள் இணைதலும், ஒரு கரைசலை நல்லியல்பு தன்மையிலிருந்து விலகலடையச் செய்யும். எடுத்துக்காட்டாக, கரைசல்களில், மூலக்கூறுகளுக்கிடைப்பட்ட ஹைட்ரஜன் பிணைப்பை உருவாக்குவதன் காரணமாக அசிட்டிக் அமிலமானது இருபடி மூலக்கூறாக காணப்படுகிறது. எனவே ரௌலட் விதியிலிருந்து விலகலடைகிறது.
iv) வெப்பநிலை
கரைசலின் வெப்பநிலை அதிகரிப்பானது, அதிலுள்ள மூலக்கூறுகளின் சராசரி இயக்க ஆற்றலை அதிகரிக்கிறது. இதனால், அவற்றிற்கிடையே காணப்படும் கவர்ச்சிவிசைகள் குறைகின்றன. இதன் விளைவாக கரைசல் நல்லியல்புத் தன்மையிலிருந்து விலகலடைகிறது.
v) அழுத்தம்
அதிக அழுத்தத்தில், மூலக்கூறுகள் ஒன்றுக்கொன்று, அருகருகே இருக்க முற்படுகின்றன. இதனால் அவற்றின் மூலக்கூறுகளுக்கிடைப்பட்ட கவர்ச்சி அதிகரிக்கிறது. எனவே அதிக அழுத்தத்தில் கரைசலானது ரௌல்ட் விதியிலிருந்து விலகலடைகிறது.
vi) செறிவு
கரைசலை போதுமான அளவு நீர்க்கச் செய்யும்போது, அக்கரைசலில் உள்ள கரைப்பான் - கரைபொருள் இடையீடுகள் குறிப்பிடத்தகுந்தளவு இருப்பதில்லை, ஏனெனில் கரைப்பான் மூலக்கூறுகளுடன் ஒப்பிடும்போது கரைபொருள் மூலக்கூறுகளின் எண்ணிக்கை மிகக் குறைவு. கரைபொருளைச் சேர்த்து செறிவை அதிகரிக்கும்போது, கரைப்பான் - கரைபொருள் இடையீடு முக்கியத்துவம் வாய்ந்ததாகிறது. இதன் விளைவாக ரௌல்ட் விதியிலிருந்து விலகலடைகிறது.
தன் மதிப்பீடு
9. 128 கிராம் நாஃப்தலினை 39 கிராம் பென்சீனுடன் சேர்த்து, நல்லியல்பு திரவக் கரைசலை உருவாக்கும்போது, ஆவிநிலையிலுள்ள பென்சீன் மற்றும் நாஃப்தலீனின் மோல் பின்னங்களை கணக்கிடுக. 300 K வெப்பநிலையில், தூய பென்சீனின் ஆவிஅழுத்தம் 50.71 mmHg மற்றும் தூய நாஃப்தலீனின் ஆவிஅழுத்தம் 32.06 mmHg
தீர்வு:
