11 வது வேதியியல் : அலகு 9 : கரைசல்கள்
கணக்குகளுக்கான தீர்வுகள்: கரைசல்கள்
எடுத்துக்காட்டு கணக்கு
1. 500 மி.லி 2.5 M HCl கரைசலைப் பெறுவதற்கு, 4M HCl மற்றும் 2M HCl கரைசல்களை எந்த கன அளவுகளில் கலக்க வேண்டும்?
தீர்வு: 500 மி.லி 2.5 M HCl கரைசலை தயாரிக்க தேவைப்படும், 4M HCl இன் கன அளவு = x மி.லி. என்க.
எனவே தேவைப்படும் 2M HCl இன் கன அளவு = (500 - x) மி.லி.
சமன்பாடு (9.1) லிருந்து
C1V1 + C2V2 = C3V3
(4x) + 2(500-x) = 2.5 × 500
4x + 1000-2x = 1250
2x = 1250 – 1000
x = 250/2
x = 125 mL
எனவே, தேவைப்படும் 4M HCl இன் கனஅளவு = 125 மி.லி.
தேவைப்படும் 2M HCl இன் கனஅளவு = (500 – 125) மி.லி.

= 375 மி.லி.
எடுத்துக்காட்டு கணக்கு:
0.24 g வாயுவானது 1.5 atm அழுத்தத்தில் 1 லிட்டர் நீரில் கரைகிறது. மாறாத வெப்பநிலையில், அழுத்தத்தை 6 atm க்கு அதிகரிக்கும்போது கரைக்கப்படும் வாயுவின் எடையை கணக்கிடுக.
Pகரைபொருள் = KHXகரைசலில் உள்ள கரைபொருள்
1.5 atm அழுத்தத்தில்
P1 = KHx1 -------- (1)
6 atm அழுத்தத்தில்
P2 = KHx2 -------- (2)
சமன்பாடு (1) ஐ (2) ஆல் வகுக்க
P1/ P2 = x1/ x2
1.5/6.0 = 0.24/x2
எனவே x2 = 0.24 × 6.0/1.5 = 0.96 g/L
கணக்கு:
2% எளிதில் ஆவியாகாத கரைபொருளை கொண்டுள்ள நீர்க் கரைசலானது, கரைப்பானின் கொதிநிலையில், 1.004 bar அழுத்தத்தை கொண்டுள்ளது. PAo மதிப்பு 1.013 bar ஆக இருக்கும்போது கரைபொருளின் மோலார் நிறை என்ன?
ΔΡ / PoA = WB × MA / MB × WA
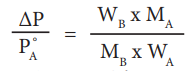
2 % கரைசலில் கரைபொருளின் எடை 2 கிராம், மற்றும் கரைப்பானின் எடை 98 கி.
ΔΡ = PoA - Ρகரைசல் = 1.013- 1.004 bar = 0.009 bar
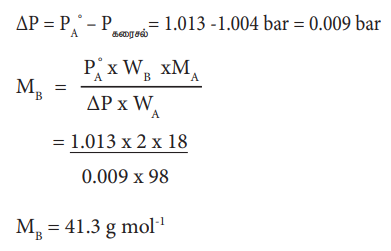
MB = 41.3g mol-1
கணக்கு – 5
குளிர்பிரதேசங்களில் பயணிக்கும் கார்களின் ரேடியேட்டர்களில், உறைதடுப்பானாக எத்திலீன் கிளைக்காலை (C2H6O2) பயன்படுத்த முடியும். ஒரு கார் ரேடியேட்டரில், பயன்படுத்தப்பட்டுள்ள, 20 நிறை சதவீத கிளைக்காலின் நீர்க் கரைசலிலிருந்து பனிக்கட்டி படிகங்கள் உருவாகிபிரியும்போது உள்ள வெப்பநிலையை கணக்கிடுக. நீரின் Kf மதிப்பு 1.86 K Kg mol-1 மற்றும் எத்திலீன் கிளைக்காலின் மோலார் நிறை 62 g mol-1
கரைசலின் 20 நிறை சதவீதம் என்பதற்க்கு 20 கிராம் எத்திலீன் கிளைக்கால் 100 கிராம் கரைசலில் உள்ளது எனப்பொருள்.
கரைபொருளின் எடை (W2) = 20கி
கரைப்பானின் எடை (நீர்) W1 = 100 - 20 = 80கி
ΔTf = Kf m
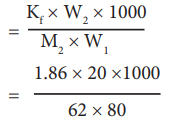
= 7.5 K
எந்த வெப்பநிலையில், பனிக்கட்டி படிகங்கள் உருவாகி பிரிகின்றனவோ அதுவே, கரைபொருளை சேர்த்த பின்னர் நீரின் உறைநிலை ஆகும். அதாவது, சாதாரண உறைநிலையை விட 7.5 K குறைவு. (273-7.5K) = 265.5 K
கணக்கு:
2% எளிதில் ஆவியாகாத கரைபொருளை கொண்டுள்ள நீர்க் கரைசலானது, கரைப்பானின் கொதிநிலையில், 1.004 bar அழுத்தத்தை கொண்டுள்ளது. PAo மதிப்பு 1.013 bar ஆக இருக்கும்போது கரைபொருளின் மோலார் நிறை என்ன?
ΔΡ / PoA = WB × MA / MB × WA
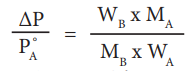
2 % கரைசலில் கரைபொருளின் எடை 2 கிராம், மற்றும் கரைப்பானின் எடை 98 கி.
ΔΡ = PoA - Ρகரைசல் = 1.013- 1.004 bar = 0.009 bar
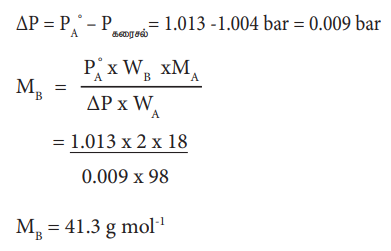
MB = 41.3g mol-1
கணக்கு- 4
0.75 கிராம் எடையுடைய பெயர் தெரியாத சேர்மமானது 200 கிராம் கரைப்பானில் கரைக்கப்படுகிறது. கொதிநிலை ஏற்ற மதிப்பு 0.15 K மற்றும் மோலால் கொதிநிலை ஏற்ற மாறிலி மதிப்பு 7.5 K Kg mol-1 எனில், அச்சேர்மத்தின் மோலார் நிறையை கணக்கிடுக.
ΔTb = Kb m
= Kb × W2 × 1000 / M2 × W1
M2 = Kb × W2 × 1000 / ΔTb × W1
= 7.5 × 0.75 × 1000 / 0.15 × 200
= 187.5 g mol-1
கணக்கு – 5
குளிர்பிரதேசங்களில் பயணிக்கும் கார்களின் ரேடியேட்டர்களில், உறைதடுப்பானாக எத்திலீன் கிளைக்காலை (C2H6O2) பயன்படுத்த முடியும். ஒரு கார் ரேடியேட்டரில், பயன்படுத்தப்பட்டுள்ள, 20 நிறை சதவீத கிளைக்காலின் நீர்க் கரைசலிலிருந்து பனிக்கட்டி படிகங்கள் உருவாகிபிரியும்போது உள்ள வெப்பநிலையை கணக்கிடுக. நீரின் Kf மதிப்பு 1.86 K Kg mol-1 மற்றும் எத்திலீன் கிளைக்காலின் மோலார் நிறை 62 g mol-1
கரைசலின் 20 நிறை சதவீதம் என்பதற்க்கு 20 கிராம் எத்திலீன் கிளைக்கால் 100 கிராம் கரைசலில் உள்ளது எனப்பொருள்.
கரைபொருளின் எடை (W2) = 20கி
கரைப்பானின் எடை (நீர்) W1 = 100 - 20 = 80கி
ΔTf = Kf m
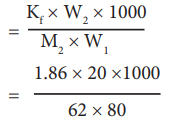
= 7.5 K
எந்த வெப்பநிலையில், பனிக்கட்டி படிகங்கள் உருவாகி பிரிகின்றனவோ அதுவே, கரைபொருளை சேர்த்த பின்னர் நீரின் உறைநிலை ஆகும். அதாவது, சாதாரண உறைநிலையை விட 7.5 K குறைவு. (273-7.5K) = 265.5 K
கணக்கு-6 :
400K வெப்பநிலையில் 1.5 கிராம் நிறையுடைய பெயர் அறியா கரைபொருளானது, தகுந்த கரைப்பானில் கரைக்கப்படுகிறது. மேலும் இந்த கரைசலானது 1.5 லி க்கு நீர்க்கப்படுகிறது. இதன் சவ்வூடுபரவல் அழுத்தம் 0.3 bar என கண்டறியப்பட்டுள்ளது. அக்கரைபொருளின் மோலார் நிறையைக் கணக்கிடுக.
மோலார் நிறை = பெயர் அறியா பொருளின் நிறை × RT / சவ்வூடு பரவல் அழுத்தம் × கரைசலின் கனஅளவு
= 1.5 × 8.314 × 10-2 × 400 / 0.3×1.5
= 110.85 g mol-1

கணக்கு - 7
200 கிராம் நீரில் 1 கிராம் NaCl ஐ கரைப்பதன்மூலம், 0.24 K உறைநிலைத் தாழ்வு ஏற்படுத்தப்பட்டது. வாண்ட்ஹாஃப் கரணியைக் கணக்கிடுக. மோலால் உறைநிலைத் தாழ்வு மாறிலி மதிப்பு 1.86 K Kg mol-1
கரைபொருளின் மோலார் நிறை

= 38.75g mol-1
= 38.75g mol-
NaCl யின் கருத்தியலான மோலார் நிறை = 58.5
i = கருத்தியலான மோலார் நிறை / அளவிடப்பட்ட மோலார் நிறை = 58.5 / 38.75
= 1.50