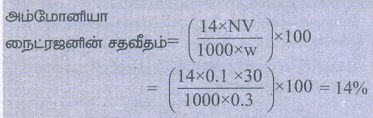வேதியியல் - எடுத்துக்காட்டு கணக்கு: கரிம வேதியியலின் அடிப்படைகள் | 11th Chemistry : UNIT 11 : Fundamentals of Organic Chemistry
11 வது வேதியியல் : அலகு 11 : கரிம வேதியியலின் அடிப்படைகள்
எடுத்துக்காட்டு கணக்கு: கரிம வேதியியலின் அடிப்படைகள்
எடுத்துக்காட்டு கணக்கு: 1
0.26g நிறையுள்ள கரிமசேர்மம் எரிக்கப்படும்போது 0.039g நீரினையும், 0.245g கார்பன் டை ஆக்சைடினையும் தருகிறது. அச்சேர்மத்திலுள்ள C மற்றும் H ன் சதவீதத்தினை கணக்கிடுக.
கரிம சேர்மத்தின் எடை = 0.26 g
நீரின் எடை = 0.039g
CO2 ன் எடை = 0.245g
ஹைட்ரஜனின் சதவீதம்
18g நீரில் உள்ள ஹைட்ரஜனின் எடை = 2g
0.39 நீரில் உள்ள ஹைட்ரஜனின் எடை = 2/18 × 0.039
எனவே 0.26 g கரிம சேர்மத்திலுள்ள ஹைட்ரஜனின் சதவீதம்
= 0.039/0.26 × 2/18 × 100 = 1.66%
கார்பனின் சதவீதம்
44g CO2 ல் உள்ள Cன் எடை = 12
0.245 g of CO2 ல் உள்ள Cன் எடை = 12/44 × 0.245g
எனவே 0.26 g கரிம சேர்மத்திலுள்ள C ன் சதவீதம்
= 12/44 × 0.245/0.26 × 100 = 25.69%
எடுத்துக்காட்டு – 2
காரியஸ் முறைப்படி அளந்தறிதலில், 0.2175 g நிறையுள்ள சல்பரைக் கொண்டுள்ள கரிமச் சேர்மம் ஆனது 0.5825g BaSO4 யைக் கொடுக்கிறது எனில் அச்சேர்மத்தில் உள்ள S ன் சதவீதத்தினை கணக்கிடுக.
கரிம சேர்மத்தின் எடை= 0.2175 g
BaSO4 ன் எடை = 0.5825 g
233 g BaSO4 ல் உள்ள S ன் எடை = 32 g
0.5825 g BaSO4 ல் உள்ள
S ன் எடை = (32/233) × 0.5825
S ன்% = (32/233) × ( 0.5825/0.2175) × 100
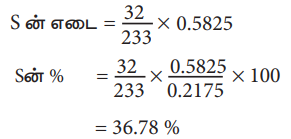
= 36.78 %
எடுத்துக்காட்டு :
காரியஸ் முறைப்படி அளந்தறிதலில், 0.284 g எடையுள்ள கரிமச்சேர்மம் 0.287 g எடையுள்ள AgCl யை தருகிறது எனில், Cl ன் சதவீதத்தைக் காண்க.
கரிமச் சேர்மத்தின் எடை = 0.284 g
AgCl ன் எடை = 0.287 g
143.5 g AgCl ல் உள்ள குளோரின் எடை = 35.5 g
0.287 g AgCl ல் உள்ள குளோரின் எடை = 35.5 / 143.5 × 0.287 g
Cl ன் சதவீதம் = 35.5/143.5 × 0.287/0.284 × 100 = 24.98%
எடுத்துக்காட்டு 4: 0.24 g எடையுள்ள பாஸ்பரஸை கொண்டுள்ள கரிமச் சேர்மம் 0.66g Mg2P2O7 யை தந்தது. இச்சேர்மத்தில் உள்ள பாஸ்பரஸின் சதவீதத்தினை கணக்கிடுக.
கரிம சேர்மத்தின் எடை = 0.24 g
Mg2P2O7 ன் எடை = 0.66 g
222g Mg2P2O7 ல் 62 g P உள்ளது
0.66gல் (62/222 × 0.66) g P உள்ளது.
w g கரிமச் சேர்மத்திலுள்ள P ன் சதவீதம் = 62/222 × 0.66/0.24 × 100% = 76.80%
எடுத்துக்காட்டு: 0.1688g எடையுள்ள சேர்மம் டுமாஸ் முறையில் பகுப்பிற்கு உட்படும்போது 140C, 758 mm Hg யில் 31.7ml ஈரமான நைட்ரஜனை தருகிறது, எனில் அச்சேர்மத்தில் உள்ள நைட்ரஜனின் சதவீதத்தினை கணக்கிடுக.
கரிமச் சேர்மத்தின் எடை = 0.168g
ஈரமான நைட்ரஜனின் கன அளவு (V1) = 31.7mL
= 31.7 × 10-3 L
வெப்பநிலை (T1) = 14°C
= 14 + 273
= 287K
ஈரமான நைட்ரஜனின் அழுத்தம் = 758 mm Hg
14°C யில் நீர்ம அழுத்தம் = 12 mm of Hg
ஃ உலர் நைட்ரஜனின் அழுத்தம் = (P-P1)
= 758 – 12
= 746 mm Hg

= 21.90%
எடுத்துக்காட்டு - 6;
கெல்டால் முறைக்கு உட்படுத்தப்பட்ட 0.6g எடையுள்ள கரிம சேர்மத்தால் வெளியிடப்பட்ட NH3 வாயு 50ml செமி நார்மல் (semi normal) H2SO4 ஆல் உறிஞ்சப்படுகிறது. மீதமுள்ள அமில கரைசல், வாலை வடிநீரால் நீர்க்கப்பட்டு, கரைசலின் கனஅளவு 150 மிலி ஆக மாற்றப்படுகிறது. 20 மி.லி நீர்க்கப்பட்ட கரைசலை முழுமையாக நடுநிலையாக்க 35 மிலி (N/20) NaOH கரைசல் தேவைப்பட்டது எனில், நைட்ரஜனின் சதவீதத்தை கணக்கீடு.
கரிம சேர்மத்தின் எடை = 0.6g
எடுத்துக்கொண்ட H2SO4 ன் பருமன் = 50 மி.லி
எடுத்துக்கொண்ட H2SO4 ன் திறன் = 0.5 N
வினைபுரியாத, 20ml நீர்த்த H2SO4 அமிலக் கரைசல், 35ml 0.05N சோடியம் ஹைட்ராக்சைடு கரைசலால் நடுநிலையாக்கப்பட்டது எனில்,
நீர்க்கப்பட்ட சல்ஃபியூரிக் அமிலத்தின் திறன்
= 35 × 0.05 / 20
= 0.0875 N
கரிம சேர்மத்துடன் வினைபட்டு எஞ்சிய
H2SO4 ன் பருமன் = V1 mL
H2SO4 ன் திறன் = 0.5N
நீர்க்கப்பட்ட H2SO4 ன் பருமன் = 150 mL
நீர்க்கப்பட்ட சல்ஃபியூரிக் அமிலத்தின் திறன் = 0.0875 N
V1 = 150 × 0.087 / 0.5 = 26.25 mL
அம்மோனியாவால் உறிஞ்சப்பட்ட H2SO4 ன் பருமன் = 23.75 mL
23.75 mL 0.5 N H2SO4 ≡ 23.75 mL 0.5N NH3
0.6g கரிமச் சேர்மத்தில் நைட்ரஜனின் எடை

= 27.66 %
புத்தக பயிற்சி கணக்குகள்
47. 0.30g கரிமச்சேர்மம் 0.88g கார்பன்டைஆக்ஸைடு மற்றும் 0.54g நீரினைத் தருகிறது. அச்சேர்மத்தில் உள்ள கார்பன் மற்றும் ஹைட்ரஜனின் சதவீதத்தினைக் காண்க.
விடை
கரிம சேர்மத்தின் நிறை (w) = 0.30g
H2O ன் எடை (x) = 0.54g
CO2 ன் எடை (y) = 0.88g
கார்பனின் சதவிகிதம் = 12/44 × y/w × 100

48. கெல்டால் முறையில் 0.20g கரிமச் சேர்மத்திலிருந்து வெளிப்படும் அம்மோனியா 15 ml N/20 கந்தக அமிலக் கரைசலால் நடுநிலையாக்கப்படுகிறது. நைட்ரஜனின் சதவீதத்தினைக் காண்க.
விடை
நைட்ரஜன் சதவிகிதம் = 1.4 × அமிலத்தின் நார்மாலிட்டி × அமிலத்தின் கன அளவு / கரிமச் சேர்மத்தின் எடை
அல்லது
N2 ன் % = 1.4 × N1 V1 / w
= 1.4 × 0.05 ×15 / 0.20 = 5.25%

49. 0.32g கரிமச் சேர்மத்தினை புகையும் நைட்ரிக் அமிலம் மற்றும் பேரியம் நைட்ரேட் படிகத்துடன் ஒரு மூடப்பட்ட குழாயில் வெப்பப்படுத்தும் போது, 0.466g பேரியம் சல்பேட் கிடைக்கிறது. அச்சேர்மத்தில் உள்ள கந்தகத்தின் சதவீதத்தினைக் கண்டறிக.
விடை
கரிம சேர்மத்தின் நிறை (w) = 0.32g
BaSO4 நிறை (x) = 0.466g
S ன் சதவிகிதம் = 32/233 × x/w × 100
= 32/233 × 0.466/0.32 × 100 = 20.02%
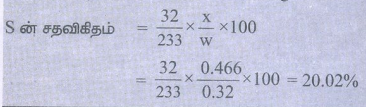
50. காரியஸ் முறையில், 0.24g கரிமச்சேர்மம் 0.287g சில்வர் குளோரைடைத் தருகிறது. அச்சேர்மத்தில் உள்ள குளோரினின் சதவீதத்தினைக் காண்க.
விடை
கரிம சேர்மத்தின் நிறை (w) = 0.24g
AgCl ன் நிறை (x) = 0.287g
Cl ன் சதவிகிதம் = 35.5/143.5 × x/w × 100
= 35.5/143.5 × 0.287/0.24 × 100 = 29.58%
51. டுமாஸ் முறையை பயன்படுத்தி நைட்ரஜனை அளவிடும்போது. 0.35g கரிமச்சேர்மமானது 150° C மற்றும் 760mm Hg அழுத்தத்தில் 20.7mL நைட்ரஜனை தருகிறது. அச்சேர்மத்தில் காணப்படும் நைட்ரஜனின் சதவீதத்தினைக் காண்க.
விடை
நைட்ரஜனின் சதவிகிதம்
= 28 / 22400 × STP ல் N2 கனஅளவு / கரிமச் சேர்மத்தின் எடை × 100
= 28 / 22400 × 0.7 / 0.35 × 100 = 7.39%
தன் மதிப்பீடு
1. பின்வரும் கரிமச் சேர்ம வகைகளுக்கு ஒவ்வொன்றிற்கும் இரு எடுத்துக்காட்டுகள் தருக.
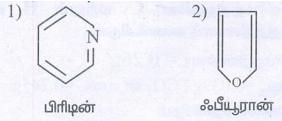
i. பென்சீன் வளைய அமைப்பை பெற்றிருக்காத அரோமேட்டிக் சேர்மம்.
தீர்வு:
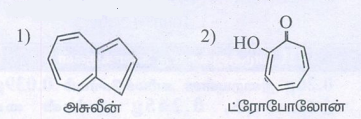
ii. அரோமேட்டிக் பல்லின வளையச் சேர்மம்
தீர்வு:
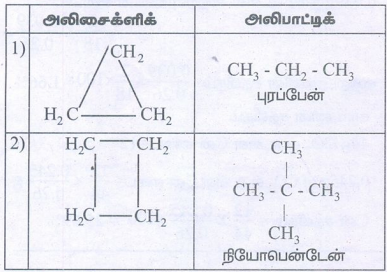
iii. திறந்த அமைப்புடைய அலிசைக்ளிக் மற்றும் அலிபாட்டிக் சேர்மங்கள்
தீர்வு:
தன்மதிப்பீடு
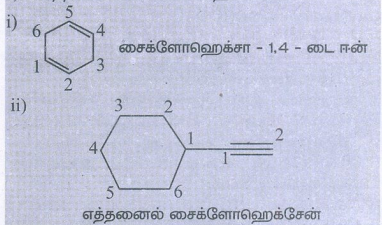
2. பின்வரும் சேர்மங்களுக்கு வடிவ வாய்ப்பாடுகளை எழுதுக.
i. சைக்ளோ ஹெக்ஸா-1, 4-டையீன்
ii. எத்தைனைல் சைக்ளோ ஹெக்ஸேன்
தீர்வு:
தன்மதிப்பீடு
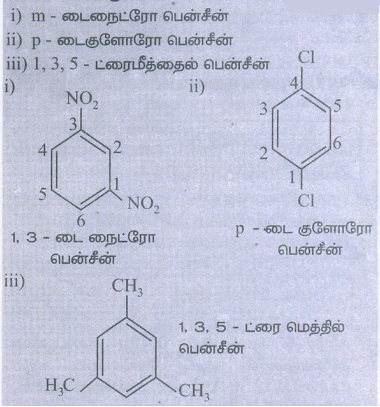
3) பின்வரும் சேர்மங்களுக்கு வடிவ வாய்பாடுகளை எழுதுக.
i. m-டைநைட்ரோ பென்சீன்
ii. P-டைகுளோரோ பென்சீன்
iii. 1,3,5-ட்ரைமீத்தைல் பென்சீன்
தீர்வு:
தன் மதிப்பீடு
4. C4H10O என்ற மூலக்கூறு வாய்ப்பாட்டினைப் பெற்றுள்ள சாத்தியமான மாற்றியங்கள் அனைத்தையும் எழுதுக அவைகளில் காணப்படும் மாற்றியங்களைக் கண்டறிக.
தன்மதிப்பீடு
5. C H மற்றும் O ஆகியனவற்றை கொண்டுள்ள 0.2346g எடையுள்ள கரிமச்சேர்மம் எரிக்கப்படும்போது, 0.2754g நீர் மற்றும் 0.4488g CO2 யை ஆகியவற்றை தருகிறது எனில் அச்சேர்மத்திலுள்ள CH மற்றும் O ன் % இயைபினைக் காண்க.
தீர்வு:
கரிம சேர்மத்தின் நிறை (w) = 0.2346g
நீரின் நிறை (x) = 0.2754g CO2 ன் நிறை (y) = 0.4488g
கார்பனின் சதவிகிதம் = 12/44 × y/w × 100
= 12/44 × 0.4488/0.2346 × 100 = 52.17%
நைட்ரஜனின் சதவிகிதம் = 2/18 × x/w × 100
= 2/18 × 0.2754/0.2346 × 100 = 13.04%
ஆக்ஸிஜனின் சதவிகிதம் = [100-(52.17 + 13.04)]
= 100 - 65.21 = 34.79%
தன்மதிப்பீடு
6. 0.16g எடையுள்ள கரிமச் சேர்மம், காரியஸ் குழாயில் சூடுபடுத்தப்படுகிறது. உருவான H2SO4 ஆனது BaCl2 உடன் சேர்த்து வீழ்படிவாக்கப்படுகிறது. வீழ்படிவான BaSO4 ன் நிறை 0.35g. சல்பரின் நிறை சதவீதத்தை காண்க.
தீர்வு:
கரிம சேர்மத்தின் நிறை (W) = 0.16g
பேரியம் சல்பேட்டின் நிறை (x) = 0.35g
சல்பரின் சதவீதம் = 32/233 × x/w × 100
= 32/233 × 0.35/0.16 × 100 = 30.04%
தன்மதிப்பீடு
1) 0.185g எடையுள்ள கரிமச்சேர்மம், அடர் HNO3 மற்றும் சில்வர் நைட்ரேட்டுன் சேர்ந்து 0.320g வெள்ளி புரோமைடை தந்தது எனில், அதில் உள்ள புரோமினின் % காண்க (Ag = 108, Br = 80)
தீர்வு:
கரிம சேர்மத்தின் நிறை (w) = 0.185g
சில்வர் புரோமைடின் நிறை (x) = 0.320g
புரோமினின் சதவீதம் =
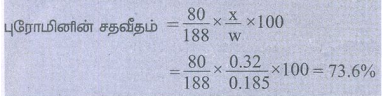
2) காரியஸ் முறையில் 0.40g எடையுள்ள அயோடினால் பதிலீடு செய்யப்பட்ட கரிம சேர்மம் 0.125g AgI யை தருகிறது எனில், அயோடினின் நிறை சதவீதத்தைக் காண்க.
தீர்வு:
கரிம சேர்மத்தின் நிறை (w) = 0.40g
சில்வர் அயோடைடின் நிறை (x) = 0.235g
அயோடினின் சதவீதம் = 127/235 × x/w × 100
= 127/235 × 0.235/0.40 × 100 = 31.75%
தன்மதிப்பீடு
9. பாஸ்பரஸை கொண்டுள்ள 0.33g எடையுள்ள கரிமச் சேர்மம் 0.397g Mg2P2O7 வீழ்படிவைத் தந்தது எனில், அச்சேர்மத்தில் உள்ள P இன் சதவீதத்தினைக் கணக்கிடுக.
தீர்வு:
கரிம சேர்மத்தின் நிறை (w) = 0.33g
Mg2P2O7ன் நிறை (x) = 0.397g
பாஸ்பரஸின் சதவீதம் =
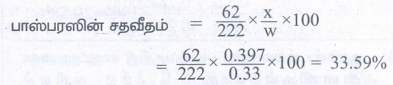
தன்மதிப்பீடு
0.3g எடையுள்ள கரிமச் சேர்மம், கெல்டால் முறையில் தந்த அமோனியா வாயுவை நடுநிலையாக்க 30ml 0.1 N H2SO4 தேவைப்பட்டது எனில் அச்சேர்மத்திலுள்ள நைட்ஜனின் சதவீதத்தினைக் காண்க
தீர்வு:
கரிமச் சேர்மத்தின் நிறை (w) = 0.3 g
சல்ஃபியூரிக் அமிலத்தின் நிறை (N) = 0.1N
சல்ஃபியூரிக் அமிலத்தின் கனஅளவு (V) = 30 mL
30ml 0.1 N சல்ஃபியூரிக் அமிலம் = 30ml 0.1 N அம்மோனியா
அம்மோனியா நைட்ரஜனின் சதவீதம் = (14 × NV/1000 × w) × 100
= (14 × 0.1 × 30/1000 × 0.3) × 100 = 14%