வேதியியல் - திரவக் கரைசல்களின் ஆவி அழுத்தம் | 11th Chemistry : UNIT 9 : Solutions
11 வது வேதியியல் : அலகு 9 : கரைசல்கள்
திரவக் கரைசல்களின் ஆவி அழுத்தம்
திரவக் கரைசல்களின் ஆவி அழுத்தம்
ஒரு கரைபொருள் (திண்மம், நீர்மம், வாயு என எந்த இயற் நிலையிலிருந்தாலும்) ஒரு திரவ கரைப்பானில் கரைக்கும்போது கிடைக்கும் கரைசலானது திரவக் கரைசல் (liquid solution) என்றழைக்கப்படுகிறது. இரண்டு கூறுகளை (ஒரு கரைபொருள் மற்றும் ஒரு கரைப்பான்) மட்டுமே கொண்டிருக்கக்கூடிய கரைசலானது, இருகூறுக் கரைசல் (binary solution) என்றழைக்கப்படுகிறது. திரவத்தில், வாயுநிலை கரைபொருள்கள் கரைந்துள்ள கரைசல்கள் பற்றி ஹென்றி விதியின் கீழ் நாம் ஏற்கனவே விவாதித்துள்ளோம் .
1. திரவத்தில் திரவத்தை கொண்ட இருகூறுக்கரைசலின் ஆவி அழுத்தம் .
தற்போது ஒரு மூடிய கலனில், ‘A' எனும் திரவ கரைபொருளை, ‘B' எனும் தூய கரைப்பானில் கரைத்து, இருகூறுக்கரைசல் தயாரிக்கப்படுதலைக் கருதுவோம். கரைசலில் உள்ள A மற்றும் B ஆகிய இரண்டு கூறுகளும் ஆவியாகக் கூடியவை, மேலும் A மற்றும் B ஆகிய கூறுகளின், திரவ மற்றும் ஆவி நிலைமைகளுக்கிடையே ஒரு சமநிலை உருவாக்கப்படும். ரௌலட் எனும் பிரான்சு வேதியியலாளர், A மற்றும் B ஆகிய கூறுகளின் பகுதி அழுத்தங்கள் மற்றும் அவற்றின் மோல் பின்னங்களுக்கிடையேயான ஒரு அளவியலான தொடர்பை முன்மொழிந்தார். அது ரௌல்ட் விதி என அறியப்படுகிறது.
ரௌல்ட் விதிப்படி “எளிதில் ஆவியாகும் திரவங்களைக் கொண்ட கரைசல்களில், கரைசலிலுள்ள ஒவ்வொரு கூறின் (A & B) பகுதி ஆவிஅழுத்தமும், அவற்றின் மோல் பின்னத்துடன் நேர் விகிதத்திலிருக்கும்"
ரௌல்ட் விதிப்படி,
PAαXA ...... (9.3)
PA = k xA
when xA = 1, எனும் போது k = p°A
இங்கு p°A என்பது அதே வெப்பநிலையில், தூயநிலையில் உள்ள கூறு A யின் ஆவி அழுத்தம்.
எனவே,
PA = p°A xA ....... (9.4)
இதே போல கூறு B க்கு
PB = p°B xB....... (9.5)
xA மற்றும் xB ஆகியன முறையே கூறுகள் A மற்றும் B ஆகியவற்றின் மோல் பின்னங்களாகும்.
டால்டனின் பகுதி அழுத்த விதிப்படி, ஒரு மூடிய கலனின் மொத்த அழுத்தமானது, அதிலுள்ள தனித்தனிக் கூறுகளின் பகுதி அழுத்தங்களின் கூடுதலுக்குச் சமமாக அமையும்.
ஆதலால்,
Pமொத்தம் = PA + PB ------ (9.6)
சமன்பாடுகள் (9.4) மற்றும் (9.5)லிருந்து PA மற்றும் PB மதிப்புகளை மேற்காண் சமன்பாட்டில், பிரதியிட
Pமொத்தம் = xA P°A + xB P°B ------ (9.7)
xA + xB = 1 அல்லது xA = 1 – xB என நாம் அறிவோம்.
ஆகையால்,
Pமொத்தம் = ( 1 – xB) P°A + xB P°B ------ (9.8)
Pமொத்தம் = P°A + xB (P°B - P°A ) ------ (9.9)
மேற்காண் சமன்பாடானது, y = mx+c வடிவிலுள்ள ஒரு நேர்க்கோட்டுச் சமன்பாடாகும். xB க்கு எதிராக (Pமொத்தம்) ஐக் கொண்டு வரையப்படும் வரைபடமானது, (P°B - P°A ) ஐ சாய்வாகவும், P°Aஐ y -அச்சு வெட்டாகவும் கொண்ட ஒரு நேர்க்கோட்டைத் தரும்.
டொலுயீன் (கரைபொருள்) மற்றும் பென்சீனைக் (கரைப்பான்) கொண்ட ஒரு திரவக் கரைசலை கருதுவோம். மோல் பின்னங்களைப் பொருத்து, தூய பென்சீன் மற்றும் டொலுயீன் ஆகியவற்றின் ஆவி அழுத்தங்களின் மாறுபாடு வரைபடத்தில் கொடுக்கப்பட்டுள்ளது.
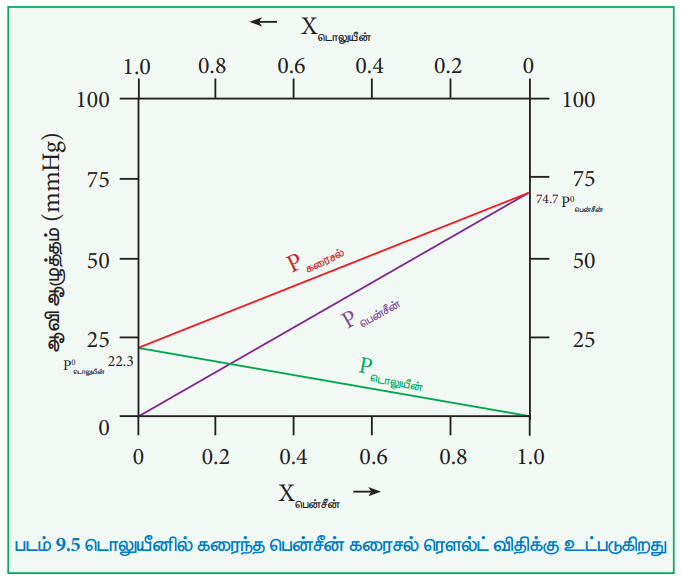
தூய டொலுயீன் மற்றும் தூய பென்சீன் ஆகியவற்றின் ஆவி அழுத்தங்கள் முறையே 22.3 மற்றும் 74.7 mmHg ஆகும். ஒரு கூறின் மோல் பின்னம் அதிகரிக்கும்போது, அத்தூய கூறின் பகுதி ஆவி அழுத்தமானது நேர்க்கோட்டில் அதிகரிக்கிறது என்பதை, மேலே கொடுக்கப்பட்டுள்ள வரைபடம் காட்டுகிறது. கரைபொருள் மற்றும் கரைப்பானின் எந்த ஒரு இயைபிலும், மொத்த ஆவி அழுத்தமதிப்பை பின்வரும் நேர்க்கோட்டுச் சமன்பாடு (சிவப்பு கோட்டால் குறிப்பிடப்பட்டுள்ளது) தருகிறது.
Pகரைசல் = P°டொலுயீன் + Xபென்சீன் (P°பென்சீன் - P°டொலுயீன்) -- (9.10)
2. திரவத்தில் திண்மம் கரைந்துள்ள இருகூறுக் கரைசலின் ஆவிஅழுத்தம்
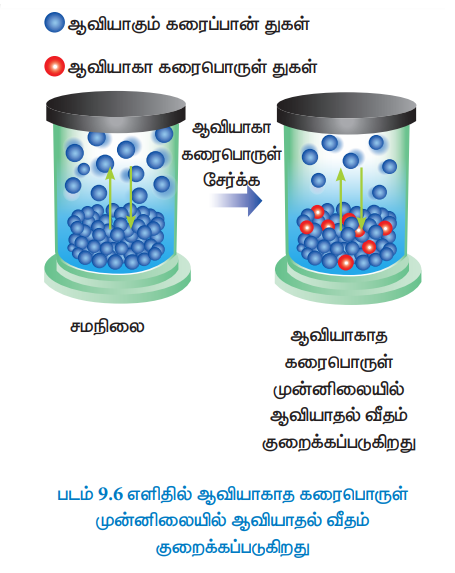
ஒரு தூய கரைப்பானில், எளிதில் ஆவியாகாத கரைபொருளைக் கரைக்கும் போது, தூய கரைப்பானின் ஆவிஅழுத்தம் குறையும். இத்தகைய கரைசல்களில், கரைபொருள் எளிதில் ஆவியாகாததால், கரைசலின் ஆவிஅழுத்தமானது, கரைப்பான் மூலக்கூறுகளை மட்டுமே பொறுத்து அமையும்.
எடுத்துக்காட்டாக, சோடியம் குளோரைடை நீரில் கரைக்கும்போது, உப்புக் கரைசலின் ஆவிஅழுத்தம் குறைகிறது. எந்தஒரு நேரத்திலும் கரைசலின் மேற்பரப்பில் காணப்படும் கரைப்பான் மூலக்கூறுகளின் எண்ணிக்கை ஆனது கரைசலின் ஆவி அழுத்தத்தினை நிர்ணயிக்கிறது மேலும் கரைசலின் ஆவி அழுத்தம் கரைப்பானின் மோல் பின்னத்திற்கு நேர் விகிதத்தில் அமையும்.
இங்கு XB என்பது கரைபொருளின் மோல் பின்னம்
(∵ XA + XB = 1, XB = 1 – XA)
மேற்கண்ட சமன்பாடானது, ஒப்பு ஆவிஅழுத்தக் குறைவைத் தருகிறது. இச்சமன்பாட்டை அடிப்படையாகக் கொண்டு, “ஒரு குறிப்பிட்ட வெப்பநிலையில், எளிதில் ஆவியாகாத கரைபொருளைக் கொண்டுள்ள ஒரு நல்லியல்பு கரைசலின் ஒப்பு ஆவிஅழுத்தக்குறைவானது, கரைபொருளின் மோல் பின்னத்திற்கு சமம்” எனவும் ரௌல்ட் விதியைக் கூறலாம்.
ரௌல்ட் விதி மற்றும் ஹென்றி விதி ஆகியவற்றை ஒப்பிடுதல்
ரௌல்ட் விதிப்படி, எளிதில் ஆவியாகாத கரைபொருளைக் கொண்டுள்ள கரைசலுக்கு
Pகரைபொருள் = P°கரைபொருள் Xகரைபொருள் ---- (9.17)
ஹென்றி விதிப்படி:
Pகரைபொருள் = KHXகரைசலில் உள்ள கரைபொருள். ----- (9.18)
மேற்காண் இரண்டு சமன்பாடுகளுக்கு இடையே உள்ள வேறுபாடு, விகித மாறிலி (ரௌல்ட் விதி) மற்றும் KH (ஹென்றி விதி) மட்டுமே ஆகும். திரவ கரைப்பானில், வாயுநிலை கரைபொருளை கொண்டுள்ள கரைசல்களுக்கு ஹென்றி விதி பொருந்தும், அதேசமயம் திரவ கரைப்பானில், எளிதில் ஆவியாகாத திண்ம கரைபொருளை கொண்டுள்ள கரைசல்களுக்கு ரௌல்ட் விதி பொருந்தும். கரைபொருளானாது எளிதில் ஆவியாகாததாக இருந்தால், ஹென்றி விதி மாறிலியானது. தூய கரைப்பானின் ஆவிஅழுத்தத்திற்கு (PAo) சமமாகிறது. அதாவது, ரௌல்ட் விதியானது ஹென்றி விதியின் சிறப்பு நிகழ்வாகிறது. மிக நீர்த்த கரைசல்களில், கரைப்பான் ஆனது ரௌல்ட் விதிக்கு உட்படுகிறது. மேலும் கரைபொருளானாது ஹென்றி விதிக்கு உட்படுகிறது.