11 வது வேதியியல் : அலகு 12 : கரிம வேதி வினைகளின் அடிப்படைக் கருத்துக்கள்
சகப்பிணைப்புகளில் எலக்ட்ரான் நகர்வு விளைவுகள்
சகப்பிணைப்புகளில் எலக்ட்ரான் நகர்வு விளைவுகள்.
சகப்பிணைப்பின் வழியே நிகழும் எலக்ட்ரான் நகர்வு விளைவினால் கரிம மூலக் கூறுகளின் நிலைப்புத்தன்மை, வினைபுரியும் திறன், காரத்தன்மை போன்ற சில பண்புகள் பாதிக்கப்படுகின்றன. பிணைப்பிற்கு அருகில் உள்ள அணுக்கள்/ தொகுதிகள் அல்லது ஒரு வினைப்பொருள் மூலக்கூறினை அணுகும் நிலை ஆகியன எலக்ட்ரான் நகர்வுகளில் தாக்கத்தினை ஏற்படுத்துகின்றன. இத்தகைய எலக்ட்ரான் நகர்வுகள் நிலையானதாகவோ அல்லது தற்காலிகமாகவோ அமையும். சில நேர்வுகளில், ஒரு மூலக்கூறில் இடம் பெற்றுள்ள அணு அல்லது தொகுதியினால் ஏற்படும் எலக்ட்ரான் நகர்வு விளைவு பிணைப்பில் நிலையான முனைவுறுதலை ஏற்படுத்துகிறது. மேலும் இதன் விளைவாக தகுந்த வினைச் சூழலில் பிணைப்புப் பிளவு ஏற்படுகிறது. எலக்ட்ரான் நகர்வு விளைவுகளை தூண்டல் விளைவு (I), உடனிசைவு விளைவு (R), எலக்ட்ரோமெரிக் விளைவு (E) மற்றும் அதி உள்ளடங்காத்தன்மை (hyper conjugation) என வகைப்படுத்தலாம்.
தூண்டல் விளைவு(I)
ஒரு மூலக்கூறில், அருகாமையில் உள்ள பிணைப்பு, அணு அல்லது தொகுதியினால் அம் மூலக்கூறில் உள்ள ஒரு சகப்பிணைப்பின் முனைவாதலில் ஏற்படும் மாற்றம் தூண்டல் விளைவு என வரையறுக்கப்படுகிறது. இது ஒரு நிலையான நிகழ்வாகும்.
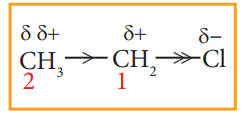
ஈத்தேன் மற்றும் எத்தில் குளோரைடினை எடுத்துக்காட்டுகளாகக் கொண்டு தூண்டல் விளைவினை நாம் விளக்கலாம். ஈத்தேனில் காணப்படும் C -C பிணைப்பு முனைவற்றது. ஆனால் எத்தில் குளோரைடில் காணப்படும் C1 –Cl பிணைப்பு முனைவுத்தன்மை உடையது. கார்பனைக் காட்டிலும் குளோரினானது அதிக எலக்ட்ரான் கவர்தன்மை உடையது என நாம் அறிவோம் எனவே C1 - Cl பிணைப்பில் உள்ள சகப்பிணைப்பு எலக்ட்ரான்களை குளோரின் தன்னை நோக்கி ஈர்க்கும் பண்பினைப் பெற்றுள்ளது. இதன் விளைவாக Cl ன் மீது சிறிய எதிர்மின் தன்மையும் அதோடு இணைக்கப்பட்டுள்ள C ன் மீது சிறிய நேர்மின் தன்மையும் ஏற்படும். இதனை ஈடு செய்யும் பொருட்டு, C1 ஆனது அதற்கும் C2ற்கும் இடைப்பட்ட எலக்ட்ரான் இணையினை தன்னை நோக்கிக் கவர்கிறது இத்தகைய முனைவாதல் தூண்டல் விளைவு என அழைக்கப்படுகின்றது.
இவ்விளைவானது அருகாமை பிணைப்புகளில் அதிகளவு உணரப்படுகிறது எனினும் மின்சுமை நகர்வின் (charge separation) அளவானது Cl லிருந்து அப்பால் செல்லச் செல்ல குறைகிறது. மேலும் இவ்விளைவு அதிகபட்சமாக இருகார்பன் அணுக்கள் வரை உணரப்படுகிறது.
தூண்டல் விளைவிற்கு காரணமான தொகுதியிலிருந்து நான்கு பிணைப்புகளுக்கு அப்பால் இவ்விளைவு மிகவும் குறைவு என்பதால் முக்கியத்துவமற்றதாகிறது.
தூண்டல் விளைவில், ஒரு அணுவிலிருந்து மற்றொரு அணுவிற்கு எலக்ட்ரான் பரிமாற்றம் செய்யப்படுவதில்லை ஆனால் இவ்விளைவு நிலையான ஒரு விளைவு என்பதனை அறிந்து கொள்ளுதல் முக்கியமானதாகும். ஒரு குறிப்பிட்ட அணு அல்லது தொகுதியானது அது இணைக்கப்பட்டுள்ள கார்பன் அணுவிற்கு எலக்ட்ரான் அடர்த்தியினை வழங்குதல் அல்லது எலக்ட்ரான் அடர்த்தியை தன்னை நோக்கி கவருதல் திறனை தூண்டல் விளைவு குறிப்பிடுகின்றது. இந்த திறனைப் பொறுத்து பதிலீட்டுத் தொகுதிகள் (substituents) +I தொகுதிகள் மற்றும் - I தொகுதிகள் என வகைப்படுத்தப்படுகின்றன. சிக்மா (σ) சகப்பிணைப்பின் வழியே இத்தொகுதிகளின் எலக்ட்ரான் விடுவித்தல் அல்லது கவருதல் திறன்கள் முறையே +I விளைவு மற்றும் – I விளைவு என அழைக்கப்படுகின்றன.
அதிக எலக்ட்ரான் கவர்தன்மை கொண்ட அணுக்கள் மற்றும் நேர் மின்சுமை கொண்ட அணுக்களைக் கொண்டுள்ள தொகுதிகள் எலக்ட்ரான் கவரும் - I தொகுதிகள் எனப்படுகின்றன.
எடுத்துக்காட்டு: -F, -Cl, -COOH, -NO2,-NH2
பதிலீட்டு தொகுதியின் எலக்ட்ரான் கவர் தன்மை அதிகமாக இருப்பின் அதன்,- I விளைவும் அதிகமாக இருக்கும். சில தொகுதிகளின் – I விளைவின் வரிசை பின் வருமாறு.
NH3 > NO2 > CN > SO3H > CHO > CO > COOH > COCl > CONH2 > F > Cl > Br > I > OH > OR > NH2 > C6H5 > H
அதிக நேர்மின் தன்மை கொண்ட அணுக்கள் மற்றும் எதிர் மின்சுமையை கொண்டுள்ள தொகுதிகள் எலக்ட்ரான் வழங்கும் +I தொகுதிகள் எனப்படும்.
எடுத்துக்காட்டு: கார உலோகங்கள், மீத்தைல், ஈத்தைல் போன்ற ஆல்கைல் தொகுதிகள், CH3O-, C2H5O-, COO- போன்ற எதிர்மின் சுமையுடைய தொகுதிகள் போன்றவை. தனிமங்களின் எலக்ட்ரான்கவர் தன்மை குறைவாக இருப்பின் +I விளைவு அதிகமாக இருக்கும். சில ஆல்கைல் தொகுதிகளின் +I விளைவின் ஒப்பீட்டு வரிசை பின்வருமாறு
-C(CH3) 3 > -CH(CH3) 2 > -CH2CH3 > -CH3
தூண்டல் விளைவின் காரணமாக கரிமச்சேர்மங்களின் சில பண்புகளில் ஏற்படும் மாற்றங்களை நாம் புரிந்து கொள்வோம்.
வினைத்திறன்
ஹாலஜன்களைப் போன்ற அதிக எலக்ட்ரான் கவர்தன்மை உடைய அணு ஒரு கார்பனுடன் இணைக்கப்பட்டிருக்கும் போது அது C-X பிணைப்பினை முனைவுள்ளதாக்குகிறது. இத்தகைய நேர்வுகளில் வினையின் போது உள்வரும் கருக்கவர் பொருளானது முனைவுற்ற கார்பனை தாக்குவதற்கு சாதகமான சூழலை ஹாலஜனின் – I விளைவு ஏற்படுத்துகிறது எனவே வினைத்திறன் அதிகரிக்கின்றது.
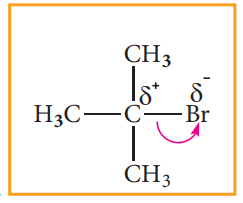
கார்பனைல் கார்பனுக்கு அருகில் – I தொகுதி இணைக்கப்பட்டிருப்பின், அத்தொகுதி, கார்பனைல் கார்பன் மீதான எலக்ட்ரான் அடர்த்தியினைக் குறைக்கிறது எனவே கருக்கவர் சேர்க்கைவினையின் வேகம் அதிகரிக்கின்றது.
கார்பாக்சிலிக் அமிலங்களின் அமிலத்தன்மை
கார்பாக்சிலிக் அமிலத் தொகுதிக்கு அருகில் உள்ள கார்பனுடன் ஹாலஜன் இணைக்கப்படும் போது, ஹாலஜனின்-I விளைவின் காரணமாக அது பிணைப்பு எலக்ட்ரான்களை தன்னை நோக்கி கவர்வதால் H+ ன் அயனியாதல் எளிதாகிறது. குளோரோ அசிட்டிக் அமிலங்களின் வலிமையின் வரிசை பின்வருமாறு அமைகிறது.
ட்ரை குளோரோ அசிட்டிக் அமிலம் > டை குளோரோ அசிட்டிக் அமிலம் > குளோரோ அசிடிக் அமிலம் > அசிடிக் அமிலம்
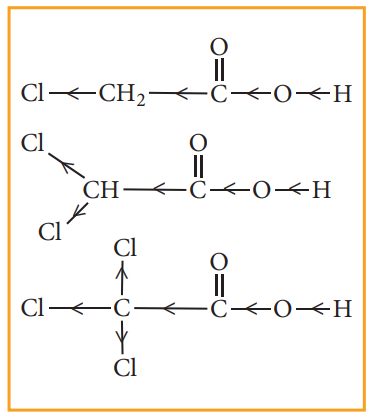
கார்பாக்சில் தொகுதியுடன் இணைக்கப்பட்டுள்ள தொகுதியின் - I விளைவு அதிகரிக்க, அதிகரிக்க அமிலத்தின் வலிமையும் அதிகரிக்கின்றது.
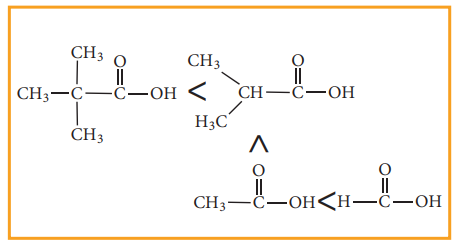
இதைப் போலவே, +I விளைவின் காரணமாக பின்வரும் அமிலங்களின் வலிமையின் வரிசை அமைகிறது.
எலக்ட்ரோமெரிக் விளைவு (E)
நிறைவுறா சேர்மங்களில் (>C=C<, >C=O, போன்றவற்றை பெற்றுள்ள சேர்மங்ககளில்) தாக்கும் வினைபொருள் முன்னிலையில் நிகழும் ஒரு தற்காலிகமான விளைவு எலக்ட்ரோமெரிக் விளைவு எனப்படும்.
(i) கார்பனைல் (>C=O) தொகுதியைக் கொண்டுள்ள ஒரு சேர்மம் மற்றும் ஆல்கீன்களைப் போன்ற (>C=C<) நிறைவுறாத் தன்மையைப் பெற்றுள்ள ஒரு சேர்மம் ஆகிய இரண்டு எடுத்துக்காட்டுகளைக் கருதுவோம்
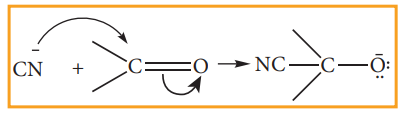
கருக்கவர் பொருள், கார்பனைல் சேர்மத்தை அணுகும் போது, C மற்றும் 'O' அணுக்களுக்கிடையே காணப்படும் எலக்ட்ரான்கள் அக்கணத்தில் அதிக எலக்ட்ரான் கவர் தன்மையுடைய 'O' அணுவிற்கு மாற்றப்படுகிறது. இதன் விளைவாக கார்பனானது எலக்ட்ரான் பற்றாக்குறையுடைய தன்மையினைப் பெறுகிறது எனவே உள்வரும் கருக்கவர் பொருள் கார்பனைல் கார்பனுடன் புதிய பிணைப்பு ஏற்படுத்துவதற்கு சாதகமான சூழல் உருவாகிறது.
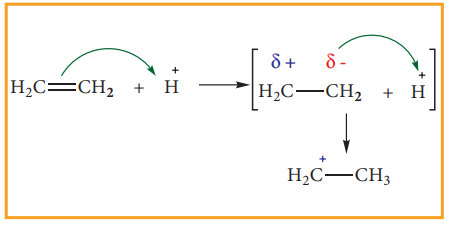
மாறாக H+ போன்ற எலக்ட்ரான் கவர் பொருள் ஒரு ஆல்கீன் மூலக்கூறை அணுகும் போது, அக்கணத்தில் π எலக்ட்ரான்கள், எலக்ட்ரான் கவர் பொருளுக்கு மாற்றப்பட்டு கார்பனுக்கும் ஹைட்ரஜனுக்கும் இடையே புதிய பிணைப்பு உருவாகிறது. இதன் விளைவாக மற்றொரு கார்பன் எலக்ட்ரான் பற்றாக்குறையுடையதாவதால் நேர் மின் சுமையை பெறுகிறது.
எலக்ட்ரோமெரிக் விளைவு E - விளைவு என குறிக்கப்படுகிறது. தூண்டல் விளைவினைப் போன்றே இவ்விளைவும் தாக்கும் வினைக் காரணியுடன் புதிய பிணைப்பு உருவாகும் பொருட்டு எலக்ட்ரான் இணை பரிமாற்றப்படும் திசையின் அடிப்படையில்+E மற்றும் -Eவிளைவு என வகைப்படுத்தப்படுகிறது.
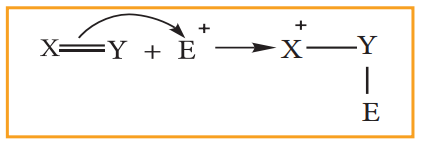
தாக்கும் வினைக் காரணியை நோக்கி π எலக்ட்ரான் மாற்றப்பட்டால் அவ்விளைவு +E விளைவு எனப்படும்.
மேற்கண்டுள்ள ஆல்கீனுடன் H+ சேர்த்தல் +E விளைவுக்கு ஒரு உதாரணமாகும்.
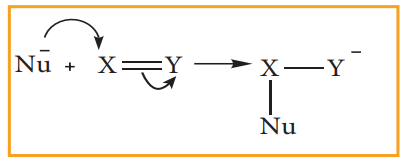
தாக்கும் காரணியிலிருந்து அதற்கு அப்பால் எலக்ட்ரான்கள் மாற்றப்படின் அவ்விளைவு -E விளைவு எனப்படும்.
சயனைடு அயனி கார்பனைல் கார்பனை தாக்குதல் -E விளைவுக்கு எடுத்துக்காட்டாகும்.
உடனிசைவு அல்லது மீசோமெரிக் விளைவு
சில கரிமச் சேர்மங்களில் இரட்டைப் பிணைப்பு தகுந்த இடங்களில் காணப்படும் நிலையில் இவ்விளைவு உணரப்படுகிறது. சில கரிமச் சேர்மங்களை, பிணைப்பு மற்றும் தனித்த இரட்டை எலக்ட்ரான்களின் இட அமைப்பில் மட்டுமே மாறுபடும் ஒன்றிற்கும் மேற்பட்ட வடிவமைப்புகளின் மூலம் குறிப்பிட இயலும். அத்தகைய அமைப்புகள் உடனிசைவு அமைப்புகள் எனவும் இந்நிகழ்வு உடனிசைவு எனவும் அழைக்கப்படுகிறது. மேலும் இந்நிகழ்வு மீசோமெரிக் விளைவு எனவும் அழைக்கப்படுகிறது.
எடுத்துக்காட்டாக, பென்சீன் மற்றும் ஒன்று விட்டு ஒன்று இரட்டைப் பிணைப்பை பெற்றுள்ள 1, 3 – பியூட்டா டையீன் போன்றவற்றின் வடிவங்களை ஒரே ஒரு வடிவமைப்பினைக் கொண்டு குறிப்பிட இயலாது. அச் சேர்மங்களின் கண்டறியப்பட்ட பண்புகளை ஒரு உடனிசைவு கலப்பு (resonance hybrid) அமைப்பின் மூலம் விளக்க முடியும்.
1, 3 பியூட்டா டையீனில் C2 – C3 பிணைப்பிற்கு இடைப்பட்ட தொலைவினைக் காட்டிலும்
C1 - C2 மற்றும் C3 – C4 ஆகிய பிணைப்புகளுக்கு இடைப்பட்ட தொலைவானது குறைவாக இருக்கும் என எதிர்பார்க்கின்றோம். ஆனால் மேற்கண்டுள்ள அனைத்து பிணைப்புகளின் பிணைப்பு நீளமும் சமமாக உள்ளது. C1 - C2 மற்றும் C3 – C4 ஆகியவற்றிற்கிடையே உள்ளடங்கியுள்ள π பிணைப்புகள் காணப்படும் ஒரு எளிய அமைப்பின் மூலம் மேற்கண்டுள்ள பண்பினை விளக்க இயலாது. உண்மையில் π எலக்ட்ரான்கள் கீழ்க்கண்டுள்ளவாறு உள்ளடங்காத் தன்மையினைப் பெற்றுள்ளன.
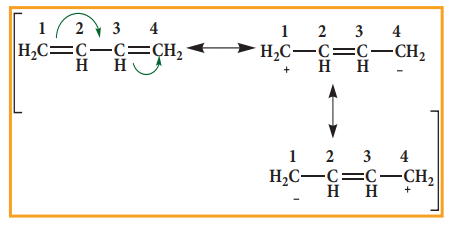
மேற்கண்டுள்ள வடிவங்கள் உடனிசைவு அமைப்புகள் என அழைக்கப்படுகின்றன. உண்மையான வடிவமைப்பு மேற்கண்டுள்ள மூன்று உடனிசைவு அமைப்புகளுக்கு இடைப்பட்டதாக அமையும் அது உடனிசைவு கலப்பு என அழைக்கப்படுகிறது அதனை பின்வருமாறு குறிப்பிடலாம்.
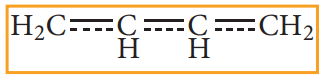
மற்ற எலக்ட்ரான் நகர்வு விளைவுகளைப் போன்றே, இரட்டை பிணைப்பிற்கு அருகில் இணைக்கப்பட்டுள்ள வினைச்செயல் தொகுதியினைப் பொறுத்து இவ்விளைவு + M விளைவு மற்றும் - M விளைவு என அழைக்கப்படுகின்றன.
நேர் மீசோமெரிக் விளைவு
ஒன்று விட்டு ஒன்றாக இரட்டைப் பிணைப்பினைப் கொண்டுள்ள அமைப்புடன் இணைக்கப்பட்டிருக்கும் பதிலீட்டுத் தொகுதியிலிருந்து, அப்பால் எலக்ட்ரான் நகரும் போது நேர் மீசோமெரிக் விளைவு (+M) ஏற்படுகிறது. ஒன்று விட்டு ஒன்றாக இரட்டைப் பிணைப்பினைப் கொண்டுள்ள அமைப்புடன் எலக்ட்ரானை வெளித்தள்ளும் இயல்புடைய பதிலிகள் இணைக்கப்படும் போது பதிலித் தொகுதியிலிருந்து எலக்ட்ரான்கள் வெளிப்பட்டு உடனிசைவில் ஈடுபடுகின்றன. இத்தொகுதிகள் (+R) அல்லது (+M) தொகுதிகள் எனப்படும்.
எடுத்துக்காட்டுகள்
எடுத்துக்காட்டு : -OH, -SH, -OR,-SR, -NH2, -O- போன்றவை.
எதிர் மீசோமெரிக் விளைவு
ஒன்றுவிட்டு ஒன்றாக இரட்டைப் பிணைப்பினைக் கொண்டுள்ள அமைப்புடன் இணைக்கப்பட்டுள்ள பதிலீட்டுத் தொகுதிகளை நோக்கி எலக்ட்ரான்கள் நகரும் போது எதிர் மீசோமெரிக் விளைவு ஏற்படுகிறது. எலக்ட்ரானை கவரும் பதிலீட்டுத் தொகுதிகள் ஒன்றுவிட்டு ஒன்றாக இரட்டைப் பிணைப்பை கொண்டுள்ள அமைப்புடன் இணைக்கப்பட்டிருக்கும் போது இணைக்கப்பட்டுள்ள தொகுதியானது உடனிசைவின் மூலம் எலக்ட்ரானைக் கவரும் தன்மையினைப் பெற்றுள்ளது. இத்தொகுதிகள் (-R) அல்லது (-M) தொகுதிகள் என அழைக்கப்படுகின்றன.
எடுத்துக்காட்டுகள்
எடுத்துக்காட்டு : -NO2, > C=O, -COOH,-C≡N போன்றவை.
பீனாலின் அமிலத்தன்மை போன்ற சில பண்புகளை உடனிசைவை பயன்படுத்தி விளக்க இயலும். +M விளைவின் காரணமாக, பீனாலைக் காட்டிலும், பீனாக்ஸைடு அயனி அதிக நிலைப்புத்தன்மையினைப் பெறுகிறது எனவே உடனிசைவால் பீனால் அயனியுற்று H+ ஐ தருதல் சாதகமாகிறது. மேலும் பீனால் அமிலத்தன்மையை பெறுகிறது.
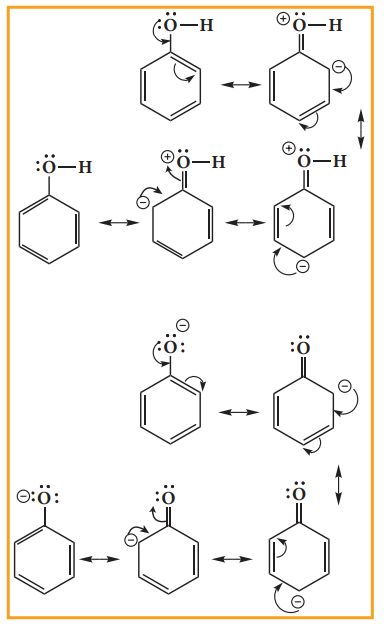
மேற்கண்டுள்ள அமைப்புகளில் பீனாலின் உடனிசைவு அமைப்பில் மின்சுமை பிரிப்பு காணப்படுகிறது. இத்தகைய அமைப்பிற்கு ஆற்றல் தேவை. ஆனால் பீனாக்சைடு அயனியில் இத்தகைய அமைப்புக் காணப்படுவதில்லை. இவ்வாறாக பீனாக்ஸைடு அயனி அதிக நிலைப்புத் தன்மையினைப் பெற்றிருப்பதால் பீனால் அமிலத்தன்மையினைப் பெற்றுள்ளது.
பிணைப்பில்லா உடனிசைவு
σ - பிணைப்பு எலக்ட்ரான்களின் உள்ளடங்காத தன்மை Hyper Conjugation என அழைக்கப்படுகின்றது. σ - பிணைப்பில் உள்ள எலக்ட்ரான்கள் (வழக்கமாக C-H (அல்லது) C-C பிணைப்பு எலக்ட்ரான்கள்) அதன் அருகாமையில் உள்ள பிணைப்பில் ஈடுபடா p ஆர்பிட்டால் அல்லது σ*, π* போன்ற எதிர் பிணைப்பு ஆர்பிட்டால்களுடன் இடைவினை புரிவதால் ஏற்படும் ஒரு தனித்த நிலைப்புத்தன்மை பெறச் செய்யும் விளைவு Hyper Conjugation எனப்படும். எலக்ட்ரோமெரிக் விளைவைப் போன்று அல்லாமல் இவ்விளைவு நிலையான ஒன்றாகும்.
இவ்விளைவு நிகழ ஒரு α C-H தொகுதி அல்லது π பிணைப்பிற்கு அருகாமையில் (sp2 இனக்கலப்பு கார்பனுக்கு) அணுக்களின் மீதுள்ள தனித்த எலக்ட்ரான்களைப் பெற்றுள்ள N,O போன்றவை அமைய வேண்டும்.
σ - பிணைப்பு ஆர்பிட்டால் அல்லது தனித்த எலக்ட்ரான் இரட்டையைப் பெற்றுள்ள ஆர்பிட்டால் ஆனது அருகாமையில் உள்ள ஆர்பிட்டால் அல்லது π ஆர்பிட்டாலுடன் மேற்பொருந்துவதால் இவ்விளைவு நிகழ்கிறது.
எடுத்துக்காட்டு 1:
புரப்பீனில், மெத்தில் தொகுதியின் C-H பிணைப்பின் σ எலக்ட்ரான்கள், இரட்டைப்பிணைப்பால் பிணைக்கப்பட்டுள்ள கார்பனின் π-ஆர்பிட்டாலுக்கு கிழே குறிப்பிட்டுள்ளவாறு உடனிசைவுறுகிறது.
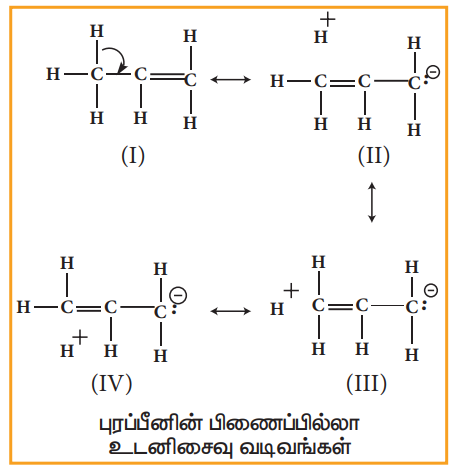
மேற்கண்டுள்ள அமைப்புகளில், 'σ' பிணைப்பு எலக்ட்ரான்கள் உடனிசைவில் ஈடுபடுகின்றன மேலும் இத்தகைய உடனிசைவு நிகழ பிணைப்பு பிளவுறுகிறது. இதன் விளைவாக மூன்று உடனிசைவு வடிவங்களில் புரப்பீனைக் குறிப்பிட இயலும் (வடிவம் (II), (III) மற்றும் (IV) இவ்வடிவங்களால், α - கார்பன் மற்றும் ஒரு ஹைட்ரஜனுக்கிடையே எத்தகைய பிணைப்பும் காணப்படுவதில்லை. எனவே இவ்விளைவு பிணைப்பில்லா உடனிசைவு விளைவு (no bond resonance) அல்லது பேக்கர் - நாதன் விளைவு என அழைக்கப்படுகிறது. வடிவம் (II), (III) மற்றும் (IV) ஆகியன முனைவுத் தன்மை உடையவை..
எடுத்துக்காட்டு 2:
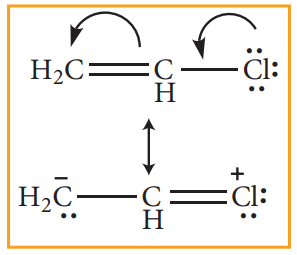
π-பிணைப்பால் பிணைக்கப்பட்டுள்ள கார்பன் அணுவுடன் தனித்த இரட்டை எலக்ட்ரான்களைக் கொண்டுள்ள அணு அல்லது தொகுதி ஒற்றைப் பிணைப்பால் இணைக்கப்பட்டிருக்கும் நேர்வுகளிலும் பிணைப்பில்லா உடனிசைவு விளைவு உணரப்படுகிறது.
தனித்த ஜோடி எலக்ட்ரான்கள் உடனிசைவில் ஈடுபட்டு π எலக்ட்ரான்களை இடப்பெயர்ச்சி செய்வதால் ஒன்றிற்கும் மேற்பட்ட உடனிசைவு அமைப்புகள் உருவாகின்றன.
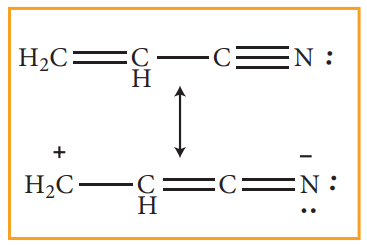
எடுத்துக்காட்டு 3:
எலக்ட்ரான் கவர்தன்மை அதிகமுடைய அணு அல்லது தொகுதி, π-பிணைப்புடன் உடனிசைவில் ஈடுபடும் போது அவைகள் பன்மைப்பிணைப்பிலிருந்து π -எலக்ட்ரான்களை கவர்கின்றன. இதனால் பின்வருமாறு உடனிசைவு அமைப்புகள் ஏற்படுகின்றன.
கார்பன் நேர் அயனிகளைப் பொருத்த வரையில், நேர் மின் சுமையுடைய கார்பனுடன் இணைக்கப்பட்டுள்ள ஆல்கைல் தொகுதிகளின் எண்ணிக்கை அதிகம் எனில், பிணைப்பில்லா உடனிசைவு வடிவமைப்புகளின் எண்ணிக்கையும் அதிகம். எனவே கார்பன் நேர் அயனிகளின் நிலைப்புத்தன்மையும் அதிகரிக்கின்றது. பல்வேறு கார்பன் நேர் அயனிகளின் நிலைப்புத்தன்மை வரிசை பின் வருமாறு 3° கார்பன் நேர் அயனி > 2° கார்பன் நேர் அயனி > 1° கார்பன் நேர் அயனி