11 வது வேதியியல் : அலகு 12 : கரிம வேதி வினைகளின் அடிப்படைக் கருத்துக்கள்
கரிம வினை வழிமுறையின் அடிப்படைக் கருத்துக்கள்
1. கரிம வினை வழிமுறையின் அடிப்படைக் கருத்துக்கள்
ஒரு வேதிமாற்றம் நிகழும்போது அதன் ஒவ்வொரு படிநிலையிலும் நிகழும் மாற்றங்களை விவரிக்கும் ஒரு கருத்தியல் வழிமுறையே வினைவழி முறை எனப்படுகிறது. ஒரு கரிம வேதிவினையில், எலக்ட்ரான்களின் நகர்வு, வினை நிகழும் போது உருவாகும் வினை இடை நிலைப்பொருளின் வகை ஆகியனவற்றின் அடிப்படையில் அவ்வேதிவினையினை புரிந்து கொள்ள முடியும். எலக்ட்ரான் இரட்டை நகரும் திசை ஒரு வளைந்த இருமுனை அம்புக் குறியீட்டால் குறிப்பிடப்படுகிறது. இந்த அம்புக்குறி எதிர்மின் பகுதியிலிருந்து துவங்கி எந்த அணுவோடு எலக்ட்ரான் இரட்டை இணைக்கப்படுகிறதோ அந்த அணுவில் முடிவடைகிறது.
2. சகப்பிணைப்பு பிளவுறுதல்
அணுக்களுக்கிடையே எலக்ட்ரான்கள் சமமாகப் பங்கிடப்படுவதால் உருவாகும் சகப்பிணைப்புகள் அனைத்து கரிம மூலக்கூறுகளிலும் காணப்படுகின்றன. இந்த சகப்பிணைப்புகள் பின்வரும் இரு வகைகளில் பிளவுறலாம். அவையாவன
● ஒரே மாதிரியான பிளவு (சீரான பிளவு)
● வெவ்வேறு விதமான பிளவு (சீரற்ற பிளவு)
வினைக்கு உட்படும் பொருளில் உள்ள பிணைப்பின் பிளவானது வினைக் காரணியின் தன்மையினைப் பொருத்து அமையும். சீரற்ற பிளப்பிற்குத் தேவைப்படும் ஆற்றலைக் காட்டிலும், சீரான பிளப்பு நிகழ அதிக ஆற்றல் தேவைப்படும்.
ஒரே மாதிரியான பிளவு Homolytic Cleavage
இத்தகையச் செயல்முறையில், சகப்பிணைப்பால் பிணைக்கப்பட்டுள்ள இரு அணுக்கள் தலா ஒரு எலக்ட்ரானை பெறும் வகையில் சகப்பிணைப்பு சீராக பிளக்கப்படுகிறது. இப்பிளவு செயல்முறை ஒரு முனை அம்புக்குறியால் (மீன்முள் அம்புக்குறி) குறிப்பிடப்படுகிறது. அதிக வெப்ப நிலை அல்லது uv ஒளி போன்றவற்றின் முன்னிலையில், ஏறத்தாழ சமமான எலக்ட்ரான் கவர்தன்மை கொண்டுள்ள அணுக்களுக்கிடையேயான முனைவற்ற சகப்பிணைப்பைக் கொண்டுள்ள சேர்மங்களில் இவ்வகை பிளவு ஏற்படுகின்றது. இத்தகைய மூலக்கூறுகளில், பிணைப்பு பிளவானது தனி உறுப்புகளை (free radicals) உருவாக்குகிறது. இவற்றின் ஆயுட்காலம் மிகவும் குறைவு மேலும் இவைகள் அதிக வினைத்திறன் உடையவை. வினைக்கு உட்படும் பொருளில் ஒரே மாதிரியான சீரான பிணைப்பு பிளவினை ஊக்குவிக்கும் வினைப் பொருள்கள் தனிஉறுப்பு துவக்கி (free radical initiator) என அழைக்கப்படுகின்றன. எடுத்துக்காட்டாக, பலபடியாக்கல் வினைகளில், அசோபிஸ் ஐசோபியூட்ரோ நைட்ரைல் (AIBN) மற்றும் பென்சாயில் பெராக்ஸைடு போன்ற தனி உறுப்பு துவக்கிகள் பயன்படுத்தப்படுகின்றன.
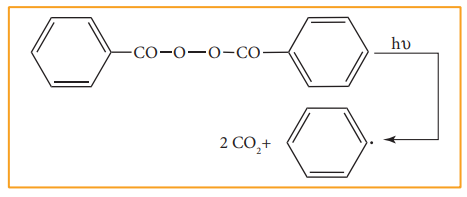
தனித்த நடுநிலைத் தன்மை உடைய இணையாகாத ஒற்றை எலக்ட்ரானைக் கொண்டுள்ள தனி உறுப்பானது அதிக நிலைப்புத்தன்மை அற்றது. அது ஒரு எலக்ட்ரானை ஏற்றுக் கொண்டு நிலைப்புத் தன்மை பெறும் இயல்பினைக் கொண்டுள்ளது. கரிம வேதி வினைகளில் C-C பிணைப்பின் சீரான பிளவினால் ஆல்கைல் தனிஉறுப்புகள் உருவாகின்றன. ஆல்கைல் தனி உறுப்புகளின் நிலைப்புத் தன்மை வரிசை பின்வருமாறு அமையும்.
•C(CH3)3 > •CH(CH3)2 > •CH2CH3 > •CH3
வெவ்வேறு மாதிரியான பிளவு (Heterolytic Cleavage)
இச்செயல் முறையில், சகப்பிணைப்பானது சீரற்ற முறையில் பிளவுபடுகிறது. இதில் சகப்பிணைப்பால் பிணைக்கப்பட்டிருந்த அணுக்களில் ஒரு அணு பிணைப்பு இரட்டை எலட்ரான்களை தன்னகத்தே இருத்தியிருக்கும். இதன் விளைவாக ஒரு நேர் அயனி மற்றும் ஒரு எதிர்அயனி உருவாகும். பிணைக்கப்பட்டிருந்த அணுக்களில் அதிக எலக்ட்ரான் கவர்தன்மை கொண்ட அணு எதிர் அயனியாகவும் மற்றொன்று நேர் அயனியாகவும் மாற்றமடைகிறது. இப்பிளவானது அதிக எலக்ட்ரான் கவர்தன்மையுடைய அணுவினை நோக்கிய ஒரு வளைவான அம்புக்குறியால் குறிப்பிடப்படுகிறது.
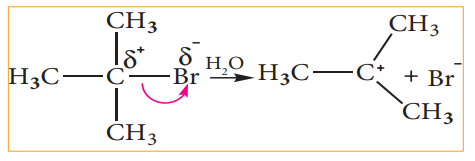
எடுத்துக்காட்டாக, மூவிணைய பியூட்டைல் புரோமைடில் உள்ள புரோமின் அதிக எலக்ட்ரான் கவர் தன்மை பெற்றிருப்பதால் C-Br பிணைப்பானது ஒரு முனைவுள்ள பிணைப்பாகும். C-Br பிணைப்பில் உள்ள பிணைப்பு எலக்ட்ரான்கள் கார்பனைக் காட்டிலும் புரோமினால் அதிக அளவு கவரப்படுகின்றன. எனவே, நீராற்பகுத்தலில், C-Br பிணைப்பானது சீரற்ற பிளப்பிற்கு உட்பட்டு மூவிணைய பியூட்டைல் நேர் அயனியினைத் தருகிறது.
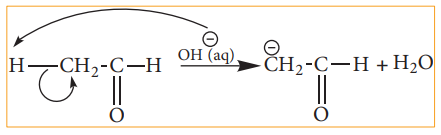
ஆல்டிஹைடு அல்லது கீட்டோன்களில் காணப்படும் C-H பிணைப்பு பிளவுபடுதலை நாம் கருதுவோம். ஹைட்ரஜனைக் காட்டிலும் கார்பன் அதிக எலக்ட்ரான் கவர்தன்மை உடையது என நாம் அறிவோம் எனவே C-H பிணைப்பின் சீரற்ற பிளவால் கார்பன் எதிர் அயனி உருவாகிறது. எடுத்துக்காட்டாக ஆல்டால் குறுக்க வினையில் OH- அயனியானது ஆல்டிஹைடின் α-ஹைட்ரஜனைக் கவர்வதால் பின்வரும் எதிர் அயனி உருவாகிறது.
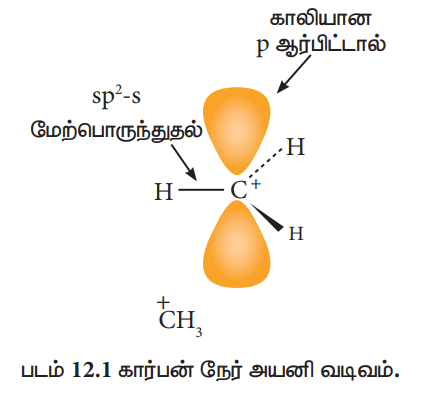
கார்பன் நேர்அயனியில் உள்ள கார்பனின் இனக்கலப்பு:
கார்பன் நேர்அயனியில், நேர்மின்சுமை கொண்ட கார்பன் sp2 இனக்கலப்பாதலுக்கு உட்பட்டதாகும். எனவே இது சமதள வடிவமைப்பினைப் பெற்றுள்ளது. இத்தகைய கார்பன் நேர்அயனிகள் உருவாகும் வினைகளில், எதிர்மின்சுமையுடைய கருக்கவர் பொருட்கள், கார்பன் நேர் அயனியை இருபுறமும் தாக்குவதற்கு வாய்ப்புள்ளது.
பொதுவாக, கார்பன் எதிர் அயனியானது பிரமிடு வடிவத்தினைப் பெற்றிருக்கும் மேலும் தனித்த இரட்டை எலக்ட்ரானானது கார்பனின் ஒரு sp3 இனக்கலப்பு ஆர்பிட்டாலில் இடம் பெற்றிருக்கும்.

ஆல்கைல் தனி உறுப்பானது பிரமிடு வடிவத்தினையோ அல்லது தள வடிவத்தினையோ பெற்றிருக்கலாம்..
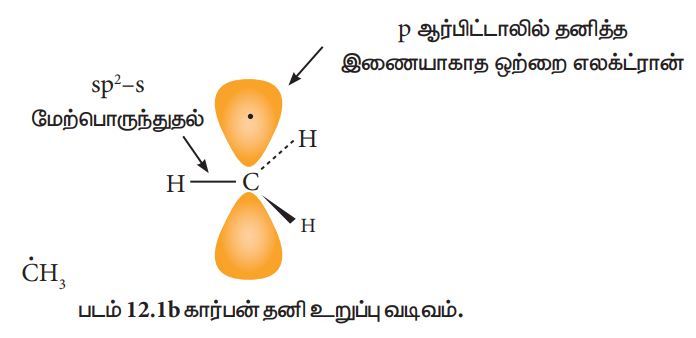
கார்பன் நேர் அயனி மற்றும் கார்பன் எதிர் அயனிகளின் ஒப்பீட்டு நிலைப்புத்தன்மை வரிசை பின்வருமாறு அமையும்.
பல்வேறு கார்பன் நேர் அயனிகளின் ஒப்பீட்டு நிலைப்புத் தன்மை வரிசை பின்வருமாறு.
+C(CH3) 3 > +CH(CH3)2 > +CH2CH3 > +CH3
பல்வேறு கார்பன் எதிர் அயனிகளின் ஒப்பீட்டு நிலைப்புத் தன்மை வரிசை பின்வருமாறு.
-C(CH3) 3 < -CH(CH3)2 < -CH2CH3 < -CH3