பருமனறி பகுப்பாய்வு | வேதியியல் செய்முறை ஆய்வக பரிசோதனை - பெர்ரஸ் அம்மோனியம் சல்பேட்டின் நிறையறிதல் | 12th Chemistry : Practicals
12 ஆம் வகுப்பு வேதியியல் : செய்முறை
பெர்ரஸ் அம்மோனியம் சல்பேட்டின் நிறையறிதல்
பெர்ரஸ் அம்மோனியம் சல்பேட்டின் நிறையறிதல்
நோக்கம்:
பருமனறி பகுப்பாய்வின் மூலம் கொடுக்கப்பட்டுள்ள செறிவறியா பெர்ரஸ் அம்மோனியம் சல்பேட் கரைசலில் 1500mL ல் கரைந்துள்ள படிக பெர்ரஸ் அம்மோனியம் சல்பேட்டின் நிறையினைத் தீர்மானித்தல். இதற்கென, 0.1024N திறனுடைய திட்ட பெர்ரஸ் சல்பேட் கரைசல் (FeSO4) மற்றும் பொட்டாசியம் பெர்மாங்கனேட் இணைப்புக் கரைசல் ஆகியன கொடுக்கப்பட்டுள்ளன.
தத்துவம்
தரம்பார்த்தல் வினைகள் ஆக்சிஜனேற்றம் : 5 Fe2+ → 5 Fe3+ + 5e-
ஆக்சிஜனொடுக்கம் : 5Fe2+ + MnO4− + 8H+ → 5Fe3+ + Mn2+ + 4H2O
ஒட்டுமொத்த ஆக்சிஜனேற்ற ஒடுக்க வினை : 5Fe2+ + MnO4− + 8H+ → 5Fe3+ + Mn2+ + 4H2O
சுருக்கமான செய்முறை:
செய்முறை
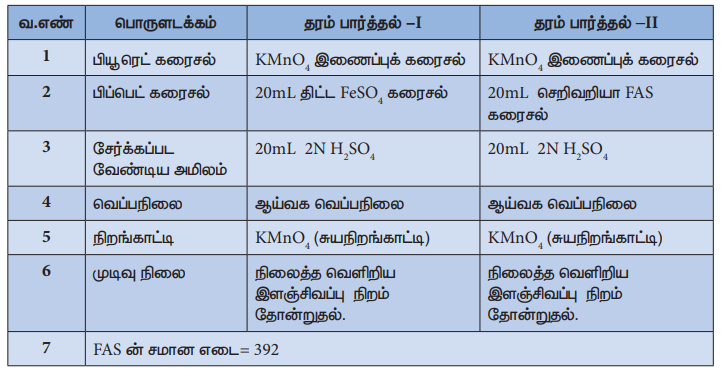
தரம் பார்த்தல்- I
KMnO4 இணைப்புக் கரைசல் VS திட்ட FeSO4 கரைசல்
பியூரெட்டை நீரினால் நன்கு கழுவவேண்டும். பின்னர் தரம்பார்த்தலுக்கென கொடுக்கப்பட்டுள்ள KMnO4 இணைப்புக் கரைசலில் சிறிதளவு, பியூரெட்டில் எடுத்துக் கொண்டு அக்கரைசல் பியூரெட் முழுமையும் படுமாறு சுழற்றிக் கழுவுதல் வேண்டும். இதன் பிறகு, கொடுக்கப்பட்டுள்ள KMnO4 கரைசலைக் கொண்டு பியூரெட்டில் பூஜ்ஜியக் குறியீட்டு அளவு வரை நிரப்புக. மிகச்சரியாக 20mL திட்ட FeSO4 கரைசலை பிப்பெட்டைக் கொண்டு உறிஞ்சி எடுத்து நன்கு கழுவப்பட்ட கூம்புக் குடுவையில் இடுக. மேலும் இதனுடன் 20mL 2N நீர்த்த கந்தக அமிலத்தைச் சேர்க்க. இக்கரைசலை பியூரெட்டில் எடுத்துக் கொள்ளப்பட்ட KMnO4 கரைசலுடன் தரம் பார்க்க. தரம் பார்த்தலின் போது வினை நிகழ்வதால் சேர்க்கப்படும் KMnO4 ன் நிறம் மறையும். ஆக்சிஜனேற்ற ஒடுக்க வினை நிறைவடையும் நிலையில் சேர்க்கப்படும் KMnO4 வினை ஏதும் புரியாமல் கரைசலில் அப்படியே இருப்பதால் வெளிறிய இளஞ்சிவப்பு நிறம் தோன்றும். இதுவே முடிவு நிலையாகும். இந்நிலையில் பியூரெட் அளவீட்டினை அட்டவணையில் குறித்து கொள்க. ஒத்த தரம் பார்த்தல் அளவீடுகளைப் பெறும் வரையில் தரம் பார்த்தலை மீளவும் நிகழ்த்தவும்.
தரம் பார்த்தல்- I
KMnO4 இணைப்புக் கரைசல் Vs FeSO4 திட்டக் கரைசல்
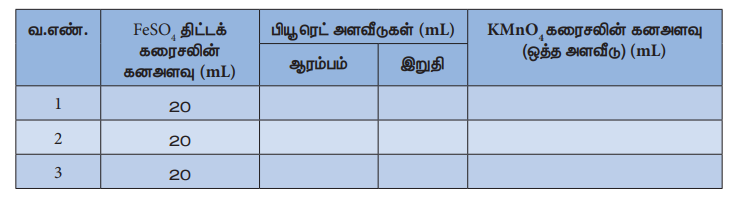
கணக்கிடுதல்
KMnO4 இணைப்புக் கரைசலின் கனஅளவு (V1) = ---------------mL
KMnO4 இணைப்புக் கரைசலின் திறன் (N1) = ----------------N
FeSO4 திட்ட கரைசலின் கன அளவு (V2) = ----- 20 ------------mL
FeSO4 திட்ட கரைசலின் திறன் (N2) = 0.1024N
பருமனறி பகுப்பாய்வுத் தத்துவத்தின்படி, V1 × N1 = V2× N2
N1 = V2× N2 / V1
KMnO4 இணைப்புக் கரைசலின் திறன் (N1) = --------N
தரம் பார்த்தல் - II
KMnO4 இணைப்புக் கரைசல் VS திறனறியா FAS கரைசல்
பியூ ரெட்டை நீரினால் நன்கு கழுவ வேண்டும். பின்னர் தரம் பார்த்தலுக்கு என கொடுக்கப்பட்டுள்ள KMnO4 இணைப்புக் கரைசலில் சிறிதளவு பியூரெட்டில் எடுத்துக் கொண்டு அக்கரைசல் பியூரெட் முழுமையும் படுமாறு சுழற்றிக் கழுவுதல் வேண்டும். இதன் பிறகு, கொடுக்கப்பட்டுள்ள KMnO4 கரைசலைக் கொண்டு பியூரெட்டில் பூஜ்ஜியக் குறியீட்டு அளவு வரை நிரப்புக. மிகச்சரியாக 20mL திறனறியா FAS கரைசலை பிப்பெட்டைக் கொண்டு உறிஞ்சி எடுத்து நன்கு கழுவப்பட்ட கூம்புக் குடுவையில் இடுக. மேலும் இதனுடன் 20mL 2N நீர்த்த கந்தக அமிலத்தை சேர்க்க. இக்கரைசலை பியூரெட்டில் எடுத்துக் கொள்ளப்பட்ட KMnO4 கரைசலுடன் தரம் பார்க்க. தரம் பார்த்தலின் போது வினை நிகழ்வதால் சேர்க்கப்படும் KMnO4 ன் நிறம் மறையும். ஆக்சிஜனேற்ற ஒடுக்க வினை நிறைவடையும் நிலையில் சேர்க்கப்படும் KMnO4 , வினை ஏதும் புரியாமல் கரைசலில் அப்படியே இருப்பதால் வெளிறிய இளஞ்சிவப்பு நிறம் தோன்றும். இதுவே முடிவு நிலையாகும். இந்நிலையில் பியூரெட் அளவீட்டினை அட்டவணையில் குறித்து கொள்க. ஒத்த தரம் பார்த்தல் அளவீடுகளை பெறும் வரையில் தரம் பார்த்தலை மீளவும் நிகழ்த்தவும்.
தரம் பார்த்தல் - II
KMnO4 இணைப்புக் கரைசல் VS திறனறியா FAS கரைசல்
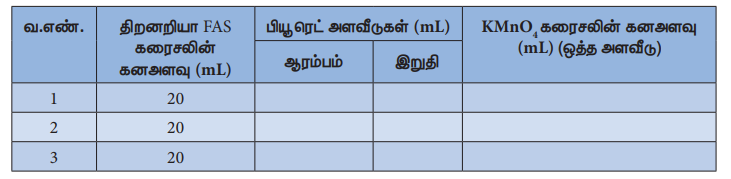
கணக்கிடுதல்
திறனறியா FAS கரைசலின் கனஅளவு (V1) = ------20------mL
திறனறியா FAS கரைசலின் திறன் (N1) = ---------------------N
KMnO4 இணைப்புக் கரைசலின் கனஅளவு (V2) = -------------mL
KMnO4 இணைப்புக் கரைசலின் திறன் (N1) = -------------------N
பருமனறி பகுப்பாய்வு தத்துவத்தின்படி, V1N1 = V2N2
N1 = V2 × N2 / V1
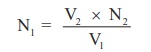
திறனறியா FAS கரைசலின் திறன் (N1) = -------------------N
நிறை கணக்கிடுதல்
1 லிட்டர் கரைசலில் கரைந்துள்ள படிக சமான நிறை = FAS கரைசலின் திறன் (நார்மாலிட்டியில்) x FAS ன் சமான நிறை
1500 mL கரைசலில் கரைந்துள்ள படிக FASன் நிறை
= FAS கரைசலின் திறன் × 392 × 1500 / 10000
= ------------------கிராம்

முடிவு
கொடுக்கப்பட்ட கரைசலில் 1500 mL-ல் கரைந்துள்ள படிக FAS ன் நிறை
=---------------------கிராம்.