பொதுப் மற்றும் வேதிப் பண்புகள், பெரிலியத்தின் தனித்துவமிக்கத் தன்மை, பயன்கள் - காரமண் உலோகங்கள் | 11th Chemistry : UNIT 5 : Alkali and Alkaline Earth Metals
11 வது வேதியியல் : அலகு 5 : கார மற்றும் காரமண் உலோகங்கள்
காரமண் உலோகங்கள்
காரமண் உலோகங்கள்
நவீன தனிம வரிசை அட்டவணையில் இரண்டாம் தொகுதியானது பெரிலியம், மெக்னீசியம், கால்சியம், ஸ்ட்ரான்சியம், பேரியம் மற்றும் ரேடியம் ஆகிய தனிமங்களைக் கொண்டுள்ளது. பெரிலியத்தினை தவிர்த்து, பிற தனிமங்களின் ஆக்சைடுகள் மற்றும் ஹைட்ராக்சைடுகள் காரத்தன்மையினைப் பெற்றுள்ளமை மற்றும் அவற்றின் ஆக்சைடுகள் புவியில் தாதுக்களாகக் காணப்படும் தன்மை ஆகியவற்றால் இத்தனிமங்கள் பொதுவாக காரமண் உலோகங்கள் என அழைக்கப்படுகின்றன.

படம் 5.5 காரமண் உலோகங்கள்
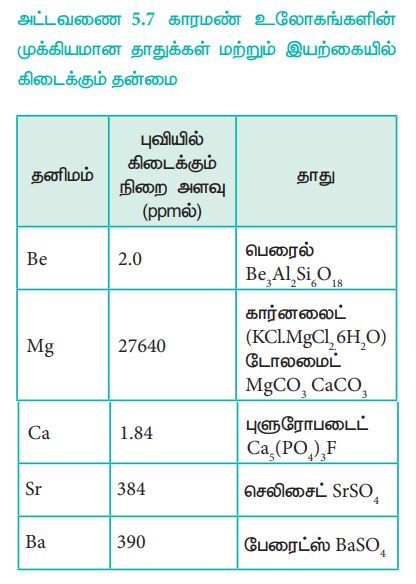
அட்டவணை 5.7 காரமண் உலோகங்களின் முக்கியமான தாதுக்கள் மற்றும் இயற்கையில் கிடைக்கும் தன்மை
1. காரமண் உலோகங்களின் பொதுப் பண்புகள்
இயற்நிலைமை
பெரிலியம் அரிதானது. மேலும் ரேடியம் மிகவும் அரிதானதாகும். வெப்பப் பாறைகளில் 10 சதவீதம் மட்டும் காணப்படுகிறது. புவி மேலடுக்கில் பொதுவாகக் காணப்படும் தனிமங்களாக மெக்னீசியம் மற்றும் கால்சியம் உள்ளன.
அதிக அளவு கிடைக்கப்பெறும் தனிமங்களில் கால்சியம் ஐந்தாவதாகவும், மெக்னீசியம் எட்டாவதாகவும் உள்ளன. மேலும் பல பாறைகள் மற்றும் தாதுக்களில் மெக்னீசியம் மற்றும் கால்சியம் காணப்படுகின்றது. கார்னலைட், டோலமைட், மேக்னசைட் ஆகியவற்றில் மெக்னீசியமும், சுண்ணாம்புக்கல், ஜிப்சம் ஆகியவற்றில் கால்சியமும் காணப்படுகின்றன. பெரும்பாலான ஸ்ட்ரான்சியம் ஆனது செலிசைட் மற்றும் ஸ்ட்ரான்சியோனைட்டில் காணப்படுகிறது. பேரியம் பெரும்பாலும் பேரைட் தாதுவில் உள்ளது. யுரேனியத்தின் கதிரியக்கத் தன்மையின் விளைவாக உருவாகும் பொருள் ரேடியம். ஆதலால் யுரேனியத்தைக் கொண்டுள்ள தாதுக்களில்ரேடியம் காணப்படுகின்றது.
உங்களுக்குத் தெரியுமா?
வான வேடிக்கை

பெரும்பாலான கார மற்றும் காரமண் உலோகங்கள் வண்ணங்களை உருவாக்க பயன்படுகின்றன. ஸ்ட்ரான்சியம் மற்றும் பேரியம் போன்றவை வான வேடிக்கை நிகழ்வுகளில் வண்ணம் உருவாக்கப் பயன்படுகின்றன. குளோரின் தனிமத்துடன் சேர்ந்து பேரியம் பச்சை நிற தீப்பொறிகளை உருவாக்குகிறது. கால்சியம் ஆரஞ்சு நிறத்தையும், லித்தியம் ஓரளவு சிவப்பு நிறத்தையும் தருகிறது. ஸ்ட்ரான்சியம் கார்பனேட் பிரகாசமான சிவப்பு நிறத்தையும், சோடியத்தின் நைட்ரேட்டுகள் ஆரஞ்சு நிறத்தையும் தருகிறது. பொட்டாசியம் மற்றும் ருபீடியம் கருஊதா நிறத்தையும், சீசியம் இண்டிகோ நிறத்தையும் தருகிறது. எரிதலால், எலக்ட்ரான்கள் கிளர்வுறுகின்றன. வழக்கமான ஆற்றல் மட்டதை விட, அதிக ஆற்றல் மட்டத்திற்குச் செல்கிறது. அவற்றின் அதிகப்படியான ஆற்றலை அவைகள் நிறமுள்ள வெடிப்பு ஒளியாக வெளியிடுகின்றன.
வெப்பச்சுடரில் காப்பர் கார்பனேட்டானது சிதைவடையும் என்பதால் நீல நிறமுள்ள வான வேடிக்கையினை உருவாக்குவது கடினமானதாகும். சமீப காலங்களில் வான வேடிக்கை வல்லுநர்கள் காரமண் உலோகமான மெக்னீசியம் மற்றும் அலுமினியத்தின் உலோகக்கலவை மெக்னாலியத்தினை வான வேடிக்கை நிறங்களை வலுப்படுத்த பயன்படுத்துகின்றனர். மெக்னாலியம் நீல நிறத்தினை மேலும் வலுப்படுத்துகிறது. எனினும், சிவப்பு, பச்சை, மஞ்சள் நிறங்களைப் போன்று பிரகாசமான நீல நிறத்தினைப் பெற வெப்ப நுட்பவியலாளர்கள் தொடர்ந்து முயன்று வருகின்றனர்.
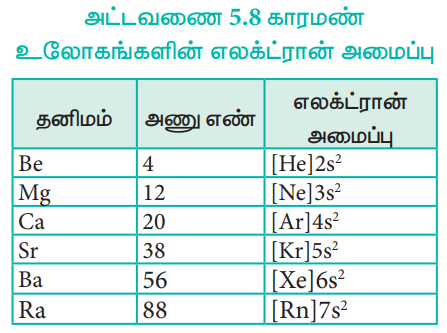
எலக்ட்ரான் அமைப்பு
இத்தனிமங்கள் அவற்றின் அணுக்களில், மந்த வாயு எலக்ட்ரான் அமைப்பினைத் தொடர்ந்து இணைதிறக் கூட்டில் இரண்டு எலக்ட்ரான்களைப் பெற்றுள்ளன. இவைகளின் பொதுவான எலக்ட்ரான் அமைப்பு (மந்தவாயு) ns2. இங்கு 'n' என்பது இணைதிறன் கூட்டைக் குறிப்பிடுகிறது.
அட்டவணை 5.8 காரமண் உலோகங்களின் எலக்ட்ரான் அமைப்பு
அணு மற்றும் அயனி ஆரம்
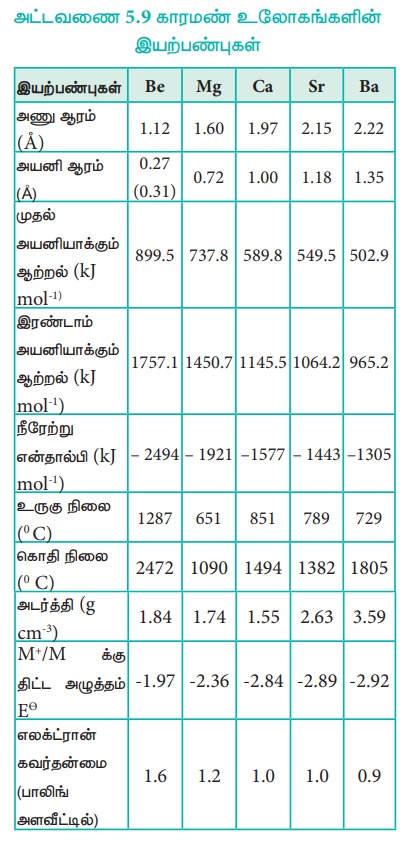
காரமண் உலோகங்களின் அணு மற்றும் அயனி ஆரங்களின் மதிப்புகள் அவற்றிற்கு இணையான கார உலோகங்களைக் காட்டிலும் குறைவானதாகும். ஏனெனில் இரண்டாம் தொகுதி தனிமங்கள் அதிக அணுக்கரு மின் சுமையைப் பெற்றிருப்பதால் அவைகளின் எலக்ட்ரான்கள் அணுக்கருவினை நோக்கி வலிமையாகக் கவரப்படுகின்றன. தொகுதியில் மேலிருந்து கீழே வரும் போது, கூடுகளின் எண்ணிக்கை மற்றும் திரை மறைப்பு விளைவு அதிகரிப்பதால் அணு ஆரம் அதிகரிக்கின்றது.
பொதுவான ஆக்ஸிஜனேற்ற நிலை
இரண்டாம் தொகுதி தனிமங்கள், அவைகளின் இணைதிற கூட்டில் இரண்டு எலக்ட்ரான்களைக் கொண்டுள்ளன. அவைகளை இழப்பதன் மூலம் மந்தவாயுவின் எலக்ட்ரான் அமைப்பினைப் பெறுகின்றன. எனவே இவற்றின் சேர்மங்களில் +2 ஆக்சிஜனேற்ற நிலையில் காணப்படுகின்றது.
அயனியாக்கும் ஆற்றல்
‘p' தொகுதி தனிமங்களோடு ஒப்பிடும் போது, காரமண் உலோகங்கள் ஓரளவிற்கு பெரிய உருவளவினைப் பெற்றிருப்பதாலும், தொகுதியில் கீழாக, அணுவின் உருவளவு அதிகரிப்பதாலும், அயனியாக்கும் ஆற்றல் குறைகிறது. புதிய கூடுகள் உருவாக்கப்படுதல் மற்றும் உட்கூட்டில் உள்ள எலக்ட்ரான்களின் திரைமறைப்பு விளைவு அதிகமாதல் ஆகியவை இதற்குக் காரணமாக அமைகின்றன. முதல் தொகுதி தனிமங்களைக் காட்டிலும், இரண்டாம் தொகுதி தனிமங்களின் அயனியாக்கும் ஆற்றல் அதிகம். ஏனெனில் அவைகள் சிறிய உருவளவினைப் பெற்றிருக்கின்றன. மேலும் எலக்ட்ரான்கள் அணுக்கருவினை நோக்கி ஈர்க்கப்படுகின்றன. இவை கார உலோகங்களைக் காட்டிலும் குறைவான நேர்மின் தன்மையினைக் கொண்டுள்ளன.
அட்டவணை 5.9 காரமண் உலோகங்களின் இயற்பண்புகள்
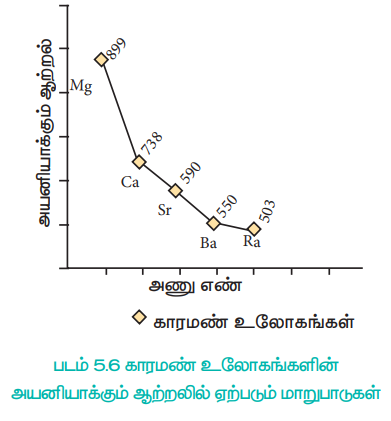
படம் 5.6 காரமண் உலோகங்களின் அயனியாக்கும் ஆற்றலில் ஏற்படும் மாறுபாடுகள்
காரஉலோகங்களைக் காட்டிலும், காரமண் உலோகங்களின் முதல் அயனியாக்கும் ஆற்றல் (IE1) அதிகமாக இருந்தபோதிலும், இரண்டாம் அயனியாக்கும் ஆற்றல் மதிப்பு (IE2) ஆனது, கார உலோகங்களைக் காட்டிலும் மிக குறைவாக உள்ளது.
ஏனெனில் காரஉலோகங்களில், இரண்டாவது எலக்ட்ரானானது, ஏற்கெனவே நிலையான மந்த வாயுவின் எலக்ட்ரான் அமைப்பினைப் பெற்றுள்ள ஒற்றை நேர்மின் சுமையுடைய அயனியிலிருந்து நீக்கப்பட வேண்டும். காரமண் உலோகங்களைப் பொறுத்த வரையில், அவற்றின் ஒற்றை நேர்மின் சுமையுடைய அயனியானது அவைகளின் இணைதிறன் கூட்டில் இன்னும் ஒரு எலக்ட்ரானைப் பெற்றிருப்பதால் அவைகளை எளிதாக நீக்க இயலும்.
நீரேற்று என்தால்பி
கார உலோகங்களைக்காட்டிலும், காரமண் உலோகங்கள் அதிக அளவில் நீரேற்றமடைகின்றன. ஏனெனில் காரமண் உலோக அயனிகளின் நீரேற்று ஆற்றலானது கார உலோக அயனிகளின் நீரேற்று ஆற்றலை விட அதிகம். கார உலோகங்களைப் போன்றே, காரமண் உலோக அயனிகளின் ஆரம் தொகுதியில் அதிகரிக்கும்போது, அவற்றின் நீரேற்று ஆற்றல் குறைகிறது.
Be > Mg > Ca > Sr > Ba
எடுத்துக்காட்டு: மெக்னீஷியம் குளோரைடு மற்றும் கால்சியம் குளோரைடு ஆகியவை முறையே MgCl2.6H2O மற்றும் CaCl2.6H2O ஆகிய நீரேற்ற சேர்மங்களாகக் காணப்படுகின்றன. ஆனால் NaCl மற்றும் KCl போன்றவை இத்தகைய ஹைட்ரேட்டுகளைத் தருவதில்லை.
எலக்ட்ரான் கவர் தன்மை
கார உலோகங்களைப் போன்றே, காரமண் உலோகங்களிலும் தொகுதியில் மேலிருந்து கீழே எலக்ட்ரான் கவர்தன்மை மதிப்பு குறைகிறது.
சுடரில் நிறம் தருதல் மற்றும் நிறமாலை
ஹைட்ரோ குளோரிக் அமிலத்தை சேர்த்து ஈரமாக்கப்பட்ட காரமண் உலோக உப்புகள் பிளாட்டினக் கம்பி மூலம் சுடரில் காட்டப்படும்போது, அவைகள் கீழே கண்டுள்ளவாறு குறிப்பிட்ட நிறச்சுடரைத் தருகின்றன.
அட்டவணை 5.10 சுடர் நிறம் மற்றும் அலைநீளம்
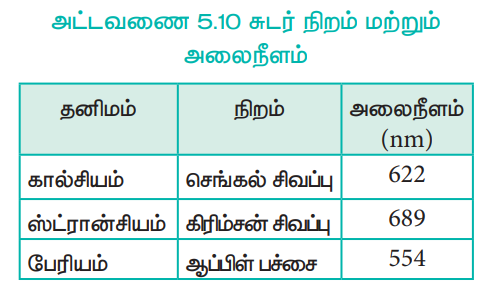
சுடரின் வெப்பத்தால் இணைதிற எலக்ட்ரான்கள் கிளர்வுற்று அதிக ஆற்றல் நிலைக்குச் செல்கின்றன. இவை அவற்றின் உண்மையான ஆற்றல் நிலைக்குத் திரும்பும்போது, கூடுதல் ஆற்றலை ஒளியாக உமிழ்கிறது. இந்த ஒளியின் அலைநீளம் கட்புலனாகும் பகுதியில் மேற்கண்டுள்ள அட்டவணையில் குறிப்பிட்டுள்ளவாறு அமைந்துள்ளது.

படம் 5.7 காரமண் உலோகங்களின் நிறச்சுடர்கள்
2. பெரிலியத்தின் தனித்துவமிக்கத் தன்மை
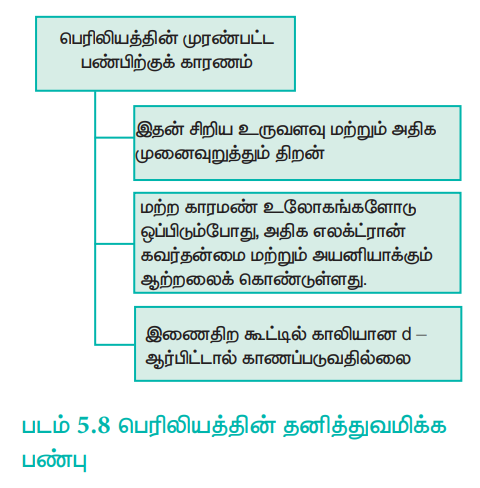
பெரிலியம் முரண்பட்ட பண்புகளைப் பெற்றிருப்பதற்கு முக்கியக் காரணம் அத்தொகுதியில் உள்ள மற்ற தனிமங்களைக் காட்டிலும் இதன் சிறிய உருவளவு, அதிக எலக்ட்ரான் கவர்தன்மை, அதிக அயனியாக்கும் ஆற்றல் மற்றும் அதிக முனைவுறுத்தும் தன்மை ஆகியவையாகும். அத்தொகுதியில் உள்ள மற்ற தனிமங்களோடு ஒப்பிடும்போது பெரிலியத்தின் முரண்பட்ட பண்புகள் அட்டவணை 5.11 ல் குறிப்பிடப்பட்டுள்ளது.
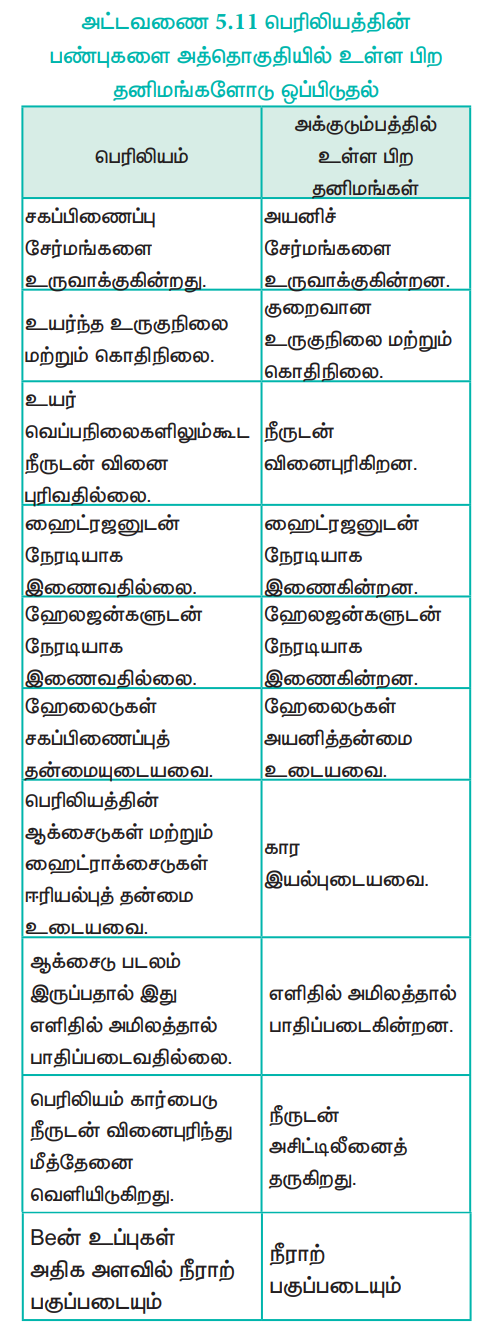
அட்டவணை 5.11 பெரிலியத்தின் பண்புகளை அத்தொகுதியில் உள்ள பிற தனிமங்களோடு ஒப்பிடுதல்
மூலைவிட்டத் தொடர்பு
கார உலோகங்களைப் போன்றே, பெரிலியமும் (இரண்டாம் தொகுதியின் முதல் தனிமத்துடன்) அலுமினியத்துடன் மூலைவிட்டத் தொடர்பினைக் கொண்டுள்ளது. இந்நேர்வில், இந்த அயனிகளின் உருவளவுகள் (rBe2+ = 0.45 Å மற்றும் rAl3+ = 0.54 Å) அதிக அளவில் நெருக்கமான மதிப்புகளைக் கொண்டிருக்கவில்லை. எனினும் ஒரலகு பரப்பில் அவைகளின் அடர்த்தியானது நெருக்கமான மதிப்புகளைப் பெற்றுள்ளன (Be2+ = 2.36 மற்றும் Al3+ = 2.50) இவைகளின் எலக்ட்ரான் கவர்தன்மை மதிப்புகளும் சமம் (Be = 1.5; Al = 1.5)
அட்டவணை 5.12 பெரிலியம் மற்றும் அலுமினியத்திற்கு இடையேயான ஒற்றுமைகள்

3. காரமண் உலோகங்களின் வேதிப்பண்புகள்
கார உலோகங்களைக் காட்டிலும், காரமண் உலோகங்கள் குறைவான வினைத்திறனைப் பெற்றுள்ளன. தொகுதியில் கீழே வரும் போது இவற்றின் வினைத்திறன் அதிகரிக்கின்றது.
ஹாலஜன்களுடன் வினை
அதிக வெப்ப நிலையில், அனைத்து காரமண் உலோகங்களும், ஹாலஜன்களுடன் இணைந்து, அவைகளின் ஹாலைடுகளை உருவாக்குகின்றன.
M + X2 → MX2
(M = Be, Mg, Ca, Sr, Ba, Ra,
X = F, Cl, Br, l )
(NH4)2 BeF4 வெப்பச் சிதைவடையச் செய்தல் வினையானது BeF2 தயாரிக்க சிறந்த முறையாகும். BeCl2 வை அதன் ஆக்சைடிலிருந்து எளிதாக தயாரிக்கலாம்.
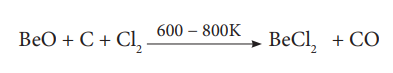
ஹைட்ரஜனுடன் வினை
பெரிலியத்தினைத் தவிர்த்து பிற தனிமங்கள் வெப்பப்படுத்தும் போது, ஹைட்ரஜனுடன் இணைந்து MH2 என்ற பொது வாய்ப்பாடுடைய ஹைட்ரைடுகளைத் தருகிறது. BeCl2 மற்றும் LiAlH4 ஆகியவற்றை வினைப்படுத்துவதன் மூலம் BeH2 ஐத் தயாரிக்கலாம்.
2 BeCl2 + LiAlH4 → 2 BeH2 + LiCl + AlCl3
4. காரமண் உலோகங்களின் பயன்கள்
பெரிலியத்தின் பயன்கள்
1. குறைந்த அணு எண் மற்றும் X-கதிர்களை உட்கவர்தல் குறைவாக இருப்பதால், X-கதிர் குழாய்களின் வெளியேறும் பகுதி மற்றும் X-கதிர் கண்டுணர்விகளில் பயன்படுகிறது.
2. கதிர் உமிழ்வு ஆய்வுகளில் மாதிரியினை வைக்கும் கலன்கள் பொதுவாக பெரிலியத்தினால் தயாரிக்கப்படுகிறது.
3. ஆற்றல் மிக்க துகள்களை தன்வழியே அனுமதிப்பதால், இது துகள் முடுக்கிகளில் பயன்படும் குழாய்களில் பயன்படுகிறது.
4. குறைவான அடர்த்தி மற்றும் டயாகாந்தப் பண்பினைப் பெற்றிருப்பதால், பல்வேறு கண்டுணர்விகளில் பயன்படுகிறது.
மெக்னீசியத்தின் பயன்கள்
1. இரும்பு மற்றும் எஃகிலிருந்து சல்பரை நீக்கப் பயன்படுகிறது.
2. அச்சிடும் தொழிலில் நிழற்பட அச்சு பதிவுகளை உருவாக்கப் பயன்படும் தகடுகளாகப் பயன்படுகிறது.
3. ஆகாய விமானங்கள் மற்றும் ஏவுகணைகள் தயாரிப்பதில் மெக்னீசியத்தின் உலோகக் கலவைகள் பயன்படுகிறது.
4. கரிம தொகுப்பு வினைகளில் பயன்படும் கிரிக்னார்டு வினைபொருளை தயாரிக்க மெக்னீஷியம் நாடா பயன்படுகிறது.
5. அலுமினியத்தின் இயந்திரவியல், வெட்டி ஒட்டும் தன்மை ஆகியவற்றை மேம்படுத்தும் பொருட்டு மெக்னீசியத்துடன் உலோக கலவையாக்கப்படுகிறது.
6. உலர்த்தியாகப் பயன்படுகிறது.
7. கால்வானிக் அரிமானத்தை கட்டுப்படுத்த தன்னை அழித்துக்கொள்ளும் மின்வாயாக பயன்படுகிறது.
கால்சியத்தின் பயன்கள்
1. யுரேனியம், ஜிர்கோனியம் மற்றும் தோரியம் ஆகியவற்றின் உலோகவியலில் ஒடுக்கும் காரணியாகச் செயல்படுகிறது.
2. பல்வேறு பெர்ரஸ் மற்றும் பெர்ரஸ் அற்ற உலோகக் கலவைகளுக்கு, ஆக்சிஜன் நீக்கி, சல்பர் நீக்கி மற்றும் கார்பன் நீக்கியாகப் பயன்படுகிறது.
3. கட்டுமானத்திற்கு பயன்படும் சிமெண்ட் மற்றும் கலவைகள் தயாரிப்பதில் பயன்படுகிறது.
4. வெற்றிடக் குழாய்களில் வாயு மாசு நீக்கியாகப் பயன்படுகிறது.
5. எண்ணெய்களில் நீர்நீக்கியாகப் பயன்படுகிறது.
6. உரங்கள், கான்கீரிட்டுகள் மற்றும் பாரீஸ்சாந்து ஆகியவற்றில் உள்ளது.
ஸ்ட்ரான்சியத்தின் பயன்கள்
1. 90Sr ஆனது கேன்சர் மருத்துவத்தில் பயன்படுகிறது.
2. 87Sr / 86Sr விகிதமானது, கடல்சார் ஆய்வுகள் மற்றும் விலங்குகளின் இடப்பெயர்ச்சினை தொடர்தல், குற்ற தடயவியலில் பயன்படுகிறது.
3. பாறைகளின் வயதை தீர்மானப்பதில் பயன்படுகிறது.
4. பழங்கால புராதன பொருட்கள், நாணயங்கள் ஆகியவற்றின் மூலங்களை கண்டறிய கதிரியக்க சுவடறிவானகப் பயன்படுகிறது.
பேரியத்தின் பயன்கள்
1. உலோகவியலில் பயன்படுகிறது. இதன் சேர்மங்கள் பெட்ரோலிய சுரங்கம், கதிரியக்கவியல் மற்றும் வெப்ப தொழிற்நுட்பங்களில் பயன்படுகிறது.
2. தாமிர (Copper) தூய்மையாக்களில் ஆக்சிஜன் நீக்கியாகப் பயன்படுகிறது.
3. இதன் நிக்கல் உலோகக் கலவை எளிதில் எலக்ட்ரானை உமிழும். எனவே, எலக்ட்ரான் குழாய்கள் மற்றும் மின்வாய்பொறிகளில் பயன்படுகிறது.
4. தொலைக்காட்சி மற்றும் மின்னணுவியல் குழாய்களில் எஞ்சியுள்ள ஆக்சிஜனை நீக்கப் பயன்படும் தூய்மையாக்கியாக பயன்படுகிறது.
5. பேரியத்தின் 133Ba - ஐசோடோப்பானது, அணுக்கரு வேதியியலில், காமா கதிர் கண்டுணர்வியை திட்ட அளவீடு செய்ய பயன்படுகிறது.
ரேடியத்தின் பயன்கள்
கடிகாரங்கள், அணுக்கரு தட்டுகள், வானூர்தி சாவிகள், உபகரண சுழற்றிகள் ஆகியவற்றிற்கான தானே ஒளிரும் மேற்பூச்சுகளில் ரேடியம் பயன்படுகிறது.