பொதுப் வேதிப் மற்றும் தனித்துவமான பண்புகள், பயன்கள் - கார உலோகங்கள் | 11th Chemistry : UNIT 5 : Alkali and Alkaline Earth Metals
11 வது வேதியியல் : அலகு 5 : கார மற்றும் காரமண் உலோகங்கள்
கார உலோகங்கள்
கார உலோகங்கள்
கார உலோக சேர்மங்களைக் கொண்டுள்ள தாவர சாம்பலை குறிக்கும் al-qaliy எனும் வார்த்தையிலிருந்து alkali என்ற வார்த்தை வருவிக்கப்பட்டுள்ளது. எரிக்கப்பட்ட தாவர சாம்பலின் நீர்ச்சாறு பொட்டாஷ் எனப்படுகிறது. இதில் முக்கியமாக பொட்டாசியம் கார்பனேட் காணப்படுகிறது. கார உலோக தொகுதியானது லித்தியம், சோடியம். பொட்டாசியம் ருபீடியம், சீசியம் மற்றும் ஃப்ரான்ஷியம், ஆகிய தனிமங்களைக் கொண்டுள்ளது இவை அனைத்தும் உலோகங்கள். பொதுவாக இவை மிருதுவானவை மேலும் அதிக வினைதிறன் கொண்டவை. இத்தனிமங்கள் ஆக்சைடுகள் மற்றும் ஹைட்ராக்சைடுகளை உருவாக்குகின்றன. இவற்றின் சேர்மங்கள் காரத்தன்மை கொண்டவையாக உள்ளன.
1. கார உலோகங்களின் பொதுப் பண்புகள்:
கார உலோகங்கள் அதிக வினைதிறன் கொண்டவை மேலும் இயற்கையில் இவைகள் சேர்மங்களாக மட்டுமே காணப்படுகின்றன. ருபீடியம் மற்றும் சீசியம் ஆகியன மிகக் குறைவான அளவில் கார உலோக தாதுக்களுடன் சேர்ந்து காணப்படுகின்றன. ஃப்ரான்ஷியம் இயற்கையில் குறிப்பிடத்தகுந்த அளவில் காணப்படவில்லை. மேலும் மிக அதிக கதிரியக்கத் தன்மை கொண்டது. அதன் அதிக நிலைப்புத் தன்மை உடைய ஐசோடோப்பின் அரைவாழ் காலம் 21 நிமிடங்கள் மட்டுமே.
அட்டவணை 5.1 கார உலோகங்களின் வளம் மற்றும் அவற்றின் மூலங்கள்
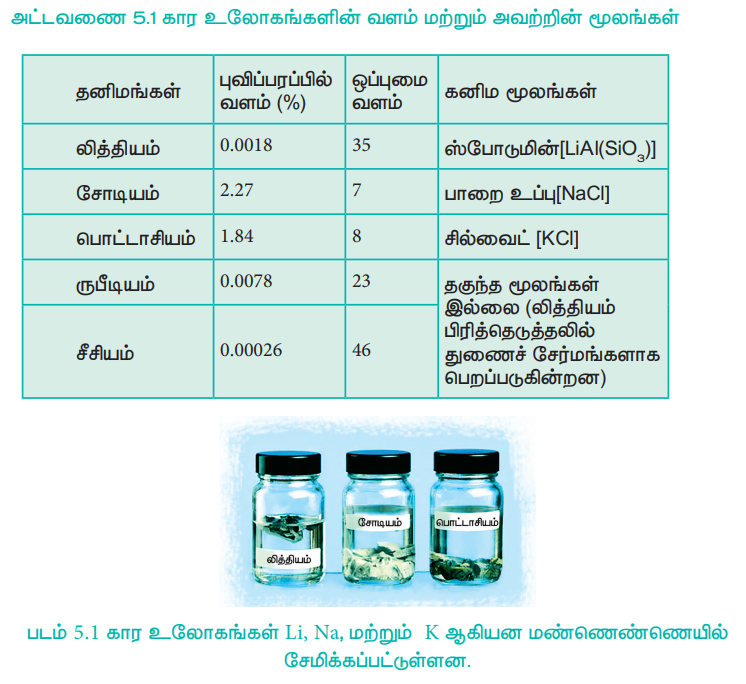
படம் 5.1 கார உலோகங்கள் Li, Na, மற்றும் K ஆகியன மண்ணெண்ணெயில் சேமிக்கப்பட்டுள்ளன.
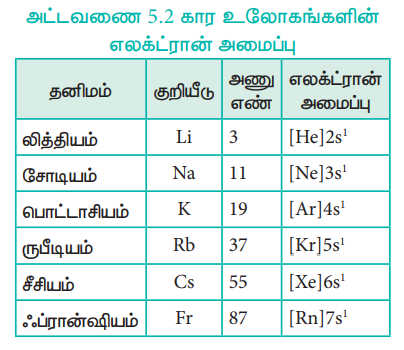
எலக்ட்ரான் அமைப்பு:
கார உலோகங்களின் பொதுவான இணைதிறன் கூட்டு எலக்ட்ரான் அமைப்பு ns1, இங்கு n என்பது வரிசை எண்ணைக் குறிப்பிடுகிறது.
அட்டவணை 5.2 கார உலோகங்களின் எலக்ட்ரான் அமைப்பு
பொதுவான ஆக்ஸிஜனேற்ற நிலை:
இந்த தனிமங்கள் அனைத்தும் அதிக நேர்மின்தன்மை கொண்டவையாக உள்ளன. இவைகள் எளிதில் தங்களின் இணைதிறன் கூட்டு எலக்ட்ரானை இழந்து ஒற்றை மின்சுமையுடைய நேர்மின் அயனிகளை (M+) உருவாக்குகின்றன. கார உலோகங்கள் +1 என்ற ஒரே ஒரு ஆக்ஸிஜனேற்ற நிலையை மட்டுமே கொண்டுள்ளன.
அணு மற்றும் அயனி ஆரங்கள்:
ஒவ்வொரு வரிசையிலும் கார உலோகங்கள், முதல் தனிமமாக இருப்பதால் அந்தந்த வரிசைகளில் அதிகபட்ச அணு மற்றும் அயனி ஆரங்களைக் கொண்டுள்ளன. தொகுதியில் மேலிருந்து கீழாகச் செல்லும்போது, கூடுகளின் எண்ணிக்கை அதிகரிக்கிறது. எனவே அணு மற்றும் அயனி ஆரங்கள் அதிகரிக்கின்றன. எதிர்பார்த்ததைப் போலவே, ஒற்றை இணைதிறன் அயனிகள் (M+), அவற்றின் மூல அணுக்களைக்காட்டிலும் உருவளவில் சிறியவையாக உள்ளன.
அட்டவணை 5.3 கார உலோகங்களின் இயற் பண்புகள்
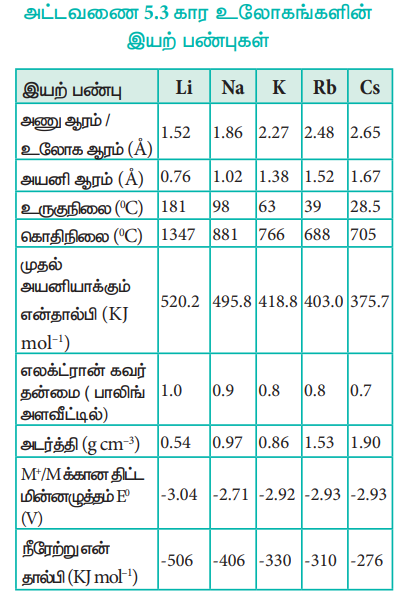
அயனியாக்கும் என்தால்பி
ஒவ்வொரு வரிசையிலும் உள்ள தனிமங்களுடன் ஒப்பிடும்போது உலோகங்கள், குறைந்தபட்ச அயனியாக்கும் என்தால்பி மதிப்புகளைக் கொண்டுள்ளன. நாம் ஒரு தொகுதியில் மேலிருந்து கீழாகச் செல்லும்போது, அணுவின் உருவளவு அதிகரிப்பதால் அயனியாக்கும் என்தால்பி குறைகிறது. மேலும் உள்கூடுகளின் எண்ணிக்கையும் அதிகரிக்கின்றன, இதன் விளைவாக திரைமறைப்பு விளைவும் அதிகரிக்கின்றது எனவே தொகுதியில் கீழாக செல்லச் செல்ல அயனியாக்கும் என்தால்பி குறைகிறது.
கார உலோகங்களின் இரண்டாம் அயனியாக்கும் என்தால்பி மதிப்புகள் மிக அதிகம். கார உலோகங்களிலிருந்து ஒரு எலக்ட்ரானை நீக்குவதால் ஒற்றை இணைதிறன் கொண்ட நேர்மின் அயனிகள் கிடைக்கின்றன, இந்த அயனிகள் மந்த வாயுக்களைப் போன்ற நிலையான எலக்ட்ரான் அமைப்பைப் பெற்றுள்ளன. எனவே, ஏற்கெனவே நிலைத்த எலக்ட்ரான் அமைப்பை அடைந்த அயனிகளிடமிருந்து, இரண்டாவதாக மேலும் ஒரு எலக்ட்ரானை நீக்குவது மிகக் கடினமாகிறது.
நீரேற்று என்தால்பி
லித்தியம் உப்புகள், மற்ற தொகுதி-1 உலோக உப்புகளை விட அதிக அளவில் கரைகின்றன. எடுத்துக்காட்டாக LiClO4 ஆனது NaClO4 விட 12 மடங்கு அதிகமாகக் கரைகிறது. KClO4 RbClO4 மற்றும் CsClO4 - யின் கரைதிறனானது LiClO4 இன் கரைதிறனைப்போல 10-3 மடங்கு குறைவான கரைதிறனை பெற்றுள்ளது. லித்தியம் உப்புகளின் அதிக கரைதிறனுக்கு காரணம் சிறிய உருவளவு கொண்ட Li+ அயனியானது எளிதில் நீரேற்றம் அடைவதே ஆகும்.
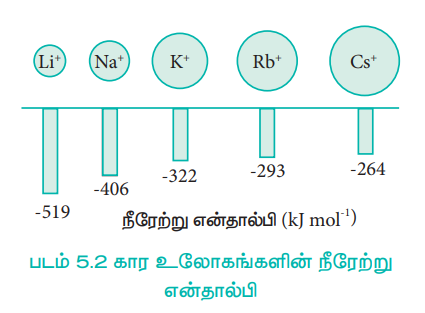
படம் 5.2 கார உலோகங்களின் நீரேற்று என்தால்பி
எலக்ட்ரான் கவர் தன்மை
ஒவ்வொரு வரிசைலும் உள்ள மற்ற தனிமங்களுடன் ஒப்பிடும்போது கார உலோகங்கள், குறைந்த எலக்ட்ரான் கவர் தன்மையைக் கொண்டுள்ளன. மற்ற தனிமங்களுடன் இவை வினைபுரியும் போது வழக்கமாக அயனிச் சேர்மங்களை உருவாக்குகின்றன. எடுத்துக்காட்டாக, கார உலோகங்கள் ஹேலஜன்களுடன் வினைப்பட்டு அயனி ஹேலைடுகளை உருவாக்குகின்றன.
சுடர் நிறம் மற்றும் நிறமாலை
கார உலோக உப்புகளை அடர் ஹைட்ரோகுளோரிக் அமிலத்தில் சேர்த்து ஈரமாக்கி, அதனை பிளாட்டின கம்பியின் முனையில் வைத்து சுடரில் வெப்பப்படுத்தும்போது, பின் வரும் அட்டவணையில் கொடுக்கப்பட்டுள்ளவாறு அதற்குரிய சுடர் நிறங்களைக் காட்டுகின்றன.
அட்டவணை 5.4 சுடரின் நிறம் மற்றும் அலைநீளங்கள்
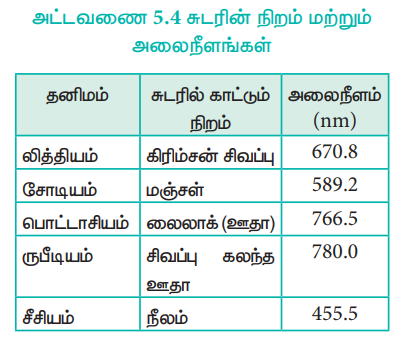
சுடரிலுள்ள வெப்பம், இணைதிறன் எலக்ட்ரானை உயர் ஆற்றல் மட்டத்திற்கு கிளர்வுறச் செய்கின்றது. இது மீளவும் அதன் இயல்பான ஆற்றல் நிலைக்கு திரும்பும்போது, அதிகப்படியான ஆற்றல், ஒளியாக வெளிவிடப்படுகிறது. இந்த ஒளியின் அலைநீளம் அட்டவணையில் காட்டியவாறு கட்புலனாகும் பகுதியில் உள்ளது.

படம் 5.3 சுடரில் கார உலோக உப்புகளின் நிறங்கள்.
2. லித்தியத்தின் தனித்துவமான பண்பு
Li+ அயனியின் தனித்துவமான பண்பிற்கான காரணங்கள் அதன் மிகச்சிறிய உருவளவு, அதிக முனைவாக்கும் திறன், அதிக நீரேற்றும் ஆற்றல் மற்றும் d-ஆர்பிட்டால்கள் இல்லாத்தன்மை போன்றவையே ஆகும்.
அட்டவணை 5.5 லித்தியம் மற்றும் அத்தொகுதியில் உள்ள மற்றதனிமங்களின் பண்புகளின் ஒப்பீடு

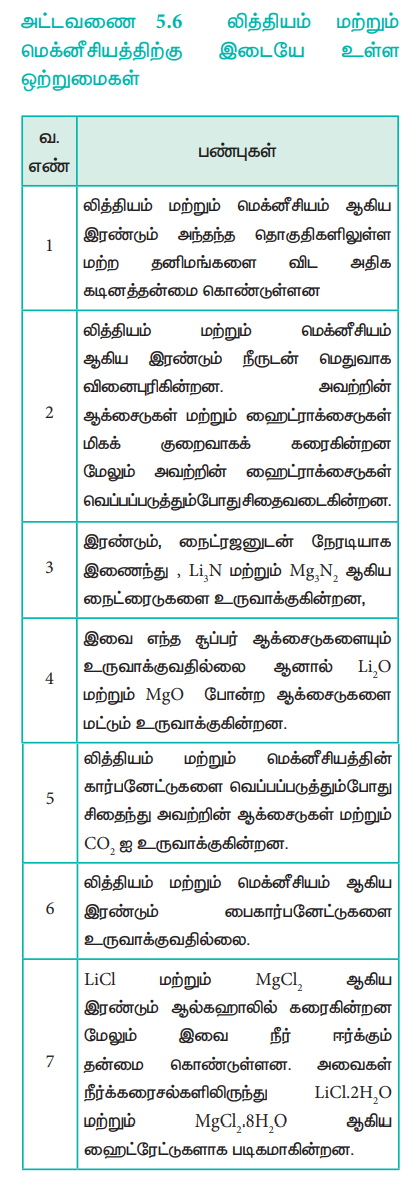
அட்டவணை 5.6 லித்தியம் மற்றும் மெக்னீசியத்திற்கு இடையே உள்ள ஒற்றுமைகள்
மூலைவிட்டத் தொடர்பு:
தொகுதி -1ல் உள்ள முதல் தனிமம் (Li) மற்றும் அதன் மூலைவிட்டத்தில் தொகுதி -2ல் இரண்டாவதாக அமைந்துள்ள தனிமம் (Mg) ஆகியவற்றிற்கிடையே உள்ள ஒத்த தன்மைகள் மூலைவிட்டத் தொடர்பு என்றழைக்கப்படுகிறது. இதற்கான காரணம் அவற்றின் ஒத்த உருவளவு (rLi+ = 0.766 Å மற்றும் rMg2+ = 0.72 Å) மற்றும் ஒப்பிடத்தகுந்த எலக்ட்ரான் கவர்திறன் மதிப்புகள் (XLi = 1.0; XMg = 1.2) ஆகியவையாகும்.
3. கார உலோகங்களின் வேதிப் பண்புகள்
கார உலோகங்கள் அதிக வினைதிறனைக் கொண்டுள்ளன. கார உலோகங்களின் இந்த வினைதிறன் Li லிருந்து Cs வரை அதிகரிக்கிறது. ஏனெனில் தொகுதியில் மேலிருந்து கீழாக அயனியாக்கும் ஆற்றல் குறைகிறது. அனைத்து கார உலோகங்களும், அதிக எலக்ட்ரான் கவர் தன்மை கொண்ட தனிமங்களான ஆக்சிஜன் மற்றும் ஹேலஜன்களுடன் மிக அதிக வீரியத்துடன் வினைபுரிகின்றன. கார உலோகங்களின் சில குறிப்பிடத்தகுந்த பண்புகள் கீழே விளக்கப்பட்டுள்ளன.
ஆக்ஸிஜனுடன் வினை
அனைத்து கார உலோகங்களும் காற்று அல்லது ஆக்சிஜனில் தீவிரமாக எரிந்து அவற்றின் புறப்பரப்பில் ஆக்சைடுகளை உருவாக்குகின்றன. லித்தியம் மோனாக்சைடை மட்டுமே உருவாக்குகிறது. சோடியம் மோனாக்சைடு மற்றும் பெராக்சைடை உருவாக்குகிறது. மற்ற தனிமங்கள் மோனாக்சைடு, பெராக்சைடு மற்றும் சூப்பர் ஆக்சைடுகளை உருவாக்குகின்றன. இந்த ஆக்சைடுகள் இயற்கையாகவே காரத்தன்மையைப் பெற்றுள்ளன.
4 Li + O2 → 2 Li2O (மோனாக்சைடு)
2 Na + O2 → Na2O2 (பெராக்சைடு)
M + O2 → MO2 (சூப்பர் ஆக்சைடு)
(M = K, Rb, Cs)
ஹைட்ரஜனுடன் வினை
அனைத்து கார உலோகங்களும் ஹைட்ரஜனுடன் சுமார் 673 K ( லித்தியம் 1073K வெப்பநிலையில்) வெப்பநிலையில் ஹைட்ரஜனுடன் வினைபுரிந்து அவற்றின் அயனி ஹைட்ரைடுகளை உருவாக்குகின்றன. ஹைட்ரஜனுடன் வினைபுரியும் திறன் கார உலோகங்களில், Li லிருந்து Cs வரை செல்லச் செல்ல குறைகிறது.
2M + H2 → 2 M+H-
(M = Li, Na, K, Rb, Cs)
ஹைட்ரைடுகளின் அயனிப்பண்பு Li லிருந்து Cs வரை செல்லச்செல்ல அதிகரிக்கிறது. மேலும் அவற்றின் நிலைப்புத்தன்மை குறைகிறது. இந்த ஹைட்ரைடுகள் சிறந்த ஒடுக்கும் வினைபொருட்களாக செயல் புரிகின்றன, மேலும் அவற்றின் ஒடுக்கும் தன்மை தொகுதியில் மேலிருந்து கீழாக அதிகரிக்கிறது.
ஹேலஜன்களுடன் வினை
கார உலோகங்கள் ஹேலஜன்களுடன் உடனடியாக வினைபுரிந்து MX என்ற அயனி ஹேலைடுகளைத் தருகின்றன. ஹேலஜன்களுடன் வினைபுரியும் திறன் கார உலோக தொகுதியில் மேலிருந்து கீழாக அதிகரிக்கிறது. ஏனெனில் அவற்றின் அயனியாக்கும் ஆற்றல் குறைகிறது.
2M + X2 → 2 MX
(M = Li, Na, K, Rb, Cs) (X = F, Cl, Br, I)
அனைத்து உலோக ஹேலைடுகளும் அயனிப் படிகங்கள் ஆகும். எனினும் லித்தியம் அயோடைடு, சகப்பிணைப்புப் பண்பை காட்டுகிறது. இதற்குக் காரணம் மிகச்சிறிய நேர்மின் அயனியானது எதிர்மின் அயனியை அதிக முனைவுறுத்தும் திறனை பெற்றுள்ளது. கூடுதலாக அயோடைடு அயனி மிகப்பெரியதாக இருப்பதால், Li+ அயனியால் மிக அதிக அளவிற்கு முனைவுறுத்தப்பட முடியும்.
திரவ அம்மோனியாவுடன் வினை
கார உலோகங்கள் திரவ அம்மோனியாவில் கரைந்து அடர் நீல நிறக் கரைசல்களைத் தருகின்றன. இந்தக் கரைசல்கள் மின்கடத்தும் தன்மை கொண்டவை. இவற்றின் கடத்துத்திறன் தூய உலோகங்களைப் போலவே உள்ளது (Hg ன் நியம கடத்துத்திறன் 104 Ω-1 திரவ அம்மோனியாவில் உள்ள சோடியத்தின் கடத்துத்திறன் 0.5 × 104 Ω-1). திரவ அம்மோனியாவில் கார உலோக அணுக்கள் தங்களின் இணைதிறன் எலக்ட்ரான்களை இழப்பதே இதற்குக் காரணம். நேர்மின் அயனி மற்றும் எலக்ட்ரான் இரண்டும் அம்மோனியா ஏற்றம் அடைந்து, அம்மோனியா ஏறிய நேரயனி மற்றும் அம்மோனியா ஏறிய எலக்ட்ரான் ஆகியவற்றைத் தருகின்றன.
M + (x + y) NH3 → [ M (NH3)x ]+ + [ e (NH3)y ]-
கரைசல் நீல நிறமாக இருப்பதற்கான காரணம், அம்மோனியா ஏறிய எலக்ட்ரான் கட்புலனாகும் ஒளி ஆற்றலை உறிஞ்சுகிறது, ஆதலால் கரைசலுக்கு நீல நிறத்தை அளிக்கிறது. இந்த கரைசல்கள் பாரா காந்தத் தன்மை கொண்டவை, மேலும் நீண்ட நேரம் வைக்கப்பட்டால் மெதுவாக ஹைட்ரஜன் வாயுவை வெளியேற்றி அமைடை உருவாக்குகின்றன.
M+ + e- + NH3 → MNH2 + 1/2 H2
அடர் கரைசல்களில் நீல நிறமானது வெண்கல நிறத்திற்கு மாறுவதுடன், கரைசல் டையா காந்தத் தன்மை கொண்டதாக மாறுகிறது.
நீருடன் வினை
கார உலோகங்கள் நீருடன் வினைப்பட்டு அவற்றின் ஹைட்ராக்சைடுகளைத் தருகின்றன. இதனுடன் ஹைட்ரஜன் வாயு வெளியேற்றப்படுகிறது.
2 Li + 2 H2O → 2 LiOH + H2
அவை மேலும் ஆல்கஹால் மற்றும் வினைதிறன் மிக்க ஹைட்ரஜன்களைக் கொண்ட ஆல்கைன்களுடன் வினைபுரிகின்றன.
2 Na + 2 C2H5OH → 2 C2H5ONa + H2
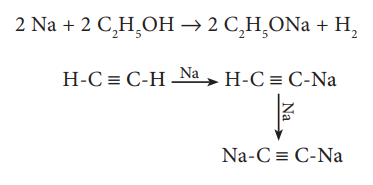
ஒடுக்கும் செயல்
கார உலோகங்கள், தங்களின் இணைதிறன் எலக்ட்ரான்களை எளிதில் இழக்க முடியும், இதனால் அவை சிறந்த ஒடுக்கும் வினைபொருட்களாகச் செயல்படுகின்றன.
M(s) → M+(g) + e-
கார்பனுடன் வினை
லித்தியம் நேரடியாக கார்பனுடன் வினைப்பட்டு லித்தியம் கார்பைடு என்ற அயனிச்சேர்மத்தை உருவாக்குகிறது. மற்ற உலோகங்கள் கார்பனுடன் நேரடியாக வினைபுரிவதில்லை. எனினும், அவற்றை அசிட்டிலீன் போன்ற கரிம சேர்மங்களுடன் வினைப்படுத்தும்போது, அவை அசிட்டிலைடுகளை உருவாக்குகின்றன.
2 Li + 2C → Li2C2
4. கார உலோகங்களின் பயன்கள்
i. லித்தியம், உலோக கலவைகள் தயாரிக்கப் பயன்படுகிறது. எடுத்துக்காட்டாக லித்தியத்தை லெட் உடன் சேர்த்து, மோட்டார் எஞ்சின்களில் பயன்படும் வெண்மை உலோக (white metal) பேரிங்குகள், அலுமினியத்துடன் சேர்த்து ஆகாய விமான பாகங்கள் மற்றும் மெக்னீசியத்துடன் சேர்த்து கேடயங்கள் ஆகியன தயாரிக்கப்படுகின்றன. இது வெப்ப உட்கரு வினைகளில் பயன்படுகிறது.
ii. லித்தியம், மின்வேதிக்கலன்கள் செய்யவும் பயன்படுகிறது.
iii. Pb(Et)4 மற்றும் Pb(Me)4 ஆகியவற்றை தயாரிக்க தேவைப்படும் Na-Pb உலோக கலவை தயாரிக்க, சோடியம் பயன்படுகிறது. இவை பெட்ரோலுடன் சேர்க்கப்படும் இடிப்பு எதிர்ப்பு (anti - knock) சேர்மங்களாக முன்னர் பயன்பட்டன. தற்காலத்தில் லெட் இல்லாத பெட்ரோல் பயன்பாட்டில் உள்ளது.
iv. திரவ சோடியம் அதிவேக ஈணுலைகளில் குளிர்விப்பானாகப் பயன்படுகிறது.
v. பொட்டாசியம் உயிரியல் அமைப்புகளில் முக்கிய பங்கு வகிக்கிறது. பொட்டாசியம் குளோரைடு உரம் தயாரித்தலில் பயன்படுகிறது
vi. பொட்டாசியம் ஹைட்ராக்சைடு மென் சோப்புகள் (soft soap) தயாரித்தலில் பயன்படுகிறது. மேலும் இது மிகச்சிறந்த கார்பன் டையாக்சைடு உறிஞ்சு பொருளாகவும் பயன்படுகிறது.
vii. சீசியம் ஒளிமின்கலன்களை வடிவமைத்தலில் பயன்படுகிறது.