பெயரிடும் முறை மற்றும் மாற்றியம், தயாரித்தல், கொதிநிலை மற்றும் இயற் நிலை, வச அமைப்புகள், பயன்கள், IUPAC பெயர்கள் | ஹைட்ரோகார்பன்கள் | வேதியியல் - ஆல்கேன்கள் | 11th Chemistry : UNIT 13 : Hydrocarbons
11 வது வேதியியல் : அலகு 13 : ஹைட்ரோகார்பன்கள்
ஆல்கேன்கள்
ஆல்கேன்கள்:
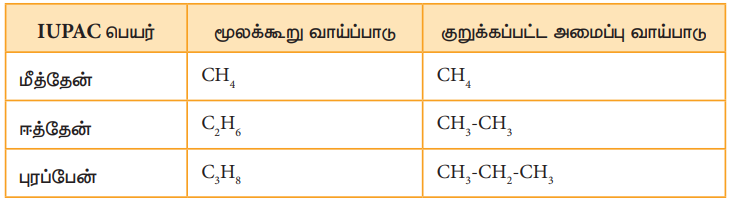
நிறைவுற்ற ஹைட்ரோகார்பனான ஆல்கேன்கள் CnH2n+2 என்னும் பொதுவான வாய்ப்பாட்டினால் குறிப்பிடப்படுகின்றன. இங்கு 'n' என்பது மூலக்கூறில் காணப்படும் கார்பன் அணுக்களின் எண்ணிக்கையாகும். ஆல்கேன் குடும்பத்தின் முதல் சேர்மம் மீத்தேன் CH4, ஆகும். ஆல்கேன் படிவரிசையின் அடுத்தடுத்த சேர்மங்கள் ஈத்தேன் C2H6, புரப்பேன் C3H8, பியூட்டேன் C4H10, பென்டேன் C5H12 முதலியனவாகும். படி வரிசையிலுள்ள அடுத்தடுத்த சேர்மங்கள் ஒரு –CH2 தொகுதியால் வேறுபடுகின்றன.
உங்களுக்குத் தெரியுமா?
வியாழன், சனி, யுரேனஸ், நெப்டியூன் ஆகிய கோள்களின் வளிமண்டலங்களில் முக்கிய கூறாக மீத்தேன் இடம் பெற்றுள்ளது. ஆனால், பூமியின் வளிமண்டலத்தில் சிறிதளவே காணப்படுகின்றது. எனினும், ஆக்சிஜன் பற்றாக்குறை சூழலை உடைய சதுப்பு நிலங்கள், சகதிகள், நதிகளின் படிவுகள் ஆகியனவற்றில் நடைபெறும் மடிந்த தாவரம் மற்றும் விலங்குகளின் சிதைவினால் மீத்தேன் உருவாகின்றது. எனவே, இதனை "சதுப்புநில வாயு" என அழைக்கிறோம். மேலும் இவை கரி மற்றும் பெட்ரோலிய படிவுகளிலும் காணப்படுகின்றன.
உங்களுக்குத் தெரியுமா?
"எரியும் பனிக்கட்டி"
இந்த வியத்தகு சொற்றொடரானது, நீர் மற்றும் மீத்தேன் வாயுவின் உறைந்த கலவையைக் குறிக்கின்றன. இது வேதியியலில் மீத்தேன் கிளாத்திரேட்டுகள் என அழைக்கப்படுகின்றன. ஆழ்கடலில் (4°C & 50 atm) உயிரியல் மாற்றத்தால் உருவாகும் மீத்தேன் மூலக்கூறு எளிதாக மேற்பரப்பை அடைவதில்லை. மாறாக ஒவ்வொரு மூலக்கூறும் 6 முதல் 18 நீர் மூலக்கூறுகளால் சூழப்பட்டு மீத்தேன் கிளாத்திரேட்டுகளை உருவாக்குகின்றன. இயற்கை வாயுவின் இந்த பரந்த ஆற்றல் மூலத்தை எவ்வாறு வெளிப்படுத்தி பயன்படுத்துவது என பல்வேறு நாடுகள் முயற்சி செய்து வருகின்றன. ஆனால் இதனை அகழ்ந்து எடுத்தல் மற்றும் பிரித்தெடுத்தல் மிகவும் கடினமானதாகும்.
பெயரிடும் முறை மற்றும் மாற்றியம்
அலகு 11-ல், கரிம சேர்மங்களின் பெயரிடும் முறையினை நாம் பயின்று உள்ளோம். தற்போது நாம் ஹைட்ரோ கார்பன்களின் பெயரிடும் முறை மற்றும் மாற்றியத்தினை சில உதாரணங்கள் மூலம் அறிந்துகொள்வோம். முதல் மூன்று சேர்மங்களான மீத்தேன் CH4, ஈத்தேன் C2H6 மற்றும் புரப்பேன் C3H8 ஆகியன ஒரே ஒரு அமைப்பை மட்டும் பெற்றிருக்கும்.
எனினும், உயரிய ஆல்கேன்கள் ஒன்றிற்கு மேற்பட்ட அமைப்புகளை பெற்றிருப்பதால், அவை அமைப்பு மாற்றியங்களை (இணைப்பில் மாறுபாடு) உருவாக்குகின்றன. உதாரணமாக,C4H10 என்னும் மூலக்கூறு வாய்ப்பாட்டினை உடைய ஆல்கேனிற்கு இரண்டு அமைப்புகள் உள்ளன. அவை n-பியூட்டேன் மற்றும் ஐசோ-பியூட்டேனாகும். n-பியூட்டேனில் உள்ள நான்கு கார்பன் அணுக்களும் நீண்ட சங்கிலி தொடராக அமைந்துள்ளன. ‘n' என்பது 'normal' அதாவது கார்பன் சங்கிலி தொடரில் கிளைகள் அற்ற தன்மையைக் குறிக்கின்றது. இரண்டாவது மாற்றியமான ஐசோ-பியூட்டேனில் கார்பன் சங்கிலி கிளைத்தொடராக உள்ளது. ஐசோ என்பது 'isomer' அதாவது 'மாற்றியம்' என்பதைக் குறிப்பிடுகின்றது.
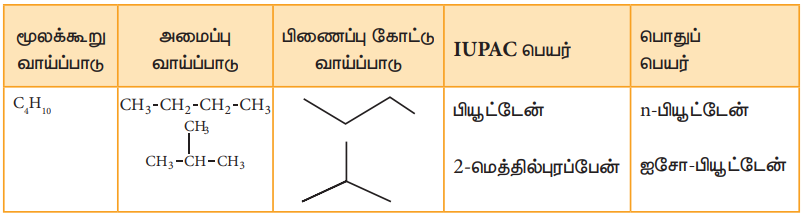
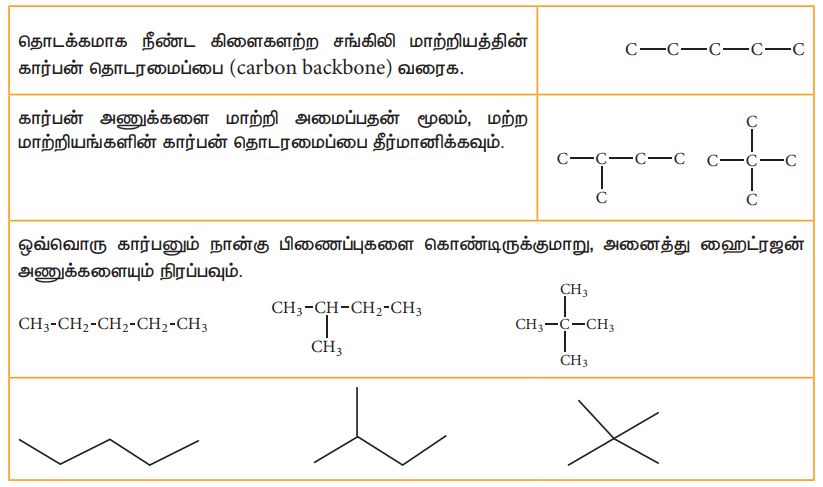
மேற்கண்டுள்ள இவ்விரு அமைப்புகளும் ஒரே மூலக்கூறு வாய்ப்பாட்டினை பெற்றிருப்பினும், கார்பன் சங்கிலி தொடரில் மாற்றம் காணப்படுவதால் சங்கிலி தொடர் மாற்றியத்தை உண்டாக்குகின்றன. பென்டேனின் (C5H12) மாற்றியங்களை எழுதுவதன் மூலம் சங்கிலிதொடர் மாற்றியத்தை, நாம் புரிந்து கொள்வோம்.
தீர்வு:
தன் மதிப்பீடு
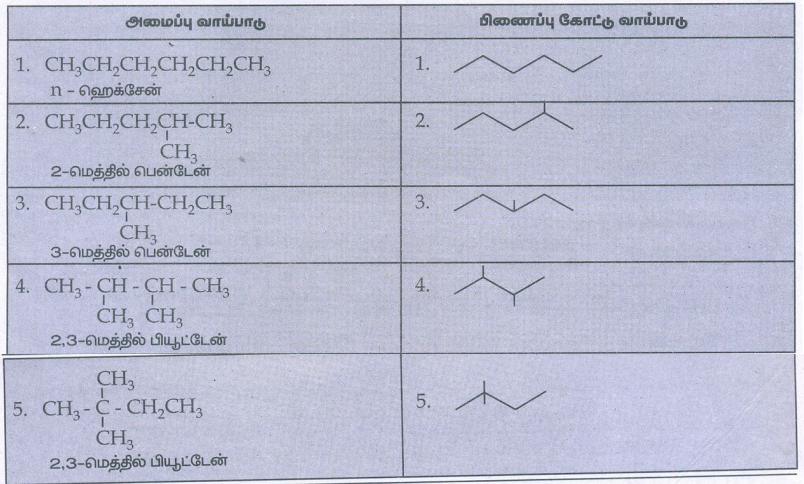
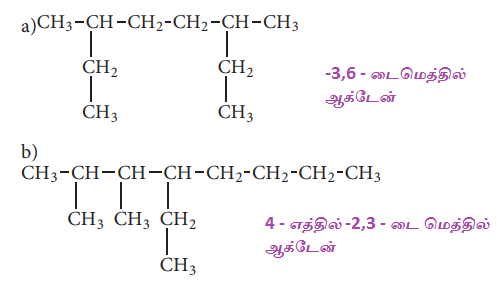
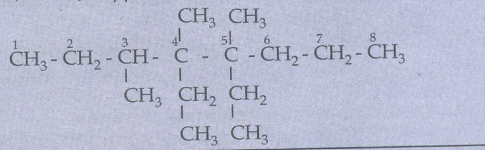
1. ஹெக்சேனின் (C6H14) அனைத்து சங்கிலி தொடர் மாற்றியங்களின் அமைப்பு வாய்ப்பாடுகள் மற்றும் அவற்றிற்குரிய பிணைப்பு கோட்டு வாய்ப்பாடுகளையும் எழுதுக.
விடை :
கிளைத் தொடர் ஆல்கேன்களுக்கான IUPAC பெயர்கள்:
தன் மதிப்பீடு
2. கீழ்கண்ட ஆல்கேன்களுக்கு IUPAC பெயரினை தருக.
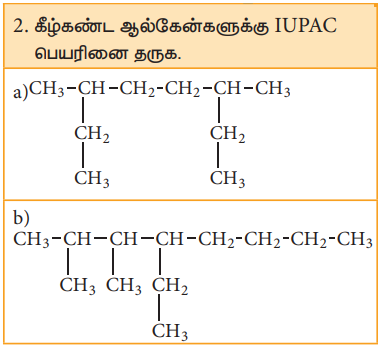
விடை :
கொடுக்கப்பட்டுள்ள IUPAC பெயருக்கு உரிய அமைப்பு வாய்ப்பாட்டினை எழுதுதல்:
ஆல்கேன்களின் பெயரிடும் விதிகளைக் கற்றபின், பெயரிட பின்பற்றிய செயல்முறையை மறுதலையாகச் செய்வதன் மூலம் IUPAC பெயரிலிருந்து அதற்குரிய ஆல்கேனின் அமைப்பு வாய்ப்பாட்டினை எழுதுதல் சற்றே எளிதானதாகும். இதனை எவ்வாறு செய்வது என்பதை பின்வரும் எடுத்துக்காட்டு விளக்குகிறது.
a) 3-எத்தில் -2, 3-டைமெத்தில் பென்டேனிற்கு அமைப்பு வாய்ப்பாட்டினை எழுதுவோம்.
தீர்வு:
படி: 1 மூல ஹைட்ரோகார்பன், பென்டேன் ஆகும். ஐந்து கார்பன் அணுக்களைக் கொண்ட சங்கிலித்தொடரினை வரைந்து, எண்களை எழுத வேண்டும்.
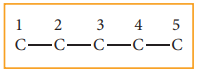
படி: 2 பெயரில் குறிப்பிட்டுள்ள ஆல்கைல் தொகுதிகளை நீண்ட கார்பன் சங்கிலியில் உரிய இடத்தில் இணைக்கவும். அதாவது மூன்றாவது கார்பனில் ஒரு எத்தில் தொகுதியையும், இரண்டு மற்றும் மூன்றாவது கார்பன்களில் ஒவ்வொன்றிலும் ஒரு மெத்தில் தொகுதியினையும் இணைக்கவேண்டும்.
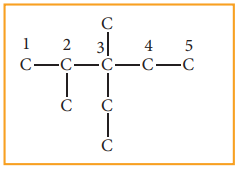
படி:3 ஒவ்வொரு கார்பன் அணுவிலும் நான்கு பிணைப்புகள் இருக்குமாறு, கார்பன் தொடரில் ஹைட்ரஜன் அணுக்களைச் சேர்க்க வேண்டும்.
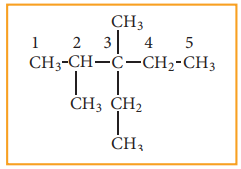
தன் மதிப்பீடு
3. கீழ்கண்ட ஆல்கேனிற்கு அமைப்பு வாய்ப்பாட்டினை வரைக.
4,5-டை எத்தில்-3,4,5-ட்ரை மெத்தில் ஆக்டேன்.
விடை :
1. ஆல்கேன்களைத் தயாரித்தல்:
சோதனை சாலைகளில் ஆல்கேனின் நேரடி பங்களிப்பு மிக குறைவு எனினும் இவை இயற்கையில் கிடைக்கும் மிக இன்றியமையாத சேர்மங்களாகும். இயற்கை எரிவாயு மற்றும் பெட்ரோலியம் (கச்சா எண்ணெய்) ஆகியவை ஆல்கேன்களின் மிக முக்கியமான இயற்கை மூலங்களாகும். எனினும் கீழ்கண்ட முறைகள் மூலமாகவும் இவைகளைத் தயாரிக்கலாம்.
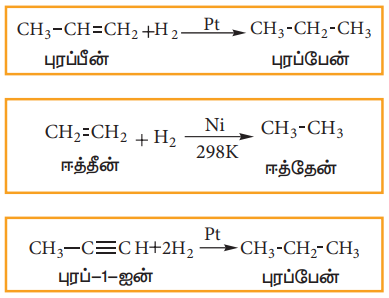
(1). நிறைவுறா ஹைட்ரோகார்பன்களை வினையூக்கி முன்னிலையில் ஒடுக்குதல்:
அறை வெப்பநிலையில், பிளாட்டினம் அல்லது பெல்லேடியம் வினையூக்கியின் மீது, ஆல்கீன் அல்லது ஆல்கைன்கள் மற்றும் ஹைட்ரஜன் வாயுகலவையை செலுத்துவதால் ஆல்கேன்கள் உருவாகுகின்றன. நிறைவுறா சேர்மங்களுடன் ஹைட்ரஜனை சேர்ப்பது, ஹைட்ரஜனேற்றம் எனப்படும்.
மேற்கூறிய செயல்முறையில், 298K வெப்பநிலையில் நிக்கல் வினையூக்கியை பயன்படுத்தி ஆல்கேனை பெறலாம், இவ்வினை சாபாடியர் – சண்டர்சன்ஸ் வினை எனப்படும்.
எடுத்துக்காட்டு,
(2). கார்பாக்சிலிக் அமிலங்களிலிருந்து ஆல்கேன்களை தயாரித்தல்:
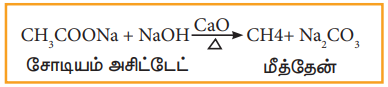
i. கார்பாக்சிலிக் அமிலத்தின் சோடியம் உப்புக்களை கார்பாக்சில் நீக்கம் செய்தல்:
கார்பாக்சிலிக் அமிலத்தின் சோடியம் உப்பு மற்றும் சோடா சுண்ணாம்பு (சோடியம் ஹைட்ராக்சைடு + கால்சியம் ஆக்சைடு) கலவையை வெப்பப்படுத்தும்போது, ஆல்கேன்கள் உருவாகுகின்றன. உருவாகும் ஆல்கேனில், கார்பாக்சிலிக் அமிலத்தைவிட ஒரு கார்பன் அணுகுறைவாக இருக்கும். கார்பாக்சிலிக் தொகுதியை நீக்கும் இச்செயல்முறையானது கார்பாக்சில் நீக்கம் எனப்படும்.
எடுத்துக்காட்டு,
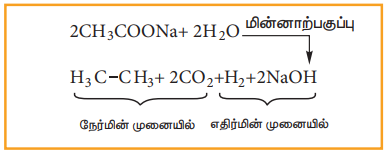
ii) கோல்ப் மின்னாற்பகுப்பு முறை
கார்பாக்சிலிக் அமிலத்தின் சோடியம் மற்றும் பொட்டாசியம் உப்பினை மின்னாற்பகுக்கும் போது, உயர் ஆல்கேன்கள் உருவாகுகின்றன. இரு கார்பாக்சலிக் அமிலங்களுக்கிடையே கார்பாக்சலிக் நீக்கம் மற்றும் இருமடியாகும் வினை நடைபெறுகின்றன. இம்முறையானது, சீர்மையான ஆல்கேன்களை (R-R) தயாரிக்க உகந்ததாகும்.
(3). ஆல்கைல் ஹாலைடுகள் அல்லது ஹாலோ ஆல்கேன்களிலிருந்து ஆல்கேன்கள் தயாரித்தல்
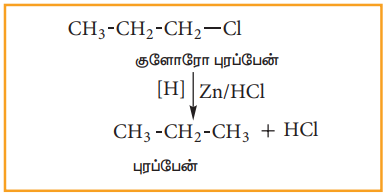
i) பிறவிநிலை ஹைட்ரஜனால் ஒடுக்கம்
ஆல்கைல் புளுரைடுகளை தவிர, மற்ற ஆல்கைல் ஹாலைடுகள், பிறவிநிலை ஹைட்ரஜனால் ஒடுக்கமடைந்து ஆல்கேன்களாக மாற்றப்படுகின்றன. ஒடுக்கத்திற்கு தேவைப்படும் ஹைட்ரஜனை கீழ்கண்ட ஒடுக்கும் காரணிகள் மூலம் பெறலாம்: Zn+HCl, Zn+CH3 COOH, எத்தனாலில் உள்ள Zn-Cu இணை, LiAlH4 முதலியன.,
எடுத்துக்காட்டு:
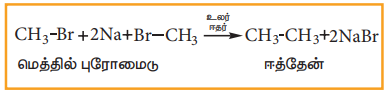
ii) உர்ட்ஸ் வினை
உலர் ஈதரில் உள்ள ஹாலோ உலோக ஆல்கேன் கரைசலை சோடியத்துடன் வினைப்படுத்தும்போது, உயர் ஆல்கேன்கள் உருவாகுகின்றன. இரட்டைபடை எண்ணிக்கையில் உள்ள உயர் ஆல்கேன்களைத் தயாரிக்க இம்முறைப் பயன்படுகிறது.
எடுத்துக்காட்டு:
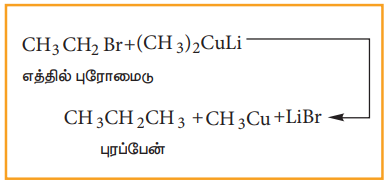
iii) கோரி ஹவுஸ் வினைவழிமுறை
ஆல்கைல் ஹாலைடும், லித்தியம் டை ஆல்கைல் குப்ரைட்டும் வினைபட்டு உயர் ஆல்கேனைத் தருகின்றன.
எடுத்துக்காட்டு;
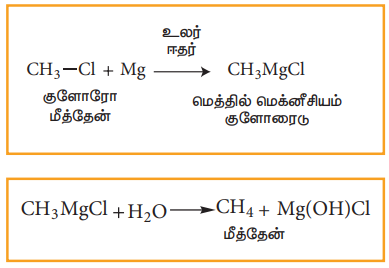
4) கிரிக்னார்டு காரணிகளிலிருந்து ஆல்கேன்களை தயாரித்தல்
ஈதர் முன்னிலையில் ஹாலோ ஆல்கேன்கள் மெக்னீசியத்துடன் வினைபட்டு, ஆல்கைல் மெக்னீசியம் ஹாலைடுகளைத் தருகின்றன. இது, கிரிக்னார்டு காரணி எனப்படுகிறது. இங்கே ஆல்கைல் தொகுதி, மெக்னிசியத்துடன் நேரடியாக இணைந்திருப்பதால், அது கார்பன் எதிர் அயனியாக செயல்படுகின்றது. எனவே, எளிதில் இடப்பெயர்ச்சி அடையும் ஹைட்ரஜனை கொண்டுள்ள எந்த ஒரு சேர்மமும், கிரிக்னார்டு காரணியுடன் வினைப்பட்டு இணையான ஆல்கேன்களைத் தருகின்றன.
எடுத்துக்காட்டு:
தன் மதிப்பீடு
4) கிரிக்னார்டு காரணியை நீரானது சிதைக்கின்றது. ஏன்?
விடை :
நீரானது கிரிக்னார்டு காரணியுடன் வினைபுரிந்து ஆல்கேனைத் தருகிறது.
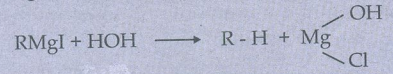
5) கோல்ப் மின்னாற் பகுப்பு முறையின் படி மீத்தேனை தயாரிக்க முடியுமா?
விடை :
மீத்தேனை கோல்ப் மின்னாற் பகுப்பு முறையில் பெற முடியாது. ஏனெனில், இவ்வினைகளில் சீர்மையுள்ள ஆல்கேனை பெற பயன்படுத்த முடியும் (இரட்டை எண் கொண்ட கார்பன் அணுக்களும் மட்டும்).
2. இயற் பண்புகள்:
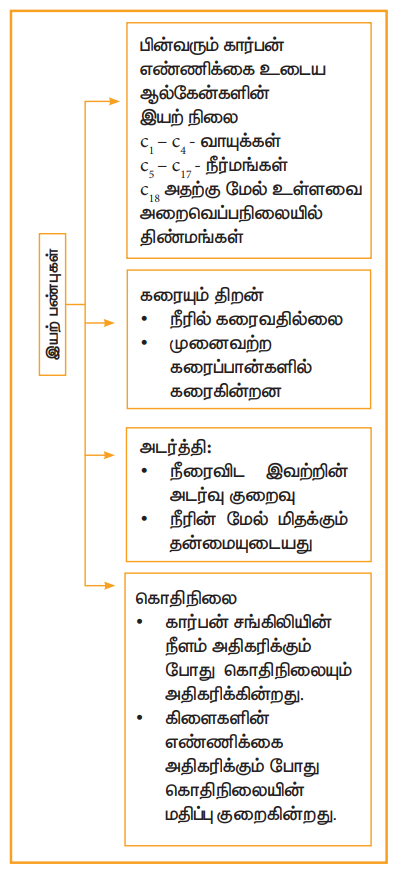
1) கொதிநிலை மற்றும் இயற் நிலை
சங்கிலித் தொடர் ஆல்கேன்களின் கொதி நிலையானது, சங்கிலியின் நீளம் அதிகரிக்கும்போது அதிகரிக்கின்றது. அதாவது சங்கிலியில் ஒவ்வொரு கார்பன் அணுவினை சேர்க்கும்போது தோராயமாக கொதிநிலையானது, 30°C அதிகரிக்கின்றது. முனைவற்ற ஆல்கேன்களில் வலிமை குறைந்த வாண்டர் வால்ஸ் விசை காணப்படுகிறது.
இவ்விசை மூலக்கூறின் புறப்பரப்பளவை சார்ந்து இருப்பதால், மூலக்கூறின் உருவ அளவு அதிகரிக்கும் பொழுது அதிகரிக்கின்றது. ஒரே எண்ணிக்கையில் உள்ள கார்பன் அணுக்களை உடைய நீண்ட சங்கிலித் தொடர் மாற்றியத்தின் கொதிநிலையானது, கிளைத்தொடர் சங்கிலி மாற்றியத்தை விட அதிகமாக காணப்படுகின்றது. கிளைகள் அதிகரிக்கும்போது, மூலக்கூறானது பொதிந்த அமைப்பையும் மற்றும் குறைந்த புறப்பரப்பளவையும் பெறுவதால், அதன் கொதிநிலை குறைகின்றது.
2) கரையும்திறன் மற்றும் அடர்த்தி
முனைவுறா தன்மையைக் கொண்ட ஆல்கேன்கள் முனைவுத் தன்மையைக் கொண்ட நீருடன் கரைவதில்லை. இத்தகைய பண்பால், உலோக மேற்பரப்பு அரிப்பு ஏற்டாதவாறு பாதுகாக்கும் சிறந்த நீர் விலக்கும் காரணியாக ஆல்கேன்கள் செயல்படுகின்றன. நீரைவிட மிக குறைந்த அடர்த்தியை பெற்றிருப்பதால் இரண்டு அடுக்குகளாக பிரிந்து, ஆல்கேன்கள் மேல் அடுக்கில் ஆக்கிரமிக்கின்றது. நீர் மற்றும் ஆல்கேனின் அடர்த்தி வேறுபடுவதால், நீரின் மீது எண்ணெய் மிக வேகமாக பரவுகின்றது.
உங்களுக்குத் தெரியுமா?
ஆப்பிள் பழத்தின் மீது உள்ள மெழுகில் நீண்ட கிளைகள் அற்ற நெடுந்தொடர் ஆல்கேன்கள் [C27 H56 மற்றும் C29H60] உள்ளன. பழத்தின் ஈரப்பதத்தை தக்கவைத்துக் கொள்ளவும், தரத்தை மேம்படுத்தவும் மற்றும் இயற்கை சிதைவிற்கு உட்படுவதை குறைப்பதற்கும் இந்த மெழுகு உதவுகின்றது. எனினும் செயற்கை மெழுகு பூசப்பட்ட பழங்களை உண்பது செரிமாண மண்டலத்திற்கு தீங்கு விளைவிக்கக்கூடியது.

3. ஆல்கேன்களின் வச அமைப்புகள்:
ஆல்கேன்களில் உள்ள ஒவ்வொரு கார்பணும் sp3 இனகலப்படைந்துள்ளது. அதனால் அக்கார்பனை சுற்றி அமைந்த நான்கு தொகுதிகள் அல்லது அணுக்கள் நான்முக அமைப்பை உருவாக்குகின்றன. இரண்டு அல்லது அதற்கு மேற்பட்ட கார்பன்களைக் கொண்டுள்ள ஆல்கேன்களில் C-C ஒற்றைப் பிணைப்பிற்கிடையே தடையற்ற சுழற்சி காணப்படுகின்றன. இத்தகைய சுழற்சியால், ஒவ்வொரு கார்பன் அணுவில் உள்ள அனைத்து தொகுதிகள் அல்லது அணுக்கள், எண்ணற்ற எளிதில் இடம்பெயரக்கூடிய முப்பரிமாண அமைப்புகளைத் தருகின்றன. இத்தகைய எளிதில் இடம்பெயரக்கூடிய முப்பரிமாண அமைப்புகளே மூலக்கூறின் வச அமைப்புகள் என அழைக்கப்படுகின்றன.
(i) ஈத்தேனின் வச அமைப்புகள் :
இரண்டு நான்முகி மெத்தில் தொகுதிகள், கார்பன் - கார்பன் பிணைப்பு அச்சின் வழியே சுழற்சிக்கு உட்பட்டு வச அமைப்புகள் எனப்படும். எண்ணற்ற அமைப்புகளைத் தருகின்றன. இதில் எதிரெதிர் மற்றும் மறைத்தல் ஆகிய இரு வச அமைப்புகள் மிக முக்கியமானவைகளாகும். இவ்விரண்டு அமைப்புகளுக்கு இடையே எண்ணற்ற அமைப்புகள் இருக்கலாம். அவைகள் சாய்வு அமைப்புகள் ( இடைநிலை அமைப்புகள்) (skew form) எனப்படுகின்றன.
மறைத்தல் வச அமைப்பு:
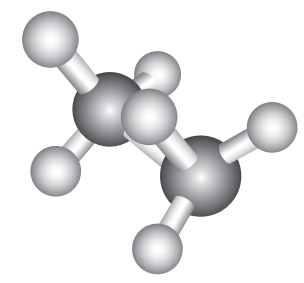
இவ்வச அமைப்பில், ஒரு கார்பனின் ஹைட்ரஜன் அணுவானது மற்றொரு கார்பனின் ஹைட்ரஜனிற்கு நேர் பின்னால் அமைந்துள்ளது. இவ்வமைப்பில் அணுக்களுக்கிடையேயான விலக்கு விசை அதிகபட்சமாக அமையும் மேலும் இது குறைவான நிலைப்புத்தன்மையுடைய வச அமைப்பாகும்.
எதிரெதிர் வச அமைப்பு :
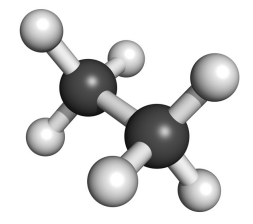
இவ்வச அமைப்பில், இரு கார்பன் அணுக்களின் ஹைட்ரஜன்களும் ஒன்றிற்கொன்று அதிகபட்சமாக எவ்வளவு தூரம் விலகியிருக்க முடியுமோ அவ்வளவு தூரம் விலகியிருக்கின்றன. இவ்வமைப்பில் அணுக்களுக்கிடையேயான விலக்கு விசை குறைந்தபட்சமாக உள்ளது. மேலும், இது அதிக நிலைப்புத் தன்மையுடைய வச அமைப்பாகும்.
சாய்வு அமைப்புகள்:
மேற்கூறிய இரண்டு முக்கிய வச அமைப்புகளுக்கிடையே உருவாகும் வாய்ப்புள்ள கணக்கிலடங்கா இடைநிலை வச அமைப்புகளே சாய்வு வச அமைப்புகள் எனப்படுகின்றன.
ஈத்தேனின் வெவ்வேறு வச அமைப்புகளின் நிலைப்புத் தன்மை பின்வருமாறு
எதிரெதிர் > சாய்வு > மறைத்தல்
ஈத்தேனின் எதிரெதிர் மற்றும் மறைத்தல் வச அமைப்புகளுக்கு இடையே உள்ள நிலை ஆற்றல் வேறுபாடு 12.5 kJmol-1 ஆகும். வெவ்வேறு வச அமைப்புகளை நியூமென் வாய்ப்பாட்டின் மூலம் குறிப்பிடலாம்.
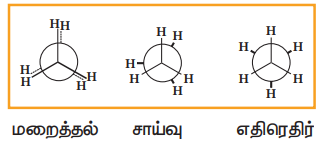
ஈத்தேனின் நியூமென் வாய்ப்பாடு
n - பியூட்டேனின் வச அமைப்புகள்:
ஈத்தேனில் உள்ள இரு கார்பன் அணுக்களில் ஒவ்வொன்றிலும் இணைக்கப்பட்டுள்ள ஒரு ஹைட்ரஜன் அணுவை மெத்தில் தொகுதியால் பதிலீடு செய்வதால் பெறப்படும் ஈத்தேனின் பெறுதியாக n –பியூட்டேனைக் கருதலாம்.
மறைத்தல் வச அமைப்பு:
இவ்வச அமைப்பில், இரு மெத்தில் தொகுதிகளுக்கு இடையே உள்ள தொலைவு குறைந்தபட்சமாக உள்ளது. எனவே, அவைகளுக்கிடையே விலக்குவிசை அதிமாக காணப்படுகிறது. மேலும், இவ்வமைப்பு குறைந்தபட்ச நிலைப்புத் தன்மை உடைய வச அமைப்பாகும்.
எதிரெதிர் அமைப்பு:
இவ்வச அமைப்பில், இரு மெத்தில் தொகுதிகளுக்கு இடையே உள்ள தொலைவு அதிகபட்சமாக உள்ளது. எனவே அவைகளுக்கிடையே விலக்குவிசை குறைவாக காணப்படுகிறது. மேலும், இவ்வமைப்பு அதிக நிலைப்புத் தன்மை உடைய வச அமைப்பாகும்.
கீழ்கண்ட நிலை ஆற்றல் வரைபடமானது n-பியூட்டேனின் பல்வேறு வச அமைப்புகளின் ஒப்பீட்டு நிலைப்புத்தன்மையைக் காட்டுகின்றது.
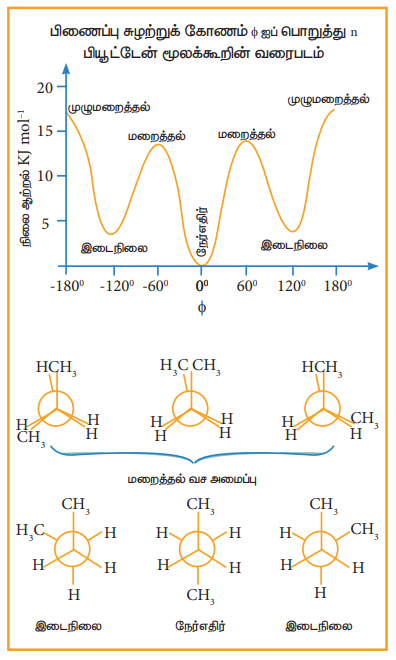
4. வேதிப் பண்புகள்:
ஆல்கேன்கள் பெரும்பாலான வினைக்காரணிகளுடன் வினைபுரியாத தன்மையினைப் பெற்றுள்ளன. குறிப்பிட்ட தகுந்த நிபந்தனைகளில், ஆல்கேன்கள் கீழ்கண்டுள்ள வினைகளில் ஈடுபடுகின்றன.
ஆல்கேன்கள் குடும்பத்தை 'பாராபின்கள்' என அழைப்பர். இவ்வார்த்தை 'குறைந்த வினைத்திறனுடைய' என பொருள்தரும் இலத்தீன் வார்த்தையிலிருந்து பெறப்பட்டுள்ளது.
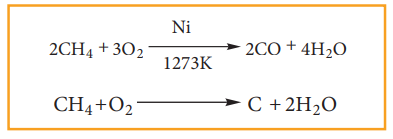
1) எரிதல்:
ஒரு சேர்மம், ஆக்சிஜனுடன் இணைந்து வெப்பம் மற்றும் ஒளியினை (பெரும்பாலும் சுடர்) தரும் வேதிவினைகள், எரிதல் வினைகள் எனப்படும். ஆல்கேன்கள் போதுமான அளவு ஆக்சிஜனுடன் எரிக்கப்படும்போது, கார்பன் டை ஆக்சைடு மற்றும் நீர் ஆகியன உருவாகின்றன .
எடுத்துக்காட்டு:
CH4+2O2 → CO2+2H2O ΔH° = -890.4kJ
ஆல்கேன்கள், போதுமான ஆக்சிஜன் இல்லாத நிலையில் எரிக்கப்படும் போது, கார்பன் மோனாக்சைடு மற்றும் கரியைத் தருகின்றன.
தன் மதிப்பீடு
6) புரப்பேனின் எரிதல் வினையினை எழுதுக
ΔH° = -2220 kJ
விடை :
புரப்பேனின் எரிதல் வினை C3H8 + 5O2 → 3CO2 + 4H2O ∆Ho = -2220KJ
2) ஹாலஜனேற்றம்:
ஹாலஜனேற்ற வினை என்பது ஆல்கேன்கள் மற்றும் ஹாலஜன்களுக்கு இடையே நிகழும் ஒரு வேதிவினையாகும். இதில் ஒன்று அல்லது அதற்கு மேற்பட்ட ஹைட்ரஜன் அணுக்கள், ஹாலஜன்களால் பதிலீடு செய்யப்படுகின்றன. ஹாலஜனேற்ற வினைகளின் முக்கியமானவை குளோரினேற்றம் மற்றும் புரோமினேற்றமாகும். எனினும், புளூரினேற்றம் மிக வேகமாகவும், ஐயோடினேற்றம் மிக மெதுவாகவும் நடைபெறுகின்றன. வெப்பம் அல்லது ஒளி முன்னிலையில், மீத்தேன் குளோரினுடன் கீழ்கண்டவாறு வினைபடுகின்றது.
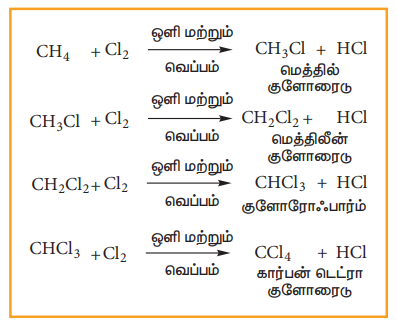
வினைவழி முறை:
இவ்வினையானது தனி உறுப்பு சங்கிலி தொடர் வினை வழி முறையினை பின்பற்றுகின்றது. இவ்வினை வழிமுறையில், ஆரம்ப நிலை, வினைத் தொடர்தல் நிலை, முடிவு நிலை ஆகிய மூன்று படி நிலைகள் உள்ளன..
i) சங்கிலி வினையின் ஆரம்ப நிலை: புற ஊதா கதிர்களால் குளோரின் மூலக்கூறுகள் சீராக பிளவுற்று, தனி உறுப்புக்களை (குளோரின் அணுக்கள்) உருவாக்குவதால் சங்கிலி வினையானது தொடங்கப்படுகிறது.

இங்கே Cl-Cl பிணைப்பு பிளவுறுகின்றது. ஏனெனில் C-C & H-H பிணைப்புகள் Cl-Cl பிணைப்பை விட அதிக வலிமை வாய்ந்தவை.
ii) வினைத் தொடரும் நிலை : இப்படிநிலை கீழ்கண்டவாறு நடைபெறுகின்றது.
அ. குளோரின் தனி உறுப்பு, மீத்தேன் மூலக்கூறினைத் தாக்கி, C-H பிணைப்பில் பிளவு ஏற்பட்டு மெத்தில் தனி உறுப்புகளை உருவாக்குகின்றன.
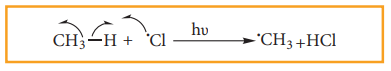
ஆ. உருவாகிய மெத்தில் தனி உறுப்பு இரண்டாவது குளோரின் மூலக்கூறைத் தாக்கி, குளோரோ மீத்தேன் (CH3- Cl) மற்றும் குளோரின் தனி உறுப்பை உருவாக்குகின்றன.
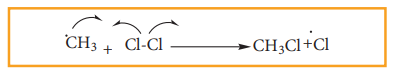
(இ) உருவாகிற குளோரின் தனி உறுப்பு படி (அ)- ல் குறிப்பிடப்பட்டுள்ள வினையில் ஈடுபடுகிறது. மேலும் படி (அ) மற்றும் (ஆ)-ல் குறிப்பிடப்பட்டுள்ள வினைகள் மீண்டும் மீண்டும் நிகழ்வதால் சங்கிலித் தொடர்வினை நிகழ்கிறது.
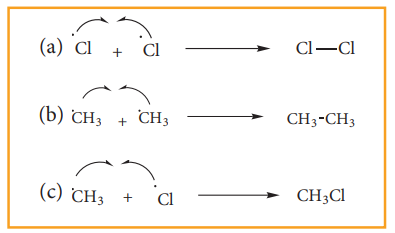
iii) சங்கிலி வினையின் முடிவு நிலை :
சிறிது நேரம் கழித்து, வினைபடு பொருள்கள் அனைத்தும் வினைபுரிந்த நிலையில் வினையானது முடிவடையும். தனி உறுப்புக்கள் மீண்டும் இணைவதால் சங்கிலி வினையானது முற்றுப்பெறுகிறது.
தன் மதிப்பீடு
7) மீத்தேனை குளோரினேற்றம் செய்யும்போது ஈத்தேன் உருவாகுகின்றது ஏன்?
விடை :
சங்கிலி வினையினை முடிப்பதற்கு தனிஉறுப்புகள் தமக்குள் இணைவதால் மீண்டும் புதிய தனி உறுப்புகளை உருவாக்குவதில்லை. எனவே, இரு மெத்தில் தனிஉறுப்புகள் இணைந்து ஈத்தேனை உருவாகின்றது.
CH•3 + CH•3 → CH3 - CH3
3) அரோமேட்டிக் சேர்மமாக்கல்
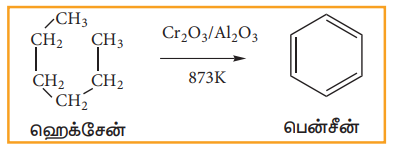
உயர் வெப்பநிலை மற்றும் வினையூக்கி முன்னிலையில், ஆறு முதல் பத்து கார்பன் அணுக்களை பெற்றுள்ள ஆல்கேன்களை, பென்சீனின் படிவரிசை சேர்மங்களாக மாற்ற இயலும். இச்செயல்முறையே அரோமேட்டிக் சேர்மமாக்கல் எனப்படும்.
இச்செயல்முறையில் ஆல்கேன்களின் வளையமாக்கல் மற்றும் ஹைட்ரஜன் நீக்கம் ஆகியன ஒரே நேரத்தில் நிகழ்கின்றன.
873K வெப்பநிலையில், அலுமினாவில் உள்ள Cr2O3 -ன் மீது n-ஹெக்சேனை செலுத்தும்போது பென்சீன் உருவாகின்றது.
தன் மதிப்பீடு
8) டொலுவின் இம்முறையின் மூலம் எவ்வாறு தயாரிக்கப்படுகின்றது?
4) நீராவியுடன் வினை
1273K வெப்பநிலையில், நிக்கல் வினையூக்கி முன்னிலையில், மீத்தேன் நீராவியால் சிதைக்கப்பட்டு கார்பன் மோனாக்சைடு மற்றும் ஹைட்ரஜன் வாயுவை தருகின்றது.
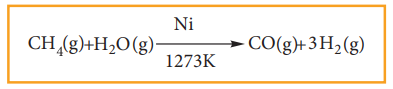
மீத்தேனிலிருந்து H2 வாயு உருவாக்கும் முறையானது, நீராவி மாற்றியமைத்தல் செயல்முறை எனப்படுகிறது. இம்முறையின் மூலம் தொழிற்சாலைகளில் அதிக அளவு H2 வாயுவை, ஹைட்ரோ கார்பனிலிருந்து பெறலாம்.
5) காற்றில்லா வெப்பமூட்டல்:
வெப்பத்தை பயன்படுத்தி, காற்றிலா சூழலில் கரிம சேர்மங்களை சிறு துகள்களாக மாற்றும் வெப்பச்சிதைவு வினையே காற்றில்லா வெப்பமூட்டல் எனப்படும். ஆங்கிலத்தில் இதனை 'பைரோலிசிஸ்' என்பர் "பைரோ" என்பது 'நெருப்பு' மற்றும் 'லைசிஸ்' என்பது "பிரித்தெடுத்தல்" எனப்படும். ஆல்கேன்களை பைரோலிசிஸ் செய்வதை "பிளத்தல்”(cracking) என்றும் பெயரிடலாம்.
காற்றிலா சூழலில் செஞ்சூடான உலோகத்தின் மீது ஆல்கேன் வாயுக்களை செலுத்தினால், அவை எளிய ஹைட்ரோ கார்பன்களாக சிதைவடைகின்றது.
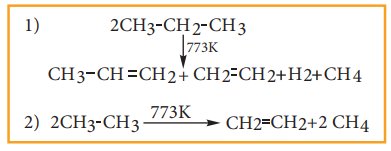
இவ்வினையில் ஆல்கேனின் தன்மை, வெப்பநிலை, அழுத்தம் மற்றும் வினையூக்கியின் முன்னிலையில் அல்லது வினையூக்கி இல்லாமல் வினை நிகழ்த்துதல் ஆகியனவற்றைப் பொருத்து உருவாகும் விளைப்பொருள்கள் அமைகின்றன. ஆல்கேன்களின் மூலக்கூறு எடை மற்றும் கிளைகளின் எண்ணிக்கை அதிகரிக்கும்போது அவை எளிதாக பிளவுபடுகின்றன. பெட்ரோலியத் தொழிற்சாலையில் இந்த பிளத்தல் செயல்முறை முக்கிய பங்கினை வகிக்கின்றது.
6) மாற்றியமாக்குதல்:
ஒரு சேர்மம் அதனுடைய மாற்றிய அமைப்புகளில் ஏதேனுமாக மாறும் வேதிச் செயல்முறையே மாற்றியமாக்குதல் எனப்படும். 298K வெப்பநிலையில், AlCl3 மற்றும் HCl முன்னிலையில், நீண்ட சங்கிலித் தொடர் ஆல்கேன்கள் கிளைதொடர் ஆல்கேன்களாக மாற்றம் அடைகின்றன.
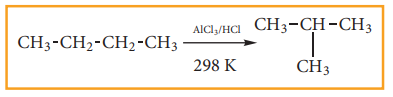
இச்செயல்முறை தொழிற்துறையில் முக்கிய பங்கினை வகிக்கின்றது. பெட்ரோலின் பகுதிப் பொருள்களை மாற்றியமாக்குதல் மூலம் அதன் தரத்தினை உயர்த்தலாம்.
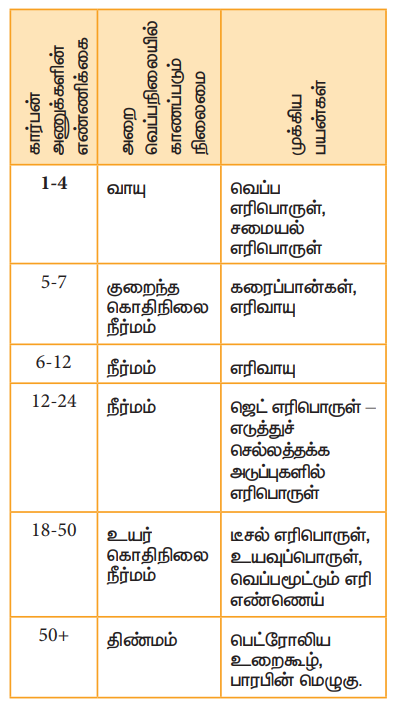
பயன்கள்
ஆல்கேன்களின் எரிதல் வினையானது வெப்ப உமிழ் வினையாகும். இதன் காரணமாக ஆல்கேன்கள் சிறந்த எரிபொருளாகப் பயன்படுகின்றன. மீத்தேன் இயற்கை வாயுவில் காணப்படுகின்றது. புரோப்பேன் மற்றும் பியூட்டேன் ஆகியவற்றின் கலவை LPG எனப்படுகின்றது. இது வீடுகளில் சமையலுக்கு எரிபொருளாகப் பயன்படுத்தப்படுகிறது.
பெட்ரோல் என்பது பல ஹைட்ரோ கார்பன்கள் கலந்த சிக்கலான கலவை ஆகும். இஃது அக எரியூட்டும் இயந்திரங்களில் எரிபொருளாகப் பயன்படுத்தப்படுகிறது.
மை, அச்சுமை மற்றும் சாயப்பொருள் தயாரித்தல், ஆகியனவற்றில் கார்பன் கருப்பு பயன்படுகின்றது. மேலும் இவை வடிப்பானாகவும் பயன்படுகிறது.