பெயரிடும் முறை மற்றும் மாற்றியம், அரோமோட்டிக் தன்மை, பென்சீனின் அமைப்பு, மூலங்கள் | வேதியியல் - அரோமேட்டிக் ஹைட்ரோகார்பன்கள் | 11th Chemistry : UNIT 13 : Hydrocarbons
11 வது வேதியியல் : அலகு 13 : ஹைட்ரோகார்பன்கள்
அரோமேட்டிக் ஹைட்ரோகார்பன்கள்
அரோமேட்டிக் ஹைட்ரோகார்பன்கள்
ஒரு நிமிடம் நிதானித்து, நறுமண மிக்க பொருள்களை நினைத்துப்பார். எந்த பொருள்கள் உன் நினைவிற்கு வருகின்றன. வாசனை திரவியம், வெண்ணிலா அல்லது லவங்கபட்டையின் மணம் போன்றவை நினைவுக்கு வரலாம். இவை ஒவ்வொன்றும் வெவ்வேறான நறுமணங்களை உடையவை. எனினும் அவைகள் ஏதோ ஒன்றினை பொதுவாக கொண்டுள்ளன அதாவது, அவைகள் அரோமேட்டிக் சேர்மங்களால் உருவாக்கப்பட்டுள்ளன. (கிரேக்கம் - அரோமோ என்றால் நறுமணம் என பொருள்). எனினும் சில சேர்மங்கள் வேதியியல் தன்மைப் படி அரோமேட்டிக் தன்மையை பெற்றிருப்பினும், குறிப்பிட்ட நறுமணத்தினை பெற்றிருப்பதில்லை. அரோமேட்டிக் ஹைட்ரோ கார்பன்கள் அச்சேர்மத்தில் காணப்படும் வளையங்களின் எண்ணிக்கையை பொருத்து வகைப்படுத்தப்படுகின்றன.
(i) ஒற்றை வளைய அரோமேட்டிக் ஹைட்ரோ கார்பன் (MAH)
(எ.கா) பென்சீன் (C6H6) மற்றும் டொலுயீன்(C7H8)

(ii) பல் வளைய அரோமேட்டிக் ஹைட்ரோ கார்பன் (PAH)
(எ.கா) நாப்தலீன் (C10 H8) மற்றும் ஆன்திரசீன் (C14H10).

தன்மதிப்பீடு :
21) C18H12 என்னும் சேர்மத்தில் உள்ள வளையங்களின் எண்ணிக்கையைக் கணக்கிடுக.
தீர்வு:
C18H12 ல், நான்கு வளையங்களை பெற்றுள்ளன.

1. பெயரிடும் முறை மற்றும் மாற்றியம்
• அலகு 11ல் அரோமேட்டிக் ஹைட்ரோ கார்பன்களை பெயரிடும் முறையினை நாம் கற்றுள்ளோம். அரோமேட்டிக் ஹைட்ரோ கார்பனின் முதல் சேர்மம் பென்சீன் ஆகும். வளைய ஹெக்சேன் அமைப்பில் ஒரு வட்டம் வரையப்பட்டு இது குறிப்பிடப்படுகிறது.
• பென்சீனில் உள்ள ஆறு ஹைட்ரஜன் அணுக்களும் சமமாக உள்ளன. அதனால் ஒரே ஒரு ஒற்றை பதிலீட்டு சேர்மத்தை மட்டும் தருகின்றது. (எ.கா) மெத்தில் பென்சீன் (C6H5-CH3). இதனை டொலுயீன் எனவும் அழைக்கலாம்.

• ஒரே மாதிரியான இரு ஒற்றை இணைத்திறன் அணு (அல்லது) இரு வெவ்வேறான அணுக்கள் (அல்லது) இரு தொகுதிகளால் பென்சீனில் இரட்டை பதிலீடு நடைபெறும்போது, மூன்று வெவ்வேறான இடமாற்றியங்கள் உருவாகின்றன. அவற்றின் இடங்கள் ஆர்தோ(1,2), மெட்டா (1,3) மற்றும் பாரா (1,4) என குறிக்கப்படுகின்றன. உதாரணமாக, சைலீன் என அழைக்கப்படும் டைமெத்தில் பென்சீனைக் கருதுவோம்.

தன்மதிப்பீடு:
22) C8H10 என்ற மூலக்கூறு வாய்பாடு உடைய அரோமேட்டிக் பென்சீனாய்டு சேர்மத்திற்கு சாத்தியமான அனைத்து மாற்றியங்களையும் எழுதுக.
தீர்வு:

23) C9H12 என்ற மூலக்கூறு வாய்பாடு உடைய ஒற்றை பதிலிடப்பட்ட அரோமேட்டிக் பென்சீனாய்டு சேர்மத்திற்கு சாத்தியமான அனைத்து மாற்றியங்களையும் எழுதுக.
தீர்வு:

2. அரோமோட்டிக் தன்மை
ஹக்கல் என்பவர் அரோமேட்டிக் தன்மை என்பது எலக்ட்ரான் அமைப்பினை பொறுத்து அமைகிறது என முன்மொழிந்தார். ஒரு சேர்மம் அரோமேட்டிக் தன்மையை பெற்றிருக்க கீழ்கண்ட விதிகளை நிறைவு செய்ய வேண்டும்.
(i) மூலக்கூறு சமதளத்தில் அமைய வேண்டும்.
(ii) வளையத்தில் உள்ள π எலக்ட்ரான்கள் முழுமையும் உள்ளடங்காத் தன்மையினைப் பெற்றிருக்க வேண்டும்.
(iii) வளையத்தில் (4n+2) π எலக்ட்ரான்கள் இருக்க வேண்டும். இங்கு n என்பது முழுக்கள் ஆகும். (n=0,1,2....)
இதுவே ஹக்கல் விதி எனப்படுகிறது.
ஹக்கல் விதியைப் பின்பற்றி சில சேர்மங்களின் அரோமேட்டிக் தன்மை பின்வருமாறு தீர்மானிக்கப்படுகிறது.

3. பென்சீனின் அமைப்பு:
1. மூலக்கூறு வாய்ப்பாடு
தனிம பகுப்பாய்வு மற்றும் மூலக்கூறு எடை நிர்ணயித்தல் போன்ற ஆய்வுகள், பென்சீனின் மூலக்கூறு வாய்ப்பாடு C6H6 என உறுதி செய்கின்றன. இதிலிருந்து பென்சீன், அதிக நிறைவுறா தன்மையை பெற்றுள்ள சேர்மம் என அறிய முடிகிறது.
2. நீண்டதொடர் அமைப்பிற்கு வாய்ப்பு இல்லை:
பென்சீனானது ஆல்கீன்கள் அல்லது ஆல்கைன்களின் பண்புகளைப் பெற்றிருப்பதில்லை, எனவே பென்சீனை நீண்ட கார்பன் சங்கிலி தொடர் அல்லது வளையச் சேர்மமாக கருத இயலாது. எடுத்துக்காட்டாக அமிலம் கலந்த KMnO4 மற்றும் கார்பன்டெட்ரா குளோரைடில் உள்ள புரோமினின் நிறங்களை, பென்சீன் நிறமிழக்கச் செய்வதில்லை. அமில முன்னிலையில், நீருடன் பென்சீன் வினைபுரிவதில்லை.
3. வளைய அமைப்பிற்கான சான்றுகள் :
i) பென்சீனின் பதிலீட்டு வினைகள் :
AlCl3 முன்னிலையில் பென்சீன் புரோமினுடன் வினைபட்டு மோனோபுரோமோ பென்சீனைத் தருகின்றது.

ஒரே ஒரு மோனோபுரோமோ பென்சீன் உருவாவதால், இதில் உள்ள ஆறு கார்பன் அணுக்களும் சமமாக உள்ளன என்பதை அறியலாம். பென்சீனில் உள்ள ஆறு கார்பன் அணுக்களும் ஒரு ஹைட்ரஜனைப் பெற்றிருந்து வளைய அமைப்பில் இருந்தால் மட்டுமே இது சாத்தியமாகும்.
ii) ஹைட்ரஜனை சேர்த்தல்:
நிக்கல் வினையூக்கி முன்னிலையில், மூன்று மோல்கள் ஹைட்ரஜனுடன் பென்சீன் இணைந்து வளைய ஹெக் சேனைத் தருகின்றது.

இவ்வினையானது, பென்சீன் வளைய அமைப்பினையும் மூன்று கார்பன்-கார்பன் இரட்டைப்பிணைப்புகளையும் பெற்றிருப்பதை உறுதி செய்கின்றது.
4. பென்சீனின் கெக்குலே அமைப்பு:
1865 ஆம் ஆண்டு ஆகஸ்ட் கெக்குலே என்பவர் பென்சீனில் உள்ள ஆறு கார்பன் அணுக்களும் சமதள வளைய அமைப்பினை பெற்றிருப்பதுடன் கார்பன்-கார்பன் ஒற்றைப் பிணைப்பும் இரட்டை பிணைப்பும் மாறி மாறி அமைந்திருக்கலாம் என தெரிவித்தார்.
இதற்கு பின்வரும் இரண்டு மறுப்புகள் உள்ளன.
(i) பென்சீன் ஆனது ஒரே ஒரு ஆர்த்தோ இரட்டை பதிலீடு விளைப்பொருளைத் தருகின்றது. ஆனால் கெக்குலே அமைப்பில், இரண்டு ஆர்த்தோ இரட்டை பதிலீடு விளைப்பொருள்கள் இருப்பதை கீழ்க்கண்டவாறு அறியப்படுகின்றன.

(ii) பென்சீனில் மூன்று இரட்டைப்பிணைப்புகள் இருப்பினும், அது ஆல்கீன்களைப் போல் சேர்க்கை வினைக்கு ஏன் உட்படவில்லை என்பதை கெக்குலே அமைப்பு விளக்கவில்லை இம் மறுப்புகளுக்கான காரண விளக்கமாக, பென்சீனானது பின்வரும் விரைவு சமநிலையில் உள்ள இரு வடிவங்களின் கலவையாக உள்ளது என கெக்குலே தெரிவித்தார்.

5. பென்சீனின் உடனிசைவுகள் :
அணுக்களின் அமைவிடங்கள் மாற்றாமல், ஓர் சேர்மத்திற்கு இரண்டு அதற்கு மேற்பட்ட அமைப்புகளை எழுத முடியுமானால், அந்நிகழ்வே உடனிசைவு எனப்படுகிறது. மூலக்கூறின் உண்மையான அமைப்பு என்பது, அனைத்து உடனிசைவு அமைப்புகளின், உடனிசைவு இனக்கலப்பு அமைப்பாகும். பென்சீனில், கெக்குலேயின் அமைப்புகளான (1) மற்றும் (2) உடனிசைவு அமைப்புகளாகும், உடனிசைவு அமைப்புகளான (1) மற்றும் (2) ஆகியவற்றின் உடனிசைவு இனக்கலப்பினை அமைப்பு (3) குறிப்பிடுகிறது.

அமைப்பு (1) மற்றும் (2) ஆகியன கருத்தியலாக மட்டுமே உள்ள அமைப்புகளாகும் இவ்விரு உடனிசைவு அமைப்புகளின் இனக்கலப்பே பென்சீனின் கருதப்படும் உண்மையான வடிவமாகும்.
6. நிரநிறல் அளவீடுகள்:
பென்சீன் சமதள அமைப்புடையது என நிரநிறல் அளவீடுகள் காட்டுகின்றன. இவற்றில் உள்ள அனைத்து கார்பன் - கார்பன் பிணைப்புகளும் சமநீளம் உடையவை. (பிணைப்பு நீளம் 1.40 Å). இந்த மதிப்பானது கார்பன் - கார்பன் ஒற்றை பிணைப்பு நீளத்திற்கும் (1.54 Å) மற்றும் கார்பன் – கார்பன் இரட்டை பிணைப்பு நீளத்திற்கும் (1.34 Å) இடையே அமைந்துள்ளது.
7. மூலக்கூறு ஆர்பிட்டால் அமைப்பு :
பென்சீனின் அமைப்பை மிகக்தெளிவாக மூலக்கூறு ஆர்பிட்டால் கொள்கையின் மூலம் விளக்கலாம். பென்சீனின் உள்ள அனைத்து கார்பன் அணுக்களும் sp2 இனக்கலப்பிற்கு உட்படுகின்றன. ஆறு கார்பனின் sp2 இனக்கலப்பு ஆர்பிட்டால்கள், ஆறு ஹைட்ரஜன் அணுக்களின் 1s ஆர்பிட்டால்களுடன், நேர்கோட்டில் மேற்பொருந்தி, ஆறு C - H சிக்மா பிணைப்புகளைத் தருகின்றன. மீதமுள்ள கார்பனின் sp2 இனக்கலப்பு ஆர்பிட்டால்கள் ஒன்றுடன் ஒன்று மேற்பொருந்தி, ஆறு C -C சிக்மா பிணைப்புகளை உருவாக்குகின்றன

பென்சீனின் அனைத்து σ பிணைப்புகளும் ஒரே தளத்தில் அமைந்துள்ளன. இதன் பிணைப்பு கோணம் 120°ஆகும். ஒவ்வொரு கார்பன் அணுவும் ஒற்றை எலட்ரானை கொண்ட இனக்கலப்டையாத p - ஆர்பிட்டாலைக் கொண்டுள்ளன. இந்த p - ஆர்பிட்டால்கள் பக்கவாட்டில் மேற்பொருந்தி மூன்று π பிணைப்புகளைத் தருகின்றன. p – ஆர்பிட்டாலில் உள்ள ஆறு எலட்ரான்களும், ஆறு கார்பன் அணுக்களுடன் பங்கிடப்பட்டு உள்ளடங்கா அமைப்பைத் தருகின்றன. இத்தகைய உள்ளடங்காத் தன்மையால், வலிமையானா π பிணைப்பு உருவாகி, மூலக்கூறின் நிலைப்பு தன்மை அதிகரிக்கின்றது. எனவே பென்சீனானது, ஆல்கின்கள் மற்றும் ஆல்கைன்கள் போல் சேர்க்கை வினைக்கு உட்படாமல், சாதாரண நிபந்தனைகளில் பதிலீட்டு வினைகளுக்கு உட்படுகின்றன.

படம் 13.7 அனைத்து கார்பன் அணுக்களும் P -ஆர்பிட்டாலைக் கொண்டுள்ளன. ஆறு p -ஆர்பிட்டால்கள் ஒன்றுடன் ஒன்று கலந்து உள்ளடங்கா மூலக்கூறு ஆர்பிட்டாலைத் தருகின்றது.
8. பென்சீனை குறித்துக்காட்டுதல்:
எனவே, பின்வரும் மூன்று வழிகளில் பென்சீனை குறித்துக்காட்டலாம்.

பென்சீன் மற்றும் அதன் படிவரிசை சேர்மங்கள்
பென்சீன் மற்றும் அதன் படிவரிசைச் சேர்மங்கள் இனிய நறுமணமுடைய நிறமற்ற நீர்மங்கள் ஆகும். அவை நீரின் அடர்த்தியைவிட குறைவான அடர்தியினை பெற்றுள்ளன மேலும் நீரில் கரையா பண்பினை பெற்றுள்ளன. இவற்றின் ஆவிகள் எளிதில் தீப்பற்றக்கூடியவை மற்றும் நச்சுத்தன்மை வாய்ந்தவை.
4. அரோமேட்டிக் சேர்மங்களின் மூலங்கள் :
• பென்சீன் மற்றும் பிற அரோமேட்டிக் சேர்மங்கள், நிலக்கரி தார் மற்றும் பெட்ரோலியத்திலிருந்து பெறப்படுகின்றன.
• ஆய்வகத்தில் எளிய அலிபாட்டிக் சேர்மங்களிலிருந்து இவை தயாரிக்கப்படுகின்றன.
1. பென்சீனின் தயாரிப்பு
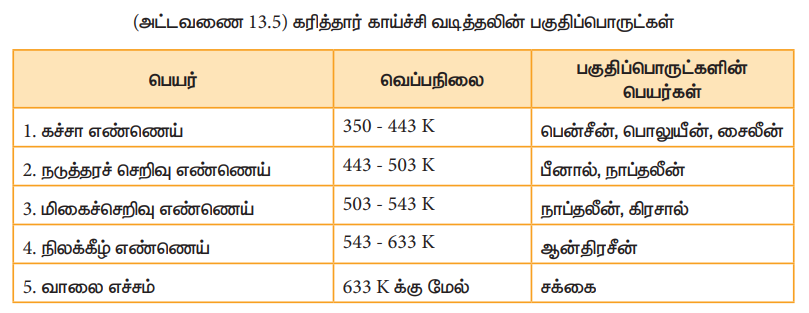
கரித்தார் என்பது கரியை வெப்ப சிதைவுறுதலுக்கு உட்படுத்தும் போது பெறப்படும் பாகுத் தன்மை உடைய நீர்மம் ஆகும். பின்னக் காய்ச்சி வடித்தலின் போது, நிலக்கரித்தார் வெப்பப்படுத்தப்பட்டு, பென்சீன், டொலுவின், சைலீன் போன்ற எளிதில் ஆவியாகக்கூடிய சேர்மங்கள், சுமார் 350 முதல் 447 K வெப்பநிலையில் வாலை வடிக்கப்படுகின்றன. இந்த வாயுக்கள் அடுக்குமுறை பிரிப்பானின் மேற்பகுதியில் சேகரிக்கப்படுகின்றன.
(அட்டவணை 13.5) கரித்தார் காய்ச்சி வடித்தலின் பகுதிப்பொருட்கள்
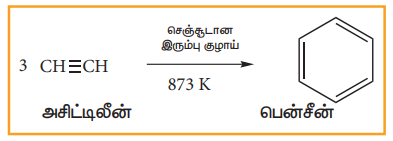
(ii) அசிட்டிலீனிலிருந்து.
செஞ்சூடான குழாய் வழியே அசிட்டிலீனை செலுத்தும்போது, மும்மடியாக்கப்பட்டு பென்சீனைத் தருகின்றன. இவ்வினையினை, ஆல்கைன்களின் பல படியாக்கல் வினையில் நாம் ஏற்கனவே கற்றுள்ளோம்.
(iii) பென்சீன் மற்றும் டொலுவினின் ஆய்வகத் தயாரிப்பு
(அ) அரோமோட்டிக் அமிலத்தின் கார்பாக்சில் நீக்கம்
சோடா சுண்ணாம்புடன் சோடியம் பென்சோயேட்டை வெப்பப்படுத்தும் போது, பென்சீன் ஆவி வாலை வடிக்கப்படுகிறது.
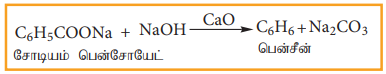
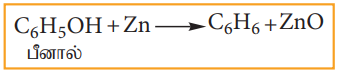
(ஆ) பீனாலிலிருந்து பென்சீன் தயாரித்தல்
பீனால் ஆவியினை தூய ஜிங்க் மீது செலுத்தும்போது, அது பென்சீனாக ஓடுக்கமடைகின்றது.
C6H5OH + Zn (பீனால்) → C6H6 + ZnO
(இ) உர்ட்ஸ் – பிட்டிக் வினை:
உலர் ஈதர் முன்னிலையில் புரோமோ பென்சீன் மற்றும் அயோடோ மீத்தேன் கரைசலை, உலோக சோடியத்துடன் வினைபடுத்தும்போது, பொலுயீன் உருவாகுகின்றது.
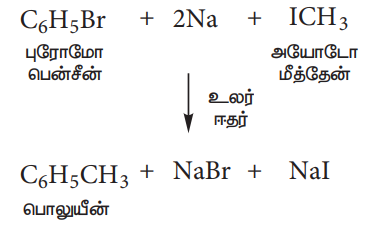
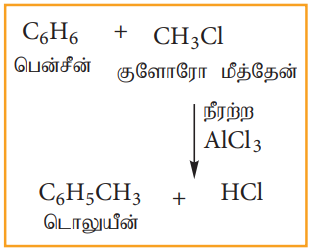
(ஈ) ஃபிரீடல் - கிராப்ட் வினை
நீரற்ற அலுமினியம் குளோரைடு முன்னிலையில் பென்சீனை மெத்தில் குளோரைடுடன் வினைபடுத்தும்போது, டொலுவீன் கிடைக்கின்றது.
தன்மதிப்பீடு
24) கிரிக்னார்டு வினைபொருளைப் பயன்படுத்தி பென்சீன் எவ்வாறு தயாரிக்கப்படுகிறது?
தீர்வு:
பினைல் மெக்னீசியம் அயோடைடு நீராற்பகுத்தலில் பென்சீன் தருகிறது.

5. இயற்பியல் பண்புகள்:
• பென்சீன் ஓர் நிறமற்ற நீர்மமாகும். இது நீரில் கரையாது ஆனால், ஆல்கஹால், ஈதர் மற்றும் குளோரோபார்மில் கரைகின்றது.
• ஆல்கேன்கள் மற்றும் ஆல்கீன்கள் வழக்கமாக நீல நிற சுவாலையுடன் எரியும். ஆனால் இது புகையுடன் எரியும்.
• இதன் வாயுக்கள் அதிக நச்சுத்தன்மை வாய்ந்தது. இதனை நுகரும் போது மயக்கம் ஏற்படலாம்.
6. வேதிப் பண்புகள் :
1. பென்சீன் உள்ளடங்கா π எலக்ட்ரான்களைப் பெற்றிருப்பதால் அதன் வளையமானது அதிக எலக்ட்ரான் அடர்வு கொண்ட மையமாக விளங்குகின்றது. எனவே பென்சீனில் எலக்ட்ரான் கவர்பொருள் பதிலீட்டு வினைகள் நடைபெறுகின்றன.
2. பென்சீனானது உள்ளடங்கா π எலக்ட்ரான்களால் நிலைப்புத் தன்மையைப் பெறுகிறது. இது அதிக நிலைப்புத் தன்மையினைப் பெற்றிருப்பினும் குறிப்பிட்ட நிபந்தனைகளில் சேர்க்கை வினை மற்றும் ஆக்சிஜனேற்ற வினைகளுக்கு உட்படுகின்றன.
1. எலக்ட்ரான் கவர்பொருள் பதிலீட்டு வினைகள்
(அ) நைட்ரோ ஏற்றம்:
பென்சீனை 330K வெப்பநிலையில் (அடர் HNO3 மற்றும் அடர் H2SO4) அடங்கிய நைட்ரோ ஏற்ற கலவையுடன் வெப்பப்படுத்தும் போது பென்சீனில் உள்ள ஹைட்ரஜன் நைட்ரோனியம் அயனியால் NO2+ ஆல் பதிலீடு செய்யபட்டு நைட்ரோ பென்சீன் உருவாகிறது.
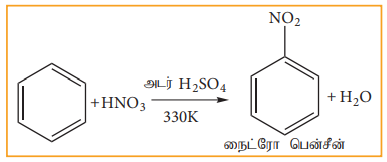
அடர் H2SO4 நைட்ரோனியம் (NO2+) அயனியை உருவாக்குவதற்காக சேர்க்கப்படுகிறது.
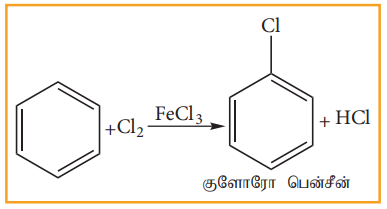
(ஆ) ஹேலஜனேற்றம்:
லூயி அமிலங்களான FeCl3, FeBr3 அல்லது AlCl3 ஆகியவற்றின் முன்னிலையில் பென்சீன் ஹேலஜனுடன் (X2 = Cl2, Br2,) வினைபுரிந்து இணையான ஹேலோ பென்சீனைத் தருகின்றது. வினையூக்கி இல்லாத நிலையில் புளூரின் வீரியத்துடன் வினைபுரிகிறது. எனினும் வினையூக்கி இருப்பினும் அயோடின் வினைத்திறன் அற்றது.
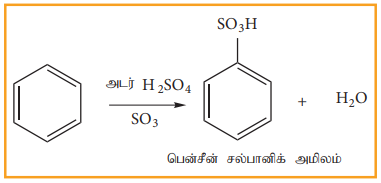
(இ) சல்போனேற்றம் :
புகையும் கந்தக அமிலத்துடன் அடர் H2SO4 + SO3 பென்சீன் வினைபட்டு, பென்சீன் சல்பானிக் அமிலத்தைத் தருகிறது. இங்கு எலட்ரான் கவர் காரணியான SO3 ஒரு நடுநிலை மூலக்கூறாகும். இதில் நேர்மின் சுமை இல்லாத போதிலும், இது ஒரு வலிமையான எலக்ட்ரான் கவர் பொருளாகும். ஏனெனில் சல்பர் அணுவைச் சுற்றி எண்ம எலட்ரான்கள் அமைப்பு இல்லை. இவ்வினை ஒரு மீள்வினையாகும் மேலும் நீரிய ஊடகத்தில் சல்போ நீக்கம் உடனடியாக நடைபெறும்.
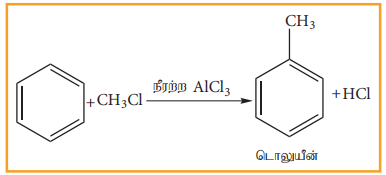
ஈ) பிரீடல் -கிராப்ட் ஆல்கைலேற்றம் (மெத்திலேற்றம்) :
பென்சீனை ஒரு ஆல்கைல் ஹேலைடுடன் நீரற்ற AlCl3 முன்னிலையில் வினைப்படுத்தும் போது ஆல்கைல் பென்சீன் உருவாகிறது.
உ) பிரீடல் - கிராப்ட் (அசிட்டைலேற்றம்)
பென்சீனை அசிட்டைல் குளோரைடுடன் நீரற்ற AlCl3 முன்னிலையில் வினைப்படுத்தும் போது அசிட்டைல் பென்சீன் உருவாகிறது.
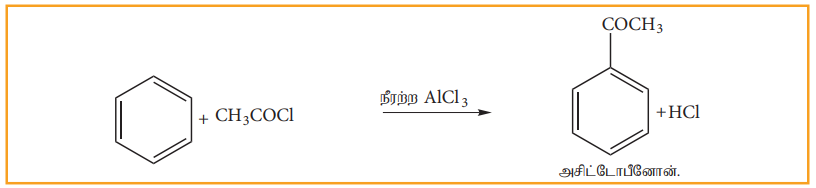
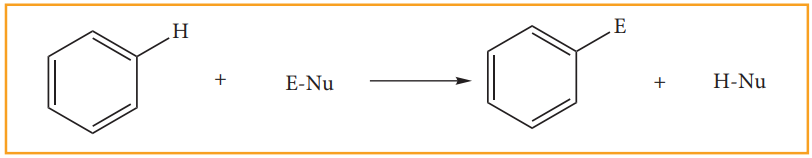
(ஊ) எலக்ட்ரான் கவர்பொருள் பதிலீட்டு வினை :
பென்சீன் உள்ளடங்கா π - எலக்ட்ரான்களைப் பெற்றிருப்பதால் எலக்ரான் அடர்வு மையமாக செயல்படுகிறது எனவே இது எலக்ட்ரான் கவர்பொருள் பதிலீட்டு வினைக்கு உட்படுகின்றது
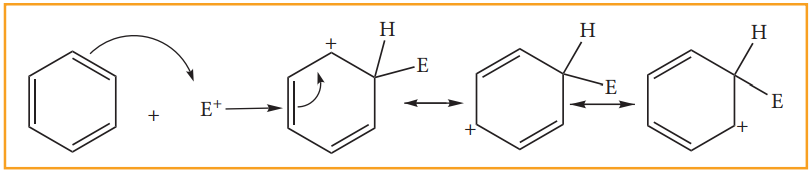
வினை வழிமுறை,
படி 1: எலக்ட்ரான் கவர்பொருள் உருவாதல்
E-Nu + வினையூக்கி → E+ + Nu-வினையூக்கி

படி 2: எலக்ட்ரான் கவர்பொருள் அரோமேட்டிக் வளையத்தினை தாக்குவதால் கார்பன் நேர் அயனி இடைநிலை உருவாகிறது இது உடனிசைவால் நிலைப்புத்தன்மையினைப் பெறுகின்றது
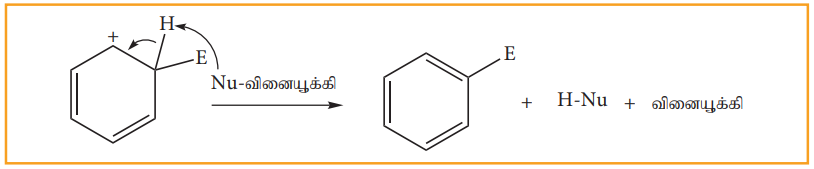
படி 3: புரோட்டான் இழக்கப்பட்டு பதிலீட்டு விளைபொருள் கிடைக்கிறது.
தன்மதிப்பீடு
25) பென்சீனில் எலட்ரான் கவர் பதிலீட்டு வினை நடைபெறுகிறது. ஆனால் ஆல்கீன்களில் சேர்க்கை வினைகள் நடைப்பெறுகின்றன. ஏன்?
தீர்வு:
● பென்சீனில் உள்ளடங்கா π எலக்ட்ரான்கள் பெற்றிருப்பதால் அதன் வளையமானது அதிக எலக்ட்ரான் அடர்வு கொண்ட மையமாக விளங்குகின்றது. எனவே, பென்சீனில் எலக்ட்ரான் கவர் பதிலீட்டு வினைகள் நடைபெறுகின்றன.
● ஆல்கீன்களிலும் எலக்ட்ரான் அடர்வு மூலக்கூறு உள்ளது. ஆனால் எலக்ட்ரான் சேர்க்கை வினையின் போது பிளவுறும் ஒரே ஒரு வலிமை குறைந்த π -பிணைப்பு மற்றும் இரண்டு வலிமையான σ-பிணைப்பு உருவாகின்றன.
(ii) சேர்க்கை வினை
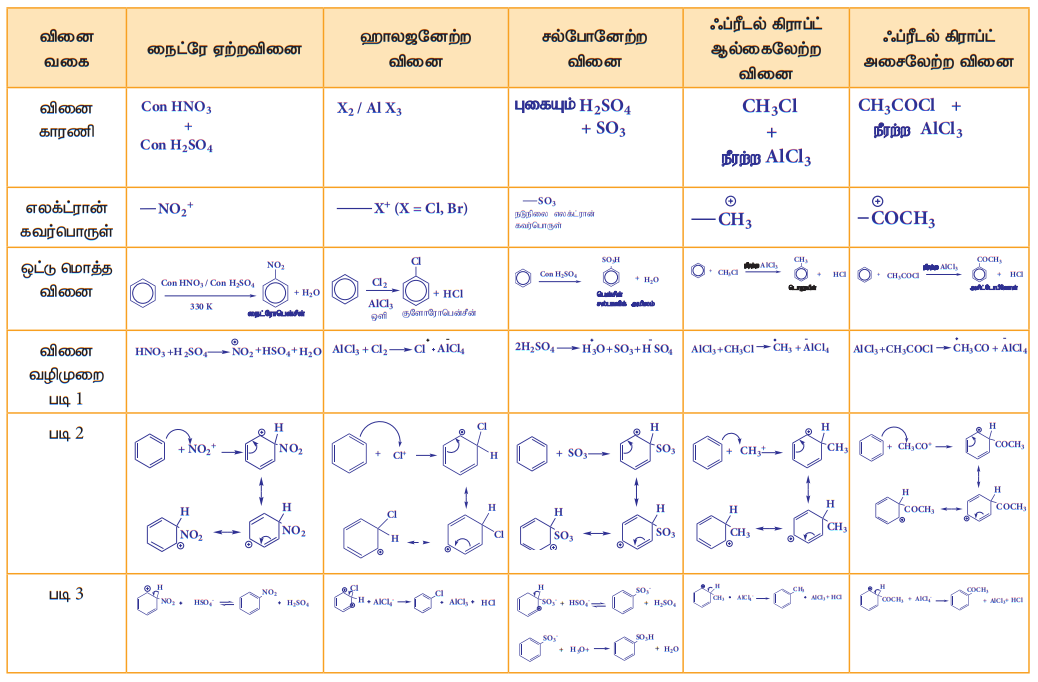
அ) பென்சீனின் ஹைட்ரஜனேற்றம்
பிளாட்டினம் அல்லது பெல்லேடியம் முன்னிலையில் பென்சீன், ஹைட்ரஜனுடன் இணைந்து வளையஹெக்சேனைத் தருகிறது. இதுவே ஹைட்ரஜனேற்றம் எனப்படும்.
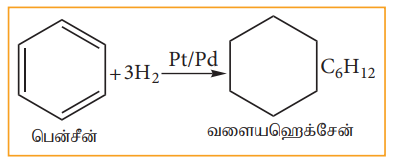
ஆ) பென்சினின் குளோரினேற்றம்
சூரிய ஒளி அல்லது புற ஊதா ஒளி முன்னிலையில், பென்சீன், மூன்று Cl2 மூலக்கூறுகள் உடன் வினைப்பட்டு பென்சீன் ஹெக்சா குளோரைடை (BHC) C6H6Cl6 தருகின்றது. இது கேமக்சேன் அல்லது லிண்டேன் என அழைக்கப்படுகின்றது. இது ஒரு சிறந்த பூச்சிகொல்லி மருந்தாகும்.
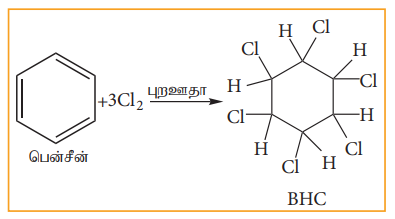
இ) ஆக்சிஜனேற்றம்
அ) ஆவி - நிலை ஆக்சிஜனேற்றம்
பென்சீன் வலிமை மிகு ஆக்சிஜனேற்றியுடன் வினைபுரியாமல் நிலைப்புத்தன்மை உடையதாக உள்ளது ஆனால் 773K வெப்பநிலையில், V2O5 முன்னிலையில், பென்சீனின் வாயுவை ஆக்சிஜனுடன் கலந்து செலுத்தும் போது ஆவி-நிலை ஆக்சிஜனேற்றம் அடைகின்றது. இங்கு வளையம் உடைபட்டு மெலியிக் அமில நீரிலி உருவாகின்றது.
ஆ) பிர்க் ஒடுக்கம்
பென்சீனை நீர்ம அம்மோனியா அல்லது அல்கஹாலில் உள்ள Na அல்லது Li ஐக் கொண்டு ஒடுக்கும் போது 1,4- சைக்ளோஹெக்ஸாடையீன் உருவாகின்றது. இம்முறை வளைய டையீன் எளிதில் தயாரிக்கப் பயன்படுகிறது.
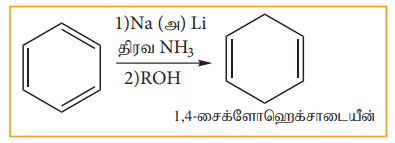
தன்மதிப்பீடு
26) ஈத்தைனை பென்சீனாக மாற்றுக அவ்வினையின் பெயரை எழுதுக.
7. ஒற்றை பதிலீட்டு பென்சீனில் உள்ள வினைசெயல் தொகுதியின் ஆற்றுப்படுத்தும் தன்மை,
ஒற்றை பதிலீடு அடைந்த பென்சீனானது எலக்ட்ரான் கவர்பொருள் பதிலீட்டு வினைக்கு உட்படும் போது, அவ்வினையின் வேகம் மற்றும் உள்வரும் எலக்ட்ரான் கவர் பொருளானது பென்சின் வளையத்தினை தாக்கும் இடம் ஆகியன ஏற்கெனவே பென்சீனில் உள்ள (பதிலீடடைந்த) வினைசெயல் தொகுதிகளால் தீர்மானிக்கப்படுகின்றன. பென்சீன் வளையத்தின் வினைத்திறனை அதிகரிக்கச் செய்யும் அத்தகைய தொகுதிகள் கிளர்வுறுத்தும் தொகுதிகள் எனப்படுகின்றன. அதே நேரத்தில் வினையின் வேகத்தினை குறைக்கும் தொகுதிகள் கிளர்வு நீக்கும் தொகுதிகள் எனப்படுகின்றன. மேலும் இத்தொகுதிகள், உள்வரும் எலக்ட்ரான் கவர்பொருளை பென்சீன் வளையத்தின் எவ்விடத்திற்கு ஆற்றுப்படுத்துகின்றன என்பதனைய் பொருத்து இரு வகைகளாகப் பிரிக்கலாம். ஆர்த்தோ மற்றும் பாரா இடங்களில் எலக்ரான் அடர்வினை அதிகரிக்கச் செய்யும் தொகுதிகள் ஆர்த்தோ பாரா ஆற்றுப்படுத்திகள் எனவும், மெட்டா இடத்தில் எலக்ட்ரான் அடர்வினை அதிகரிக்கச் செய்யும் தொகுதிகள் மெட்டா ஆற்றுப்படுத்திகள் எனவும் அழைக்கப்படுகின்றன. ஒற்றை பதிலீட்டு பென்சீனில்உள்ள தொகுதிகளின் ஆற்றுப்படுத்தும் தன்மை சில எடுத்துக்காட்டுகளுடன் கீழே விளக்கப்பட்டுள்ளன.
ஆர்த்தோ மற்றும் பாரா ஆற்றுப்படுத்திகள்:
அனைத்து கிளர்வுறுத்தும் தொகுதிகளும் ஆர்த்தோ – பாரா ஆற்றுப்படுத்திகளாகும். எடுத்துக்காட்டு -OH, -NH2, NHR, -NHCOCH3, -OCH3-CH3 - C2H5 முதலியன. பீனாலிக் (-OH) தொகுதியின் ஆற்றுப்படுத்தும் தன்மையை நாம் கருதுவோம். பீனால் ஆனது பின்வரும் உடனிசைவு அமைப்புகளின் இனக்கலப்பாகும்.

இந்த உடனிசைவு அமைப்புகளில் எதிர் மின் சுமையானது வளையத்தின் ஆர்த்தோ மற்றும் பாரா இடங்களில் காணப்படுகின்றன. மேலும் பென்சீன் வளையத்துடன் இணைக்கப்பட்டுள்ளன தொகுதியில் உள்ள தனித்த இரட்டை எலக்ட்ரான் ஆனது வளையத்துடன் உடனிசைவில் ஈடுபடுவதால் வளையமானது பென்சீனைக்காட்டிலும் அதிக எலக்ரான் செறிவினை பெறுகிறது. மெட்டா இடத்துடன் ஒப்பிடும்போது ஆர்த்தோ மற்றும் பாரா இடங்களில் எலக்ட்ரான் அடர்வு அதிகமாக காணப்படுகிறது. எனவே பென்சீனுடன் இணைக்கப்பட்டுள்ள பீனாலிக் தொகுதியானது, பென்சீன் வளையத்தினை கிளர்வுறச் செய்வதுடன், புதிதாக உள்வரும் எலக்ரான் கவர் பொருளை ஆர்த்தோ அல்லது பாரா இடத்திற்கு ஆற்றுப்படுத்துகிறது.
எனவே –OH தொகுதியானது ஒரு கிளர்வுறுத்தும் ஆர்த்தோ மற்றும் பாரா ஆற்றுப்படுத்தும் தொகுதியாகும்.
அரைல் ஹாலைடுகளில், ஹேலஜன்களில் −I விளைவின் காரணமாக (எலக்ட்ரானை கவர்ந்திழுக்கும் தன்மை) பென்சீன் வளையத்தின் எலக்ட்ரான் அடர்வு குறைகின்றனது எனவே எலக்ட்ரான் கவர்பொருள் தாக்குவதற்கு கிளர்வு நீக்கியாக இத்தொகுதிகள் உள்ளன எனினும் ஹாலஜன்களில் காணப்படும் தனித்த இரட்டை எலக்ட்ரான்கள் பென்சீன் வளையத்தின் π எலக்ட்ரான்களுடன் உடனிசைவில் ஈடுபடுவதால் ஆர்த்தோ மற்றும் பாரா இடங்களில் எலக்ட்ரான் அடர்வு அதிகரிக்கின்றது. எனவே ஹாலஜன் தொகுதிகள் கிளர்வு நீக்கும் ஆர்த்தோ மற்றும் பாரா ஆற்றுப்படுத்தும் தொகுதிகளாகும்.
மெட்டா ஆற்றுப்படுத்திகள்
பொதுவாக அனைத்து மெட்டா ஆற்றுப்படுத்திகளும் கிளர்வு நீக்கும் தொகுதிகள். எடுத்துக்காட்டாக –NO2,-CN, -CHO, -COR, -COOH, -COOR, - SO3H முதலியன, -CHO தொகுதியின் மெட்டா ஆற்றுப்படுத்தும் தன்மையை நாம் கருதுவோம். பென்சால்டிஹைடு பின்வரும் வடிவங்களின் உடனிசைவு இனக்கலப்பாகும்.

இந்த உடனிசைவு அமைப்புகளில் நேர் மின் சுமையானது வளையத்தில் காணப்படுகின்றது. உடனிசைவினால் அனுக்களின் மீதான இந்த நேர்மின்சுமை உள்ளடங்கா தன்மையினை பெறுகிறது. இதனால் வளயமானது பென்சீனைக் காட்டிலும் குறைவான எலக்ட்ரான் அடர்வினைப் பெறுகிறது. இங்கு -CHO தொகுதியின் - I விளைவின் காரணமாக பென்சீனின் ஒட்டுமொத்த எலக்ட்ரான் அடர்த்தி குறைகிறது. எனவே எலக்ரான் கவர்பொருள் பதிலீட்டு வினைக்கு இத்தொகுதி கிளர்வுநீக்கும் தொகுதியாக உள்ளது. எனினும், எலக்ட்ரான் உடனிசைவு அமைப்புகளை ஒப்பிட்டு நோக்கும் போது o, p இடங்களைக் காட்டிலும் m, இடத்தில் எலக்ட்ரான் அடர்வு அதிகமாக உள்ளது எனவே -CHO தொகுதியானது மெட்டா ஆற்றுப்படுத்தி மற்றும் கிளர்வு நீக்கியாகும்.
தன்மதிப்பீடு
27) பென்சீனைக் காட்டிலும் டொலுயீன் எளிதில் ஆக்சிஜனேற்றம் அடையும் ஏன்?
தீர்வு:
டொலுவினில், -CH3 தொகுதி எலக்ட்ரான் வழங்கவல்லது. எனவே, அத்தொகுதி எலக்ட்ரான் அடர்த்தியை பென்சீன் வளையத்தில் அதிகரிப்பதால், புதிதாக உள்வரும் எலக்ட்ரான் கவர் பொருளை ஆர்த்தோ அல்லது பாரா இடத்திற்கு ஆற்றுப்படுத்துகிறது.
8. புற்றுநோய் உருவாக்கும் தன்மை மற்றும் நச்சுத்தன்மை
பென்சீன் மற்றும் பல வளைய அரோமேட்டிக் ஹைட்ரோகார்பன்கள் ஆகியன கரித்தார், பெட்ரோல், மரம் ஆகியன முழுமையாக எரிக்கப்படாத போது உருவாகும் சுற்றுச்சூழல் மாசுபடுத்திகளாகும் திறந்த வெளி எரித்தல், பெட்ரோலியத்தின் இயற்கை கசிவு, புதைபொருள் படிமம் மற்றும் எரிமலைச் செயல்பாடுகள் ஆகியனவற்றின் மூலமாகவும் பல வளைய அரோமேட்டிக் ஹைட்ரோகார்பன்கள் உருவாகின்றன. இவைகள் நச்சுத்தன்மை மற்றும் புற்றுநோய் உருவாக்கும் தன்மையுடையவை இவை மனிதர்களில் இரத்தஓட்ட மண்டலத்தினை பாதிக்கின்றன. இவைகள் கதிர்வீச்சினைப் போன்ற விளைவை ஏற்படுத்தும் தன்மையுடையது நீண்ட கால பயன்பாடு காரணமாக மரபனு பாதிப்புகள் ஏற்படும். பல வளைய அரோமேட்டிக் சேர்மங்களுக்கான சில எடுத்துக்காட்டுகள்
‘L’ அமைப்புடைய PAH-கள் மிகவும் நச்சுத்தன்மை மற்றும் புற்றுநோய் காரணியாக இருக்கின்றது.
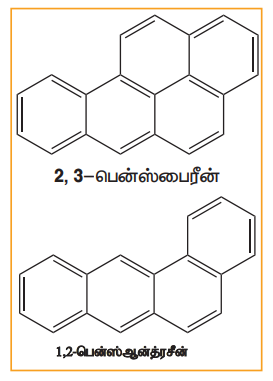
சிகரெட் புகை புகையிலை கரி எரிக்கப்பட்ட உணவுகள் பெட்ரோல் புகை ஆகியவை
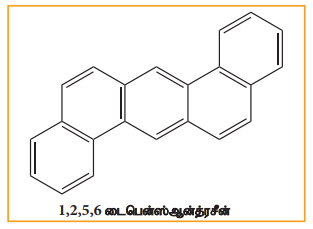
பெட்ரோல் மற்றும் கரி எரிக்கப்பட்ட உணவு வகைகள் புகை ஆகியவை
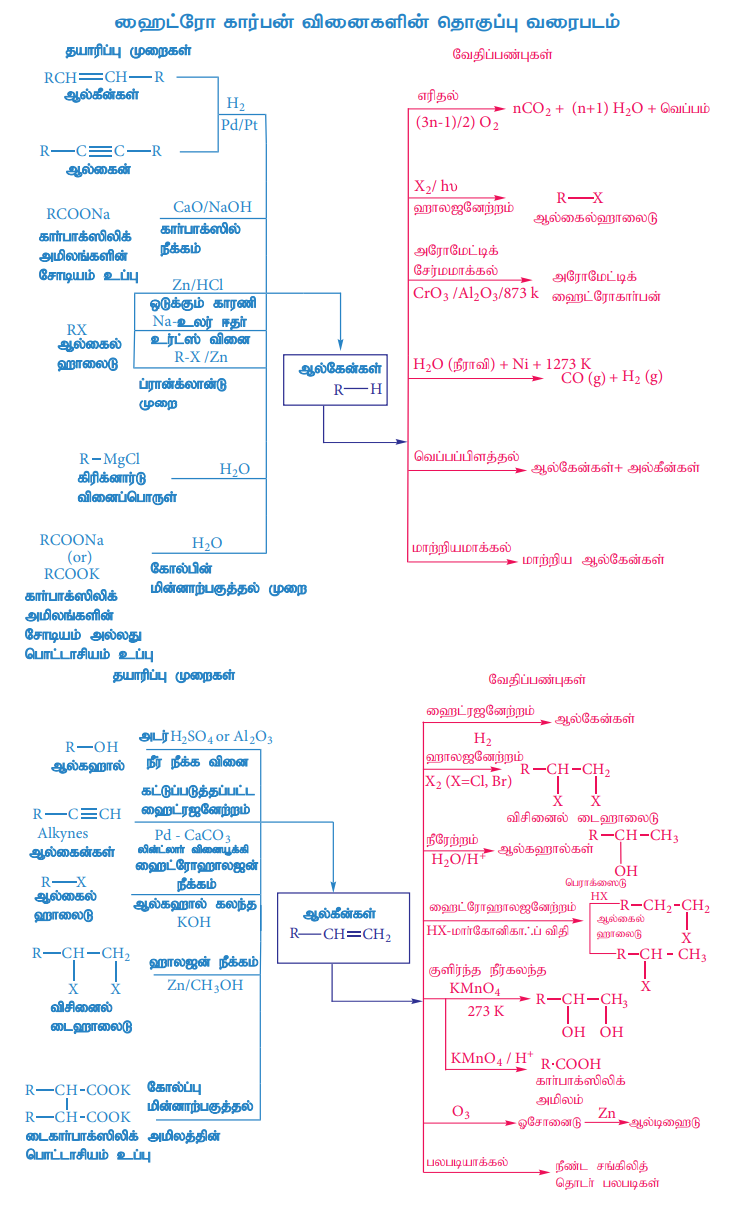
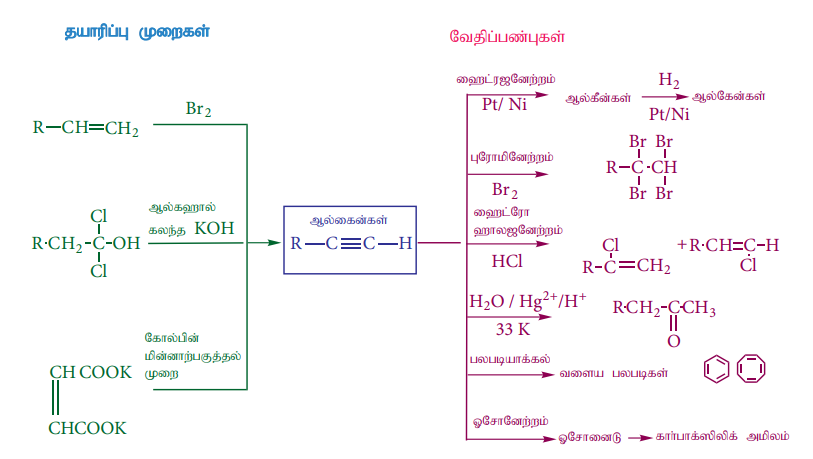
ஹைட்ரோ கார்பன் வினைகளின் தொகுப்பு வரைபடம்