11 வது வேதியியல் : அலகு 1 : வேதியியலின் அடிப்படைக் கருத்துக்கள் மற்றும் வேதிக் கணக்கீடுகள்
ஆக்சிஜனேற்ற – ஒடுக்க வினைக்கான சமன்பாடுகளை சமன் செய்தல்
3. ஆக்சிஜனேற்ற – ஒடுக்க வினைக்கான சமன்பாடுகளை சமன் செய்தல்:
ஆக்சிஜனேற்ற - ஒடுக்க வினைக்கான வேதிச் சமன்பாடுகளை சமன் செய்யும் இருமுறைகள் பின்வருமாறு.
i) ஆக்சிஜனேற்ற எண் முறை
ii) அயனி - எலக்ட்ரான் முறை / அரை வினை முறை
ஆக்சிஜனேற்ற - ஒடுக்க வினைகளில், ஆக்சிஜனொடுக்கியால் இழக்கப்படும் எலக்ட்ரான்களின் மொத்த எண்ணிக்கை, ஆக்சிஜனேற்றியால் ஏற்றுக் கொள்ளப்படும் எலக்ட்ரான்களின் மொத்த எண்ணிக்கைக்கு சமமாகும். மேற்கண்டுள்ள இரு முறைகளும் இத்தத்துவத்தின் அடிப்படையில் அமைந்து உள்ளன.
ஆக்சிஜனேற்ற எண் முறை:
இம்முறையில், வினைபுரிவதற்கு முன்னரும், வினை நிகழ்ந்த பிறகும், தனிமங்களின் ஆக்சிஜனேற்ற எண் கண்டறியப்படுகிறது. இதன் மூலம் வினையில், ஏற்றுக்கொள்ளப்பட்ட அல்லது இழந்த எலக்ட்ரான்களின் எண்ணிக்கையினை கணக்கிடலாம். அமில ஊடகத்தில் பொட்டாசியம் பெர்மாங்கனேட்டால் பெர்ரஸ்சல்பேட் ஆக்சிஜனேற்றம் அடையும் வினையினைக் கருதுவோம். இவ்வினைக்கான சமன் செய்யப்படாத சமன்பாடு,
FeSO4 + KMnO4 + H2SO4 → Fe2(SO4)3 + MnSO4 + K2SO4 + H2O
படி: 1
ஆக்சிஜனேற்ற எண்ணைப் பயன்படுத்தி, ஆக்சிஜனேற்றம் மற்றும் ஆக்சிஜனொடுக்கம் அடையும் வினைபொருட்களை (அணுக்கள்) கண்டறிக.
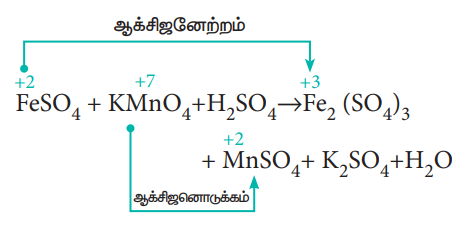
a) ஐந்து எலக்ட்ரான்களை ஏற்பதால், KMnO4 ல் உள்ள Mn ன் ஆக்சிஜனேற்ற எண் +7லிருந்து +2 ஆகக், குறைகிறது.
b) ஒரு எலக்ட்ரானை இழப்பதால், FeSO4 ல் உள்ள Fe ன் ஆக்சிஜனேற்ற எண் +2லிருந்து +3ஆகக் அதிகரிக்கிறது.
படி: 2
ஏற்கப்படும் எலட்ரான்களின் எண்ணிக்கை, இழக்கப்படும் எலக்ட்ரான்களின் எண்ணிக்கைக்குச் சமம் என்பதால், பின்வருமாறு தொடர்புடைய சேர்மத்தின் வாய்ப்பாட்டினை தகுந்த எண்ணால் குறுக்கு பெருக்கம் செய்து எலக்ட்ரான்களை சமப்படுத்துக. வினைவிளைபொருள் Fe2 (SO4)3 ஆனது இரு மோல் இரும்பைக் கொண்டுள்ளதால், 1e- மற்றும் 5e- களை இரண்டால் பெருக்கவும்
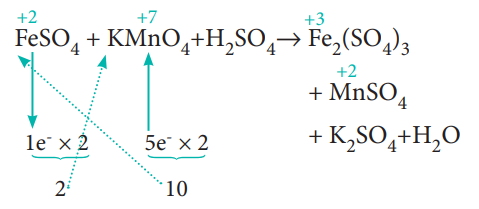
10 FeSO4 + 2 KMnO4 + H2SO4 → Fe2(SO4)3 + MnSO4 + K2SO4 + H2O
படி: 3
ஆக்சிஜனேற்றம் / ஆக்சிஜனொடுக்கம் அடைந்த / வினைவிளைபொருளை சமன் செய்தல்.
குறுக்கு பெருக்கம் செய்த பின், வினைபடு பொருட்களின் அடிப்படையில் வினைவிளை பொருளை (ஆக்சிஜனேற்றம் / ஆக்சிஜனொடுக்கம் அடைந்தவை) சமன் செய்யவும். மேற்கண்டுள்ள சமன்பாடு பின்வருமாறு மாற்றமடைகிறது.
10 FeSO4 + 2 KMnO4 + H2SO4 → 5 Fe2 (SO4)3 + 2 MnSO4 + K2SO4 + H2O
படி: 4
H மற்றும் O வைத் தவிர்த்து பிற தனிமங்களை சமன் செய்க. இந்த தேர்வில், நாம் K மற்றும் S ஐ சமன் செய்ய வேண்டும். ஆனால் K மேற்கண்டுள்ளவாறு தானாகவே சமன் செய்யப்பட்டுள்ளது.
வினைபடு பொருள் : 10 'S' அணுக்கள் (10 FeSO4)
வினைவிளை பொருள்: 18 'S' அணுக்கள்
5 Fe2 (SO4)3 + 2 MnSO4 + K2SO4
15S + 2S + 1S = 18S
எனவே, வினைபடு பொருள் பகுதியில் 8-S அணுக்கள் குறைவாக உள்ளது. எனவே, H2SO4 ஐ '8' ஆல் பெருக்குக.
10 FeSO4 + 2 KMnO4 + 8 H2SO4 → 5 Fe2(SO4)3 + 2 MnSO4 + K2SO4 + H2O
படி : 5
'H' மற்றும் 'O' அணுக்களை சமன் செய்தல்.
வினைபடு பொருள் பகுதி '16' - H அணுக்கள் (8 H2SO4 i.e. 8 × 2H = 16 'H')
வினைவிளை பொருள் பகுதி '2' - H அணுக்கள் (H2O i.e. 1 × 2H = 2 'H')
எனவே விளைபொருள் H2O வை '8' ஆல் பெருக்கு
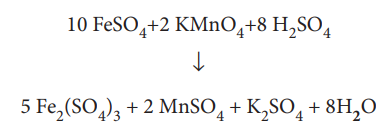
ஆக்சிஜன் அணு தானாகவே சமன் செய்யப்பட்டுவிட்டது. இதுவே சமன்படுத்தப்பட்ட சமன்பாடாகும்.
அயனி - எலக்ட்ரான் முறை
அயனிகள் இடம்பெறும் ஆக்சிஜனேற்ற - ஒடுக்க வினைகளுக்கு இம்முறை பயன்படுத்தப்படுகிறது.
படி : 1
ஆக்சிஜனேற்ற எண் கோட்பாட்டினைப் பயன்படுத்தி, ஆக்சிஜனேற்றம் மற்றும் ஆக்சிஜன் ஒடுக்கம் அடையும் வினைப் பொருட்களைக் கண்டறிக.
படி : 2
ஆக்சிஜனேற்றம் மற்றும் ஒடுக்கத்திற்கு, தனித்தனியே இரு அரைவினைகளை எழுதுக.
ஆக்சிஜனேற்ற எண் முறையினைப் பயன்படுத்தி சமன் செய்ய எடுத்துக்கொண்ட அதே வினையைக் கருதுவோம்.
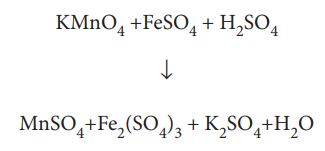
இவ்வினையின் அயனி வடிவம்
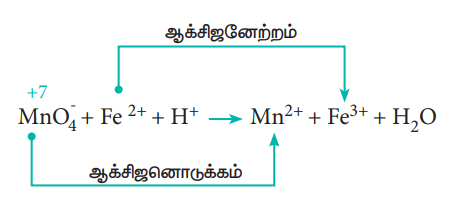
இரு அரைவினைகள் முறையே
Fe2+ → Fe3+ + 1e- -------------------- (1)
மற்றும்
MnO-4 + 5e- → Mn2+ -------------------- (2)
அரைவினைகளின் இருபுறமும் அணுக்கள் மற்றும் மின் சுமையினை சமன் செய்க.
சமன்பாடு (1) மாற்றம் ஏதுமில்லை
Fe2+ → Fe3+ + 1e- -------------------- (1)
சமன்பாடு 2) ⇒ வினைபடுபொருள் பகுதியில் 4'O' உள்ளது.
எனவே, விளைபொருள் பகுதியில் 4H2O சேர்க்கவும். 'H' ஐ சமன் செய்ய, வினைபடுபொருள் பகுதியில் 8H+ சேர்க்கவும்.
MnO-4 + 5e- + 8H+ → Mn2+ + 4H2O ---- (3)
படி : 3
இழந்த எலக்ட்ரான்களின் எண்ணிக்கையும், ஏற்றுக் கொள்ளப்பட்ட எலக்ட்ரான்களின் எண்ணிக்கையும் சமமாகுமாறு, இரு அரைவினைகளையும் சமப்படுத்துக.
பின்னர், இரு அரைவினைகளையும் கூட்டுவதால் சமன்படுத்தப்பட்ட சமன்பாடு (6) கிடைக்கிறது
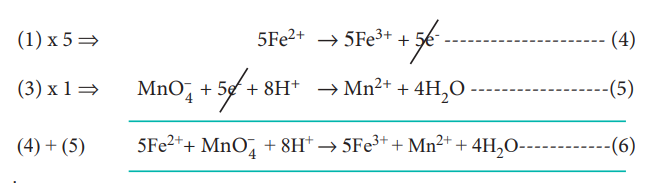
தன் மதிப்பீடு
8. ஆக்சிஜனேற்ற எண்ணைப் பயன்படுத்தி பின்வரும் சமன்பாட்டினை சமன் செய்க.
As2S3 + HNO3 + H2O → H3AsO4 + H2SO4 + NO
தீர்வு
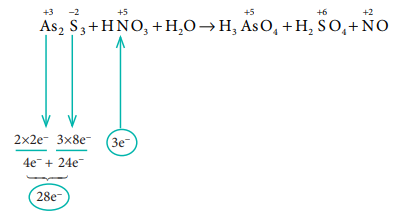
வினைபடு பொருள் உள்ள பகுதியில் எலக்ட்ரான்களின் எண்ணிக்கையை சமன்படுத்துக.
⇒ 3As2S3 + 28HNO3 + H2O → H3AsO4 + H2SO4 + NO
வினைபடு பொருட்களுள்ள பகுதியின் அடிப்படையில் வினைவிளை பொருளை சமன்படுத்துக.
⇒ 3As2S3 + 28HNO3 + H2O → 6H3AsO4 + 9H2SO4 + 28NO
வினைவிளை பொருள் பகுதி : 36 ஹைட்ரஜன் அணுக்கள் & 88 ஆக்ஸிஜன் அணுக்கள்
வினைபடு பொருள் பகுதி : 28 ஹைட்ரஜன் அணுக்கள் & 74 ஆக்ஸிஜன் அணுக்கள்
வேறுபாடானது 8 ஹைட்ரஜன் அணுக்கள் & 14 ஆக்ஸிஜன் அணுக்கள்
ஃ வினைபடு பொருள் பகுதியிலுள்ள H2O மூலக்கூறை '4' ஆல் பெருக்குக. சமன்படுத்தப்பட்ட சமன்பாடானது,
3As2S3 + 28HNO3 + 4H2O → 6H3AsO4 + 9H2SO4 + 28NO