11 வது வேதியியல் : அலகு 1 : வேதியியலின் அடிப்படைக் கருத்துக்கள் மற்றும் வேதிக் கணக்கீடுகள்
எளிய விகித வாய்பாடு மற்றும் மூலக்கூறு வாய்பாடு
எளிய விகித வாய்பாடு மற்றும் மூலக்கூறு வாய்பாடு
தனிமங்களைக் கண்டறியும் ஆய்வின் மூலம் ஒரு சேர்மத்தில் அடங்கியுள்ள தனிமங்களின் நிறை சதவீதத்தினைக் கண்டறியலாம். இந்த நிறை சதவீதத்தினைப் பயன்படுத்தி, நாம் எளிய விகித வாய்ப்பாட்டினைத் தீர்மானிக்க இயலும். சேர்மத்தின் மோலார் நிறையினை பயன்படுத்தி, எளியவிகித வாய்ப்பாட்டிலிருந்து, மூலக்கூறு வாய்ப்பாட்டினைக் கண்டறியலாம்.
சேர்மத்தின், ஒரு மூலக்கூறில் அடங்கியுள்ள வெவ்வேறு தனிமங்களின் எண்ணிக்கையின் எளிய விகிதத்தினை அத்தனிமத்தின் குறியீட்டிற்கு கீழ் ஒட்டாக எழுதுவதால் பெறப்படும் வாய்பாடு எளிய விகித வாய்பாடு எனப்படும். சேர்மத்தின் ஒரு மூலக்கூறில் உள்ள அனைத்து தனிமங்களின் சரியான எண்ணிக்கையினை, அத்தனிமத்தின் குறியீட்டிற்கு கீழ்ஒட்டாக குறிப்பிட்டு எழுதுவதால் பெறப்படும் வாய்பாடு மூலக்கூறு வாய்ப்பாடாகும்.
அசிட்டிக் அமிலத்தினை எடுத்துக்காட்டாகக் கொண்டு எளிய விகித வாய்ப்பாட்டினை நாம் புரிந்து கொள்வோம்.
அசிட்டிக் அமிலத்தின் மூலக்கூறு வாய்பாடு C2 H4 O2 ஆகும்.
C : H : O இவற்றிற்கிடையேயான விகிதம் 1 : 2 : 1 எனவே அசிட்டிக் அமிலத்தின் எளிய விகித வாய்பாடு CH2O.
1. தனிமங்களைக் கண்டறியும் பகுப்பாய்வு தரவுகளிலிருந்து எளிய விகித வாய்ப்பாட்டினைத் தீர்மானித்தல்.
நிலை 1 : தனிமங்களின் இயைபானது சதவீதத்தில் குறிப்பிடப் படுவதால், சேர்மத்தின் மொத்த நிறையினை நாம் 100g என எடுத்துக்கொள்வதுடன், தனிமங்களின் நிறை சதவீதத்தினை அவற்றின் நிறையினை (கிராமில்) குறிப்பிடுவதாகக் கொள்ளலாம்.
நிலை 2 : ஒவ்வொரு தனிமத்தின் நிறையினையும், அதன் அணு நிறையால் வகுக்க இது சேர்மத்தில் உள்ள தனிமங்களின் ஒப்பு மோல்களின் எண்ணிக்கையினைத் தருகிறது.
நிலை 3 : நிலை 2ல் பெறப்பட்ட ஒப்பு மோல்களின் எண்ணிக்கையினை, அவற்றினுள் உள்ள சிறிய எண்ணால் வகுத்து, எளிய விகிதத்தினைப் பெறவேண்டும்.
நிலை 4 : (தேவையெனில்) நிலை 3ல் பெறப்பட்ட எண்கள் முழு எண்ணாக இல்லாமல் பின்ன எண்ணாக இருப்பின், தகுந்த எண்ணைக்கொண்டு பெருக்குவதன் மூலம் முழு எண்ணாக மாற்றுக.
எடுத்துக்காட்டு :
1. புளியில் காணப்படும் ஒரு அமிலம் பகுப்பாய்வில் பின்வரும் சதவீத இயைபினைக் கொண்டுள்ளது: 32% கார்பன், 4% ஹைட்ரஜன், 64% ஆக்சிஜன். அச்சேர்மத்தின் எளிய விகித வாய்ப்பாபாட்டினைக் கண்டறிக.
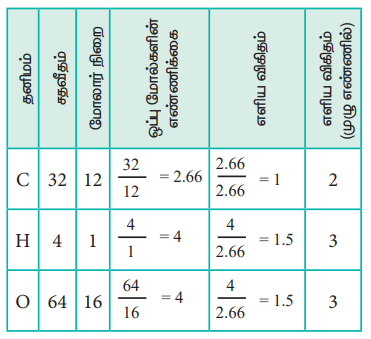
எளிய விகித வாய்பாடு C2 H3 O3
2. வினிகரில் காணப்படும் ஒரு கரிமச் சேர்மம் 40% கார்பன், 6.6% ஹைட்ரஜன் மற்றும் 53.4% ஆக்சிஜனைக் கொண்டுள்ளது. அச்சேர்மத்தின் எளிய விகித வாய்ப்பாட்டினைக் கண்டறிக.
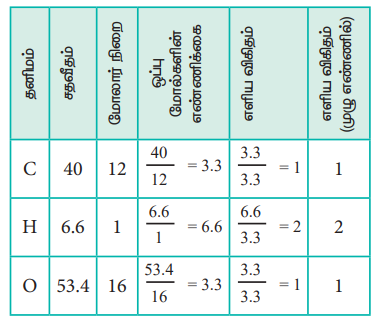
எளிய விகித வாய்பாடு C H2 O
தன்மதிப்பீடு
5. ஒரு சேர்மம் பகுப்பாய்வில் பின்வரும் சதவீத இயைபைக் கொண்டுள்ளது. C = 54.55%, H = 9.09%, O = 36.36% அச்சேர்மத்தின் எளிய விகித வாய்ப்பாட்டினைக் கண்டறிக.
தீர்வு:
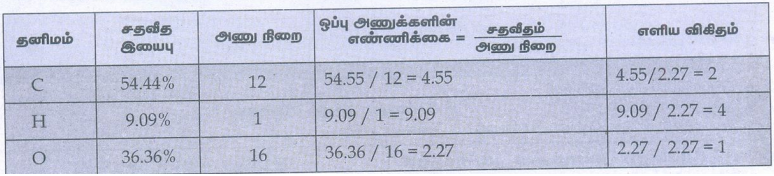
எளிய விகித வாய்ப்பாடு (C2H4O)
எளிய விகித வாய்ப்பாட்டின் ஒரு குறிப்பிட்ட முழு எண் மடங்கு மூலக்கூறு வாய்ப்பாட்டினைத் தருகிறது. அந்த முழு எண்ணை, அச் சேர்மத்தின் மோலார் நிறையினைக் கொண்டு பின்வரும் வாய்ப்பாட்டின் மூலம் பெற இயலும்.
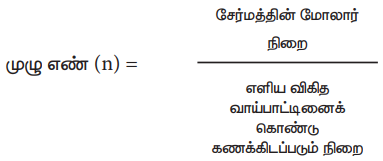
முழு எண் (n) = சேர்மத்தின் மோலார் நிறை / எளிய விகித வாய்பாட்டினைக் கொண்டு கணக்கிடப்படும் நிறை
2. எளிய விகித வாய்ப்பாட்டிலிருந்து மூலக்கூறு வாய்பாட்டினைக் கணக்கிடுதல்:
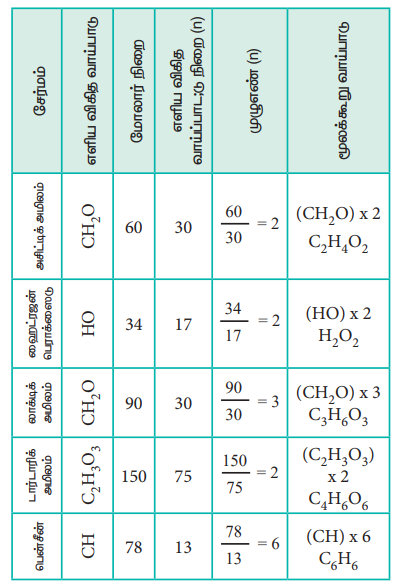
மூலக்கூறு வாய்ப்பாட்டினை கண்டறிவதை பின்வரும் எடுத்துக்காட்டின் மூலம் நாம் புரிந்து கொள்வோம்.
C-40%, H-6.6% ; O-53.4% நிறை சதவீத இயைபுடைய இரு கரிமச்சேர்மங்களில் ஒன்று வினிகரில் காணப்படுகிறது (மோலார்நிறை 60g mol-1), மற்றொன்று புளித்த பாலில் காணப்படுகிறது (மோலார்நிறை 90g mol-1) அவைகளின் மூலக்கூறு வாய்பாடுகளைக் கண்டறிக.
இரண்டு சேர்மங்களும் ஒரே சதவீத இயைபைக் கொண்டுள்ளன. எடுத்துக்காட்டு (2)ல் தீர்வு காணப்பட்ட எளிய விகித வாய்பாடும், இவ்விரண்டு சேர்மங்களின் எளிய விகித வாய்பாடுகளும் ஒன்றே. அதாவது எளிய விகித வாய்பாடு CH2O ஆகும். எளிய விகித வாய்ப்பாட்டினைக் கொண்டு கணக்கிடப்படும் நிறை
(CH2O) = 12 + (2 × 1) + 16 = 30 g mol-1
வினிகரில் காணப்படும் சேர்மத்தின் வாய்பாடு
n = மோலார் நிறை / கணக்கிடப்பட்ட எளிய விகித வாய்ப்பாட்டு நிறை = 60 / 30 = 2
ஃ மூலக்கூறு வாய்பாடு = (CH2 O)2
= C2 H4 O2 (அசிட்டிக் அமிலம்)
தன்மதிப்பீடு
6) x, y, z ஆகிய தனிமங்களைக் கொண்டுள்ள ஒரு சேர்மத்தின் பகுப்பாய்வு முடிவுகளிலிருந்து பின்வரும் தரவுகள் பெறப்பட்டுள்ளது. x = 32%, y = 24%, z = 44% x, y மற்றும் z ன் ஒப்பு அணுக்களின் எண்ணிக்கை முறையே 2, 1 மற்றும் 0.5 ஆகும். (சேர்மத்தின் மூலக்கூறு நிறை 400g)
i) தனிமங்கள் x, y மற்றும் z ன் அணு நிறைகளைக் காண்க.
ii) சேர்மத்தின் எளிய விகித வாய்பாடு மற்றும்
iii) சேர்மத்தின் மூலக்கூறு வாய்ப்பாட்டினைக் கண்டறிக.
தீர்வு
கணக்கிடப்பட்ட எளிய விகித வாய்ப்பாட்டு முறை = (16 × 14) + (24 × 2) + 88
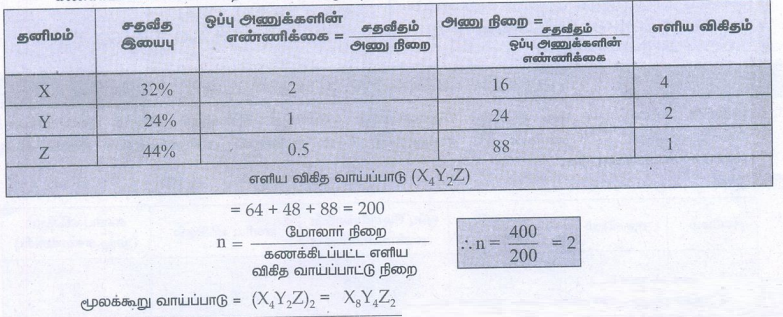
= 64 + 48 + 88 = 200
n = மோலார் நிறை / கணக்கிடப்பட்ட எளிய விகித வாய்ப்பாட்டு நிறை
மூலக்கூறு வாய்ப்பாடு = (X4Y2Z) 2 = X8Y4Z2
∴ n = 400 / 200 = 2
புளித்த பாலில் காணப்படும் சேர்மத்தின் மூலக்கூறு வாய்பாடு
n = மோலார் நிறை / 30 = 90 / 30 = 3
மூலக்கூறு வாய்பாடு = (CH2 O)3
= C3 H6 O3 (லாக்டிக் அமிலம்)