கேள்விகளுக்கான பதில்கள் - சரியான விடையை தெரிவு செய்க | 11th Chemistry : UNIT 1 : Basic Concepts of Chemistry and Chemical Calculations
11 வது வேதியியல் : அலகு 1 : வேதியியலின் அடிப்படைக் கருத்துக்கள் மற்றும் வேதிக் கணக்கீடுகள்
சரியான விடையை தெரிவு செய்க
மதிப்பீடு
I. சரியான விடையை தெரிவு செய்க.
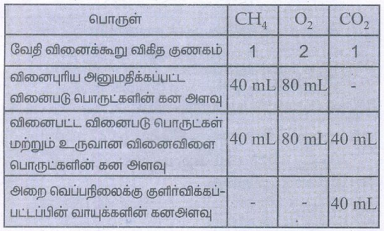
1. 40 மி.லி மீத்தேன் வாயுவானது 80 மி.லி ஆக்சிஜனைக் கொண்டு முழுமையாக எரிக்கப்படுகிறது. அறை வெப்பநிலைக்கு குளிர்விக்கப்பட்ட பிறகு எஞ்சியுள்ள வாயுவின் கனஅளவு
அ. 40 மி.லி CO2 வாயு
ஆ. 40 மி.லி CO2 மற்றும் 80 மி.லி H2O வாயு
இ. 60 மி.லி CO2 மற்றும் 60 மி.லி H2O வாயு
ஈ. 120 மி.லி CO2 வாயு
[விடை: அ) 40மி.லி CO2 வாயு]
தீர்வு:
1. CH4(g) + 2O2 (g) → CO2 (g) + 2 H2O (l)
2. தனிமம் X ன் ஐசோடோப்புகளின் இயைபு பின்வருமாறு அமைகிறது. 200X = 90 %, 199X = 8 %, 202X = 2 % இயற்கையில் கிடைக்கும் தனிமம் X ன் தோராய அணு நிறை மதிப்பு
அ. 201 u
ஆ. 202 u
இ. 199 u
ஈ. 200 u
[விடை: ஈ) 200 u]
தீர்வு:
(200 × 90) + (199 × 8) + (202 × 2) / 100 = 199.96
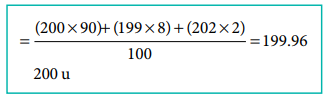
= 200 u
3. கூற்று (A) : இரு மோல் குளுக்கோஸில் 12.044 × 1023 குளுக்கோஸ் மூலக்கூறுகள் உள்ளன.
காரணம் (R) : ஒரு மோல் அளவுள்ள எந்த ஒரு பொருளிலும் உள்ள உட்பொருட்களின் எண்ணிக்கை 6.02 × 1022
அ. கூற்று (A) மற்றும் காரணம் (R) இரண்டும் சரி, மேலும் காரணம் (R) ஆனது கூற்று (A) க்கான சரியான விளக்கம்
ஆ. கூற்று (A) மற்றும் காரணம் (R) இரண்டும் சரி, மேலும் காரணம் (R) ஆனது கூற்று (A) க்கான சரியான விளக்கமல்ல
இ. கூற்று (A) சரி மற்றும் காரணம் (R) தவறு
ஈ. கூற்று (A) மற்றும் காரணம் (R) இரண்டும் தவறு
[விடை: இ) கூற்று (A) சரி மற்றும் காரணம் (R) தவறு]
தீர்வு:
சரியான காரணம் : ஒரு மோல் அளவுள்ள எந்தவொரு சேர்மத்திலும் அடங்கியுள்ள உட்பொருட்களின் எண்ணிக்கை 6.022 × 1023
4. கார்பன், கார்பன் மோனாக்ஸைடு கார்பன் டையாக்ஸைடு எனும் இரண்டு ஆக்ஸைடுகளை உருவாக்குகிறது. எந்த தனிமத்தின் சமான நிறை மாறாமல் உள்ளது?
அ. கார்பன்
ஆ. ஆக்ஸிஜன்
இ. கார்பன் மற்றும் ஆக்ஸிஜன்
ஈ. கார்பன், ஆக்ஸிஜன் இரண்டுமில்லை
[விடை: ஆ) ஆக்ஸிஜன்]
தீர்வு:
வினை 1:
2C + O2 → 2 CO
2 × 12g கார்பனானது 32g ஆக்ஸிஜனுடன் இணைந்துள்ளது,
எனவே கார்பனின் சமான நிறை [(2 × 12) / 32] × 8 = 6
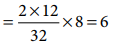
வினை 2:
C + O2 → CO2
12g கார்பனானது 32g ஆக்ஸிஜனுடன் இணைந்து உள்ளது,
எனவே கார்பனின் சமான நிறை = (12/32) × 8 = 3
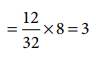
5. இணைதிறன் மூன்று கொண்ட உலோகத் தனிமத்தின் சமான நிறை 9g.eq-1 அதன் நீரற்ற ஆக்ஸைடின் மூலக்கூறு நிறை
அ. 102 g
ஆ. 27g
இ. 270 g
ஈ. 78 g
[விடை: அ) 102 g ]
தீர்வு:
இணைதிறன் மூன்று கொண்ட உலோகத்தினை M3+ என்க
சமான நிறை = உலோகத்தின் நிறை / சமான காரணி
9g eq−1 = உலோகத்தின் நிறை / 3eq
உலோகத்தின் நிறை = 27g
உருவாகும் ஆக்ஸைடு = M2O3 ;
ஆக்ஸைடின் நிறை = (2 × 27) + (3 × 16)
= 102g
6. 0.018 கிராம் எடையுள்ள நீர்த்துளியில் உள்ள நீர் மூலக்கூறுகளின் எண்ணிக்கை
அ. 6.022 × 1026
ஆ. 6.022 × 1023
இ. 6.022 × 1020
ஈ. 9.9 × 1022
[விடை: இ) 6.022 × 1020 ]
தீர்வு:
நீர்த்துளியின் எடை = 0.018g
நீர்த்துளியில் உள்ள மோல்களின் எண்ணிக்கை = நீரின் நிறை / மோலார் நிறை
= 0.018 / 18 = 10−3 மோல்
1 மோல் நீரில் காணப்படும் நீர் மூலக்கூறுகளின் எண்ணிக்கை = 6.022 × 1023
1 நீர்த்துளியில் காணப்படும் நீர் மூலக்கூறுகளின் எண்ணிக்கை (10−3 மோல்)
= 6.022 × 10−23 × 10−3 = 6.022 × 1020
7. 1g மாசு கலந்த மெக்னீஷியம் கார்பனேட் மாதிரியை (வெப்பச்சிதைவு அடையாத மாசுக்களைக் கொண்டது) முழுமையாக வெப்பச்சிதைவிற்கு உட்படுத்தும்போது 0.44g கார்பன்டையாக்ஸைடு வாயுவை தருகிறது. இம்மாதிரியிலுள்ள மாசு சதவீதம்.
அ. 0%
ஆ. 4.4%
இ. 16%
ஈ. 8.4 %
[விடை: இ) 16% ]
தீர்வு:
MgCO3 → MgO + CO2 ↑
MgCO3 : (1 × 24) + (1 × 12) + (3 × 16) = 84g
CO2 : (1 × 12) + (2 × 16) = 44g
100% தூய்மையுடைய 84g MgCO3 ஆனது வெப்பப்படுத்தும் போது 44gCO2 ஐத் தருகிறது.
1g MgCO3 ஆனது வெப்பப்படுத்தும் பொழுது 0.44gCO2 ஐத் தருகிறது. என கொடுக்கப்பட்டுள்ளது. எனவே,
84g MgCO3 மாதிரியினை வெப்பப்படுத்தும் பொழுது 36.96 g CO2 ஐத் தரும்
மாதிரியினுடைய தூய்மைத் தன்மையின் சதவீதம் = (100% / 44g CO2) × 36.96g CO2 = 84%
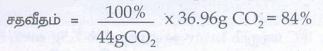
ஃ மாசு சதவீதம் = 16%
8. 6.3g சோடியம் பை கார்பனேட்டை, 30g அசிட்டிக் அமில கரைசலுடன் சேர்த்த பின்னர் எஞ்சியுள்ள கரைசலின் எடை 33g. வினையின்போது வெளியேறிய கார்பன்டையாக்ஸைடின் மோல் எண்ணிக்கை
அ. 3
ஆ. 0.75
இ. 0.075
ஈ. 0.3
[விடை: இ) 0.075]
தீர்வு:
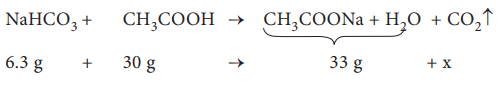
வெளியேறிய CO2 அளவு x = 3.3g
வெளியேறிய CO2 ன் மோல்களின் எண்ணிக்கை = 3.3/44 = 0.075 மோல்
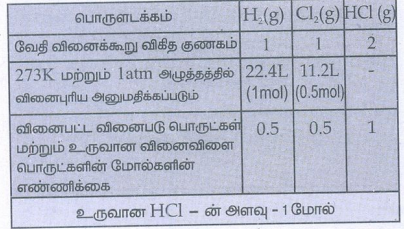
9. STP நிலையில் உள்ள 22.4 லிட்டர் H2 (g) வாயு, 11.2லிட்டர் Cl2 வாயுடன் கலக்கப்படும்போது உருவாகும் HCl (g) வாயுவின் மோல் எண்ணிக்கை
அ. 2 மோல்கள் HCl (g)
ஆ. 0.5 மோல்கள் HCl (g)
இ. 1.5 மோல்கள் HCl (g)
ஈ. 1 மோல் HCl (g)
[விடை: ஈ) 1 மோல் HCl (g) ]
தீர்வு:
H2(g) + Cl2 (g) → 2 HCl (g)
10. சூடான அடர் கந்தக அமிலம் ஒரு மிதமான ஆக்சிஜனேற்றி, பின்வரும் வினைகளில் எது ஆக்ஸிஜனேற்றப் பண்பைக் குறிப்பிடவில்லை?
அ. Cu + 2 H2SO4 → CuSO4 + SO2 + 2 H2O
ஆ. C + 2 H2SO4 → CO2 + 2 SO2 + 2 H2O
இ. BaCl2 + H2SO4 → BaSO4 + 2 HCl
ஈ இவற்றில் எதுவுமில்லை
[விடை: இ) BaCl2 + H2SO4 → BaSO4 + 2HCl]
தீர்வு:
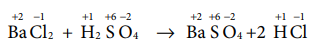
11. பின்வரும் ஆக்ஸிஜனேற்ற ஒடுக்க வினைகளில் எது விகிதச்சிதைவு வினை?
அ. 3 Mg (s) + N2 (g) → Mg3N2 (s)
ஆ. P4 (s) + 3 NaOH + 3H2O → PH3 (g) + 3 NaH2PO2 (aq)
இ. Cl2 (g) + 2 KI (aq) → 2 KCl (aq) + I2
ஈ. Cr2O3 (s) + 2 Al (s) → Al2O3 (s) + 2Cr (s)
[விடை: ஆ) P4(s) + 3NaOH + 3H2O → PH3(g) + 3NaH2PO2(aq)]
தீர்வு:
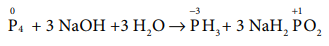
12. கார ஊடகத்தில் பொட்டாசியம் பெர்மாங்கனேட்டின் சமான நிறை மதிப்பு
(MnO4- + 2 H2O + 3e- → MnO2 + 4 OH-)
அ. 31.6
ஆ. 52.7
இ. 79
ஈ. இவற்றில் எதுவுமில்லை
[விடை: ஆ) 52.7]
தீர்வு:
ஆக்ஸிஜனேற்றியான (MnO−4) ஆனது ஒடுக்க வினைக்கு உட்படும் போது மூன்று எலக்ட்ரான்களை ஏற்றுக் கொள்கிறது. எனவே சமானநிறை
= (KMnO4 − ன் மோலார்நிறை) / 3
= 158.1 / 3 = 52.7
13. பின்வருவனவற்றுள், 180 g நீரில் உள்ளது எது?
அ. 5 மோல்கள் நீர்
ஆ. 90 மோல்கள் நீர்
இ. (6.022 × 1023) / 180 நீர் மூலக்கூறுகள்
ஈ. 6.022 × 1024 நீர் மூலக்கூறுகள்
[விடை: ஈ) 6.022 × 1024 நீர் மூலக்கூறுகள்]
தீர்வு:
180g நீரில் காணப்படும் மோல்களின் எண்ணிக்கை = நீரின் நிறை /நீரின் மோலார் நிறை
= 180g/ 18g mol−1 =10 மோல்கள்
நீரில் 6.022 × 1023 நீர் மூலக்கூறுகள் உள்ளன.
10 மோல் நீரில் 6.022 × 1023 × 10 = 6.022 × 1024 நீர் மூலக்கூறுகள் உள்ளன.
14. 0° C மற்றும் 1 atm அழுத்தத்தில் 7.5g வாயு 5.6 L கனஅளவை அடைத்துக்கொள்கிறது எனில், அந்த வாயு
அ. NO
ஆ. N2O
இ CO
ஈ. CO2
[விடை: அ) NO ]
தீர்வு:
273K மற்றும் 1 atm அழுத்தத்தில் 7.5g வாயு அடைத்துக் கொள்ளும் கனஅளவு 5.6 லிட்டர் எனவே, 22.4 லிட்டர் கனஅளவை அடைத்துக் கொள்ளும் வாயுவின் நிறை
= 7.5g/5.6L = x22.4L = 30g
NO− ன் மோலார் நிறை (14 + 16) = 30g
15. 1.7 g அம்மோனியாவில் உள்ள எலக்ட்ரான்களின் எண்ணிக்கை
அ. 6.022 × 1023
ஆ. (6.022 × 1022) / 1.7
இ. (6.022 × 1024) / 1.7
ஈ. (6.022 × 1023) / 1.7
[விடை: அ) 6.022 × 1023 ]
தீர்வு:
ஒரு அம்மோனியா (NH3) மூலக்கூறில் காணப்படும் எலக்ட்ரான்களின் எண்ணிக்கை (7 + 3) = 10
அம்மோனியா மோல்களின் எண்ணிக்கை = நிறை /மோலார் நிறை = 1.7g /17gmol−1

= 0.1mol
0.1மோல் அம்மோனியாவில் காணப்படும் மூலக்கூறுகளின் எண்ணிக்கை = 0.1 × 6.022 × 1023 = 6.022 × 1022
0.1 மோல் அம்மோனியாவில் காணப்படும் எலக்ட்ரான்களின் எண்ணிக்கை = 10 × 6.022 × 1022 = 6.022 × 1023
16. SO42-, SO32-, S2O42-, S2O62- ஆகிய எதிரயனிகளில் சல்பரின் ஆக்ஸிஜனேற்ற எண்களின் அடிப்படையில் சரியான ஏறுவரிசை எது?
அ. SO32- < SO42- < S2O42- < S2O62-
ஆ. SO42- < S2O42- < S2O62- < SO32-
இ. S2O42- < SO32- < S2O62- < SO42-
ஈ. S2O62- < S2O42- < SO42- < SO32-
[விடை: இ S2O42−< SO32−< S2O62−< SO42− ]
தீர்வு:
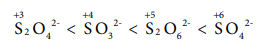
17. பெர்ரஸ் ஆக்சலேட்டின் சமான நிறை
அ. பெர்ரஸ் ஆக்சலேட்டின் மோலார் நிறை / 1
ஆ. பெர்ரஸ் ஆக்சலேட்டின் மோலார் நிறை / 2
இ. பெர்ரஸ் ஆக்சலேட்டின் மோலார் நிறை / 3
ஈ. மேற்கண்ட எதுவுமில்லை.
[விடை: இ) பெர்ரஸ் ஆக்சலேட்டின் மோலார் நிறை /3]
தீர்வு:

FeC2 O4 ன் சமான நிறை = பெர்ரஸ் ஆக்சலேட்டின் மோலார் நிறை /3
18. அவகாட்ரோ எண் மதிப்பு 6.022 × 1023 லிருந்து 6.022 × 1020 க்கு மாற்றப்படுகிறது. இதனால் மாறுவது
அ. ஒரு சமன் செய்யப்பட்ட சமன்பாட்டில் வினைப்பொருட்களின் விகிதம்.
ஆ. ஒரு சேர்மத்திலுள்ள தனிமங்களின் விகிதம்
இ. கிராம் அலகில் நிறையின் வரையறை
ஈ. 1 மோல் கார்பனின் நிறை
[விடை: ஈ) 1 மோல் கார்பனின் நிறை]
தீர்வு:
ஒரு மோல் கார்பனின் நிறை
19. 22.4 L கனஅளவு கொண்ட இரு கொள்கலன்கள் A மற்றும் B யில் முறையே 8g O2 மற்றும் 8g SO2 வாயுக்கள் STP நிலையில் நிரட்டப்பட்டுள்ளது. எனில்
அ. A மற்றும் B கலன்களிலுள்ள மூலக்கூறுகள் சமம்.
ஆ. B கலனிலுள்ள மூலக்கூறுகளின் எண்ணிக்கை A ல் உள்ளதை விட அதிகம்.
இ. A மற்றும் B கலன்களிலுள்ள மூலக்கூறுகளின் எண்ணிக்கைக்கு இடைப்பட்ட விகிதம் 2:1
ஈ. B கலனிலுள்ள மூலக்கூறுகளின் எண்ணிக்கை A ல் உள்ளதை போல மூன்று மடங்கு அதிகம்.
[விடை: இ) A மற்றும் B கலன்களிலுள்ள மூலக்கூறுகளின் எண்ணிக்கைக்கு இடைப்பட்ட விகிதம் 2:1]
தீர்வு:
ஆக்ஸிஜனின் மோல்களின் எண்ணிக்கை = 8g/32g
= 0.25 மோல்கள்
சல்பர் டை ஆக்ஸைடின் மோல்களின் எண்ணிக்கை = 8g/ 64g
= 0.125 மோல்கள்
மூலக்கூறுகளின் எண்ணிக்கைகளுக்கு இடையேயான விகிதம் = 0.25 : 0.125 = 2 : 1
20. 50 mL 8.5 % AgNO3 கரைசலை 100 mL. 1.865% பொட்டாசியம் குளோரைடு கரைசலுடன் சேர்க்கும் போது கிடைக்கும் வீழ்படிவின் எடை என்ன?
அ. 3.59g
ஆ. 7g
இ. 14 g
ஈ. 28 g
[விடை: அ) 3.59g]
தீர்வு:
AgNO3 + KCl → KNO3 + AgCl
50 mL 8.5% கரைசல் ஆனது 4.25g AgNO3 −ஐக் கொண்டுள்ளது. 50 mL 8.5% AgNO3 கரைசலில் உள்ள AgNO3 ன் மோல்களின் எண்ணிக்கை = நிறை / மோலார் நிறை
= 4.25/170 = 0.025 மோல்கள்
இதைப்போலவே, 100 mL 1.865% KCl கரைசலில் காணப்படும் KCl ன் மோல்களின் எண்ணிக்கை = 1.865 / 74.5
= 0.025 மோல்கள்
எனவே உருவாகும் AgCl ன் மொத்த அளவு 0.025 மோல்கள் (வேதி வினைக்கூறு விகிதத்தின் அடிப்படையில்)
0.025 மோல்கள் AgCl ல் காணப்படும் AgCl − ன் அளவு
= மோல்களின் எண்ணிக்கை × மோலார் நிறை
= 0.025 × 143.5 = 3.59g
21. 1.1 g வாயு, அறை வெப்பநிலை மற்றும் அழுத்தத்தில் (25° C மற்றும் 1atm அழுத்தம்) 612.5 mL கனஅளவை அடைத்துக்கொள்கிறது. அந்த வாயுவின் மோலார் நிறை
அ. 66.25 g mol-1
ஆ. 44 g mol-1
இ. 24.5 g mol-1
ஈ. 662.5 g mol-1
[விடை: ஆ) 44g mol−1]
தீர்வு:
அறை வெப்பநிலை மற்றும் அழுத்தத்தில் (25°C மற்றும் 1 atm அழுத்தம்) 612.5 mL கன அளவை அடைத்துக் கொள்ளும் ஒரு வாயுவின் மோல்களின் எண்ணிக்கை
= 612.5 × 10−3 L/24.5 Lmol−1 = 0.025 மோல்கள்
நாம் அறிந்தபடி,
மோலார் நிறை = நிறை / மோல்களின் எண்ணிக்கை
= 1.1g / 0.025 mol = 44g mol−1
22. பின்வருவனவற்றுள் எது 6 g கார்பன் - 12 ல் உள்ள அணுக்களுக்கு சமமான கார்பன் அணுக்களை கொண்டுள்ளது?
அ. 7.5 g ஈத்தேன்
ஆ. 8 g மீத்தேன்
இ. (அ) மற்றும் (ஆ)
ஈ. எதுவுமில்லை
[விடை: இ) (அ) மற்றும் (ஆ)]
தீர்வு:
6g C −12 ல் காணப்படும் கார்பனின் மோல்களின் எண்ணிக்கை = நிறை / மோலார் நிறை
= 6/12 = 0.5 மோல்கள் = 0.5 × 6.022 × 1023 கார்பன் அணுக்கள்
8g மீத்தேனில் உள்ள மோல்களின் எண்ணிக்கை = 8/16 = 0.5 மோல்கள்
0.5 × 6.022 × 1023 கார்பன் அணுக்கள்
7.5g ஈத்தேனில் உள்ள மோல்களின் எண்ணிக்கை = 7.5 / 16 = 0.25 மோல்கள்
= 2 × 0.25 × 6.022 × 1023 கார்பன் அணுக்கள்
23. பின்வருவனவற்றுள் எத்திலீனில் (C2H4) காணப்படும் கார்பன் சதவீதத்திற்கு சமமான கார்பன் சதவீதத்தை பெற்றுள்ளது எது?
அ. புரப்பீன்
ஆ. ஈத்தைன்
இ. பென்சீன்
ஈ. ஈத்தேன்
[விடை: அ) புரப்பீன்]
தீர்வு:
எத்திலீனில் உள்ள கார்பனின் சதவீதம் (C2H4)

= (கார்பனின் நிறை/ மோலார் நிறை) × 100
= (24/28) × 100 = 85.71%
= (36/42) × 100 = 85.71%
புரப்பீனில் உள்ள கார்பனின் சதவீதம் (C3H6 )
24. கார்பன் - 12 பொறுத்து பின்வருவனவற்றுள் எது உண்மையான கூற்று?
அ. C - 12 ன் ஒப்பு அணுநிறை 12 u
ஆ. கார்பனின் அனைத்து சேர்மங்களிலும் அதன் ஆக்ஸிஜனேற்ற எண் +4
இ. 1 மோல் கார்பன் - 12 ல் 6.022 × 1022 அணுக்கள் உள்ளன.
ஈ. அனைத்தும்
[விடை: அ) C −12 ன் ஒப்பு அணுநிறை 12 u ]
25. அணுநிறைக்கு நியமமாக பின்வருவனவற்றுள் பயன்படுவது எது?
அ. 6C12
ஆ. 7C12
இ. 6C13
ஈ. 6C14
[விடை: அ) 6C12 ]