11 வது வேதியியல் : அலகு 1 : வேதியியலின் அடிப்படைக் கருத்துக்கள் மற்றும் வேதிக் கணக்கீடுகள்
மோல் பற்றிய கோட்பாடு
மோல் பற்றிய கோட்பாடு
பொருட்களின் அளவினைக் குறிப்பிட, நம் வசதிக்கேற்ப டஜன், குயர் போன்ற சிறப்புப் பெயர்களை வழக்கத்தில் பயன்படுத்தி வருகிறோம். எடுத்துக்காட்டாக, ஒரு டஜன் ரோஜாக்கள் என்பது 12 ரோஜா பூக்களையும், ஒரு குயர் பேப்பர் என்பது 24 எண்ணிக்கை கொண்ட தாள்களையும் குறிப்பிடுகிறது.
இந்த ஒப்புமையினை பயன்படுத்தி வேதியியலில் அணு மற்றும் மூலக்கூறுகளின் அளவினை வரையறுக்கப் பயன்படும் மோல் பற்றிய கோட்பாட்டினை நாம் புரிந்து கொள்ளலாம். பொருளின் அளவினை குறிக்க SI அலகு முறையில் பயன்படுத்தப்படும் அடிப்படை அலகு 'மோல்' ஆகும்.
மோல் பற்றிய கோட்பாட்டினைப் புரிந்து கொள்வதற்கு, 12g கார்பன்-12 ஐசோடோப்பில் காணப்படும் அணுக்களின் எண்ணிக்கை, 158.03g பொட்டாசியம் பெர்மாங்கனேட் மற்றும் 294.18g பொட்டாசியம் டைகுரோமேட்டில் காணப்படும் மூலக்கூறுகளின் எண்ணிக்கையினை நாம் கணக்கிடுவோம்.

அட்டவணை 1.2. ஒரு மோல் பொருளில் காணப்படும் உட்பொருட்களின் எண்ணிக்கையினைக் கணக்கிடுதல்.
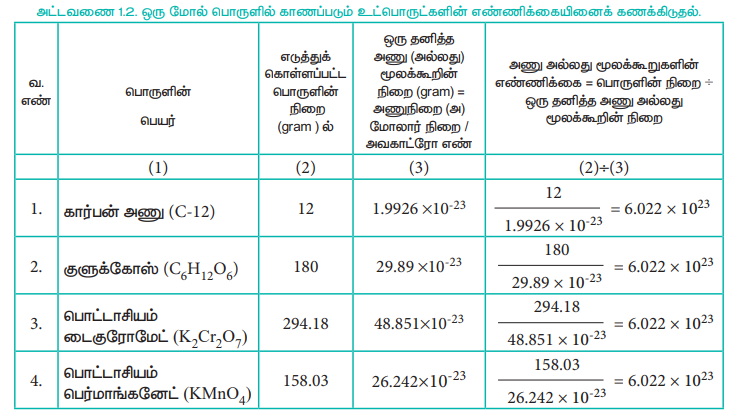
மேற்கண்டுள்ள கணக்கீடுகளிலிருந்து, 12g C-12 ஆனது 6.022 × 1023 கார்பன் அணுக்களைக் கொண்டுள்ளது என்பதனை நாம் அறிந்து கொள்கிறோம். மேலும் 158.03g பொட்டாசியம் பெர்மாங்கனேட் மற்றும் 294.18g பொட்டாசியம் டைகுரோமேட் ஆகியவையும் இதே எண்ணிக்கையிலான மூலக்கூறுகளைக் கொண்டுள்ளன. ஒரு டஜன் என்பது 12 உட்பொருட்களை கொண்டது என குறிப்பிட்டவாறு, 6.022 × 1023 உட்பொருட்களை (அணுக்கள் (அ) மூலக்கூறுகள் (அ) அயனிகள்) கொண்ட பொருளின் அளவைக் குறிப்பிட நாம் மோல் எனும் அலகைப் பயன்படுத்தலாம்.
12g கார்பன்-12 ஐசோடோப்பில் காணப்படும் கார்பன் அணுக்களின் எண்ணிக்கைக்குச் சமமான அடிப்படைத் துகள்களைப் பெற்றுள்ள ஒரு அமைப்பில் உள்ள பொருளின் அளவு ஒரு மோல் எனப்படும். அடிப்படை துகள் என்பது மூலக்கூறுகள், அணுக்கள், அயனிகள், எலக்ட்ரான்கள் அல்லது ஏதேனும் ஒரு வரையறுக்கப்பட்ட துகளைக் குறிப்பிடுகிறது.
உங்களுக்குத் தெரியுமா?
இரைப்பை அமிலம் மற்றும் அமில நீக்கிகள்
அமிலத்தன்மை மற்றும் நெஞ்செரிச்சலை குணப்படுத்த பொதுவாக அமிலநீக்கிகள் மருந்தாக பயன்படுத்தப்படுகிறது. இதன் வேதியியல் உங்களுக்குத் தெரியுமா?
இரைப்பை அமிலம் என்பது வயிற்றில் சுரக்கும் சீரணத்திரவம் ஆகும். இதில், ஹைட்ரோகுளோரிக் அமிலம் உள்ளது. இரைப்பை அமிலத்தில் உள்ள ஹைட்ரோகுளோரிக் அமிலத்தின் செறிவு பொதுவாக 0.082M என்ற அளவில் இருக்கும். இந்த அமிலத்தின் செறிவு 0.1M என்ற அளவை விட அதிகமாகும் போது அமிலத்தன்மை மற்றும் நெஞ்செரிச்சல் ஏற்படுகிறது.
அமிலத்தன்மையினைக் குணப்படுத்த பயன்படுத்தப்படும் அமிலநீக்கிகள் பெரும்பாலானவற்றில் மெக்னீசியம் ஹைட்ராக்ஸைடு மற்றும் அலுமினியம் ஹைட்ராக்ஸைடு அடங்கியுள்ளது. இவை அதிகப்படியான அமிலத்தை நடுநிலையாக்குகிறது. வேதிவினைகள் பின்வருமாறு
3 HCl + Al(OH)3 → AlCl3 + 3 H2O
2 HCl + Mg(OH)2 → MgCl2 + 2 H2O
மேற்கண்டுள்ள வினைகளிலிருந்து, 1 மோல் அலுமினியம் ஹைட்ராக்ஸைடு 3 மோல் HCl ஐயும், 1 மோல் மெக்னீசியம் ஹைட்ராக்ஸைடு 2 மோல் HCl ஐயும் நடுநிலையாக்குகிறது என நாம் அறிகிறோம். 250mg அலுமினியம் ஹைட்ராக்ஸைடு மற்றும் 250mg மெக்னீசியம் ஹைட்ராக்ஸைடை கொண்டுள்ள ஒரு அமில நீக்கியால் நடுநிலையாக்கப்படும், அமிலத்தின் அளவினை நாம் கணக்கிடுவோம்.
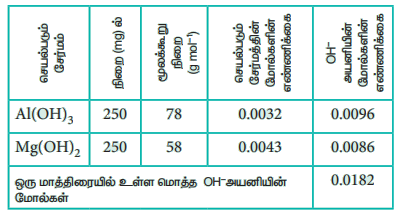
ஒருவருடைய வயிற்றில் 0.1 மோல் அமிலக்கூறைக் கொண்டுள்ள இரைப்பை திரவம் இருப்பின், மேற்கண்டுள்ள இயைபினைப் பெற்றுள்ள ஒரு மாத்திரை ஆனது 0.0182. மோல் HClஐ நடுநிலையாக்கும். அதாவது, ஒரு மாத்திரையானது, அதிகப்படியாக உள்ள அமிலத்தினை நடுநிலையாக்கி ( 0.1 - 0.018 M = 0.082 M) வழக்கமான அமில நிலைக்கு மீள கொண்டு வரும்.
1. அவகாட்ரோ எண்
ஒரு மோல் அளவுடைய எந்தவொரு சேர்மத்திலும் காணப்படும் உட்பொருட்களின் எண்ணிக்கை 6.022 × 1023 க்கு சமமாகும். இந்த எண் அவகாட்ரோ எண் என அழைக்கப்படுகிறது. இத்தாலிய இயற்பியல் அறிஞர் அமிடோ அவகாட்ரோ என்பவரது பெயரால் இந்த எண் அழைக்கப்படுகிறது. ஒத்த வெப்பநிலை மற்றும் அழுத்த நிலையில், சம கன அளவுள்ள எல்லா வாயுக்களும், சம எண்ணிக்கையிலான மூலக்கூறுகளை பெற்றிருக்கும் என அவகாட்ரோ முன் மொழிந்தார். அவகாட்ரோ எண்ணிற்கு அலகு இல்லை.
ஒரு வேதிவினையில் அணுக்கள் அல்லது மூலக்கூறுகள் ஒரு குறிப்பிட்ட விகிதத்தில் வினைபுரிகின்றன. பின்வரும் எடுத்துக்காட்டுகளை நாம் கருதுவோம்.
வினை 1: C + O2 → CO2
வினை 2: CH4 + 2 O2 → CO2 + 2 H2O
முதல் வினையில், ஒரு கார்பன் அணு, ஒரு ஆக்சிஜன் மூலக்கூறுடன் வினைபுரிந்து ஒரு கார்பன் டை ஆக்ஸைடு மூலக்கூறினைத் தருகிறது. இரண்டாம் வினையில் ஒரு மூலக்கூறு மீத்தேன், இரு மூலக்கூறு ஆக்சிஜனில் எரிந்து ஒரு மூலக்கூறு கார்பன் டை ஆக்ஸைடையும் இரு மூலக்கூறு நீரையும் தருகிறது.
இதிலிருந்து வினையில் ஈடுபடும் வினைபொருட்களுக்கு இடையேயான விகிதம் மூலக்கூறுகளின் எண்ணிக்கையின் அடிப்படையில் அமைகிறது என்பது தெளிவாகிறது. இருந்தபோதிலும், ஒரு வேதிவினையில் ஈடுபடும் தனித்த மூலக்கூறுகளின் எண்ணிக்கையினைக் கணக்கிடுவது என்பது நடைமுறையில் கடினமான ஒன்றாகும். எனவே, வேதிவினையில் ஈடுபடும் வினைப்பொருட்களின் அளவினை மூலக்கூறுகளின் எண்ணிக்கையில் குறிப்பிடுவதைக்காட்டிலும் மோல் அடிப்படையில் குறிப்பிடுவது பயனுள்ளதாக அமையும். முதல் வினையினை, ஒரு மோல் கார்பன், ஒரு மோல் ஆக்சிஜனுடன் வினைபுரிந்து ஒரு மோல் கார்பன் டை ஆக்ஸைடை தருகிறது எனவும், இரண்டாவது வினையினை, ஒரு மோல் மீத்தேன், இரண்டு மோல் ஆக்சிஜனில் எரிந்து, இரண்டு மோல் நீர் மற்றும் ஒரு மோல் கார்பன் டை ஆக்ஸைடை தருகிறது எனவும் நாம் விளக்கலாம். அணுக்கள் மட்டுமே இடம்பெறும் நிலையில், அறிவியல் அறிஞர்கள் ஒரு மோல் என்ற வார்த்தைக்கு பதிலாக ஒரு கிராம் அணு என்ற வார்த்தையினையும் பயன்படுத்துவார்கள்.
லாரன்ஸோ ரோமானோ அமிடியோ கார்லோ அவகாட்ரோ (1776-1856)

அவகாட்ரோ கருதுகோளை வழங்கியவர். இவருடைய பங்களிப்பினை நினைவுகூறும் வகையில், ஒரு மோல் பொருளில் அடங்கியுள்ள அடிப்படை துகள்களின் எண்ணிக்கையை குறிப்பிடும் எண் அவகாட்ரோ எண் என அழைக்கப்படுகிறது. சம கன அளவுள்ள வாயுக்களில் காணப்படும் துகள்களின் எண்ணிக்கையினை இவர் தெரிவிக்கவில்லை. எனினும், இவரது கருதுகோள் 6.022 × 1023 என்ற எண்ணைக் கண்டறிய அடிப்படையாக அமைந்தது. ருடால்ப் கிளாசியஸ் தனது வாயுக்களின் இயக்கவியற் கொள்கையின் மூலம் அவகாட்ரோ விதிக்கான ஆதாரத்தினை வழங்கினார்.
2. மோலார் நிறை
1 மோல் அளவுள்ள ஒரு பொருளின் நிறையானது அதன் மோலார் நிறை என வரையறுக்கப்படுகிறது. ஒரு சேர்மத்தின் மோலார் நிறை என்பது அதில் அடங்கியுள்ள தனிமங்களின் ஒப்பு அணு நிறைகளின் கூடுதல் மதிப்பை g mol-1 என்ற அலகில் குறிப்பிடுவதாகும்.
எடுத்துக்காட்டு
ஒரு ஹைட்ரஜன் அணுவின் ஒப்பு அணு நிறை = 1.008 u
ஒரு ஹைட்ரஜன் அணுவின் மோலார் நிறை = 1.008 g mol-1
குளுக்கோசின் ஒப்பு மூலக்கூறு நிறை = 180u
குளுக்கோசின் மோலார் நிறை = 180 g mol-1
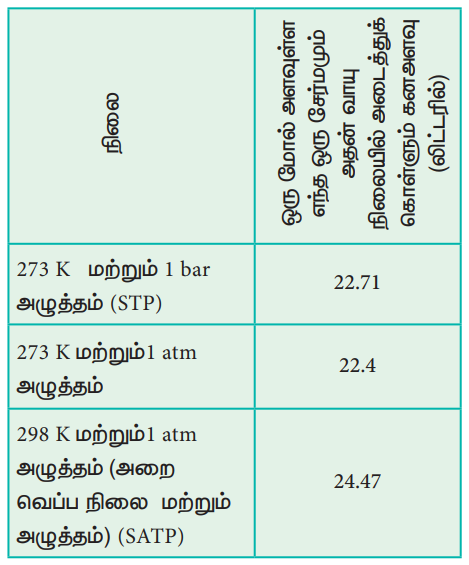
3. மோலார் கனஅளவு:
ஒரு குறிப்பிட்ட வெப்பநிலை மற்றும் அழுத்த நிலையில், ஒரு மோல் சேர்மம் அதன் வாயு நிலையில் அடைத்துக்கொள்ளும் கனஅளவு, மோலார் கனஅளவு எனப்படும்.
தன்மதிப்பீடு
3அ) 9 கிராம் ஈத்தேனில் காணப்படும் மோல்களின் எண்ணிக்கையைக் கணக்கிடுக.
தீர்வு:
அ) ஈத்தேனின் மோலார் நிறை C2H6
= (2 × 12) + (6 × 1) = 30g mol−1
n = நிறை / மோலார் நிறை
= 9g/ 30gmol−1 = 0.3mol
3 ஆ) 273K மற்றும் 3atm அழுத்த நிலையில், 224mL கன அளவினை அடைத்துக்கொள்ளும் ஆக்சிஜன் வாயுவில் காணப்படும் ஆக்சிஜன் மூலக்கூறுகளின் எண்ணிக்கையினைக் கணக்கிடுக.
தீர்வு:
ஆ) 273K மற்றும் 1atm அழுத்தத்தில் 1 மோல் வாயு அடைத்துக் கொள்ளும் கனஅளவு 22.4L. எனவே 273K மற்றும் 3 atm அழுத்தத்தில் 224ml கனஅளவை அடைத்துக் கொள்ளும் ஆக்ஸிஜனின் மோல்களின் எண்ணிக்கை
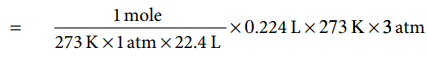
= 0.03 mole
1 மோல் ஆக்ஸிஜனில் 6.022 × 1023 மூலக்கூறுகள் உள்ளன. 0.03 மோல் ஆக்ஸிஜனில்
= 6.022 × 1023 × 0.03
= 1.807 × 1022 ஆக்ஸிஜன் மூலக்கூறுகள் உள்ளன.