11 வது வேதியியல் : அலகு 13 : ஹைட்ரோகார்பன்கள்
பென்சீனின் வேதிப் பண்புகள்
வேதிப் பண்புகள் :
1. பென்சீன் உள்ளடங்கா π எலக்ட்ரான்களைப் பெற்றிருப்பதால் அதன் வளையமானது அதிக எலக்ட்ரான் அடர்வு கொண்ட மையமாக விளங்குகின்றது. எனவே பென்சீனில் எலக்ட்ரான் கவர்பொருள் பதிலீட்டு வினைகள் நடைபெறுகின்றன.
2. பென்சீனானது உள்ளடங்கா π எலக்ட்ரான்களால் நிலைப்புத் தன்மையைப் பெறுகிறது. இது அதிக நிலைப்புத் தன்மையினைப் பெற்றிருப்பினும் குறிப்பிட்ட நிபந்தனைகளில் சேர்க்கை வினை மற்றும் ஆக்சிஜனேற்ற வினைகளுக்கு உட்படுகின்றன.
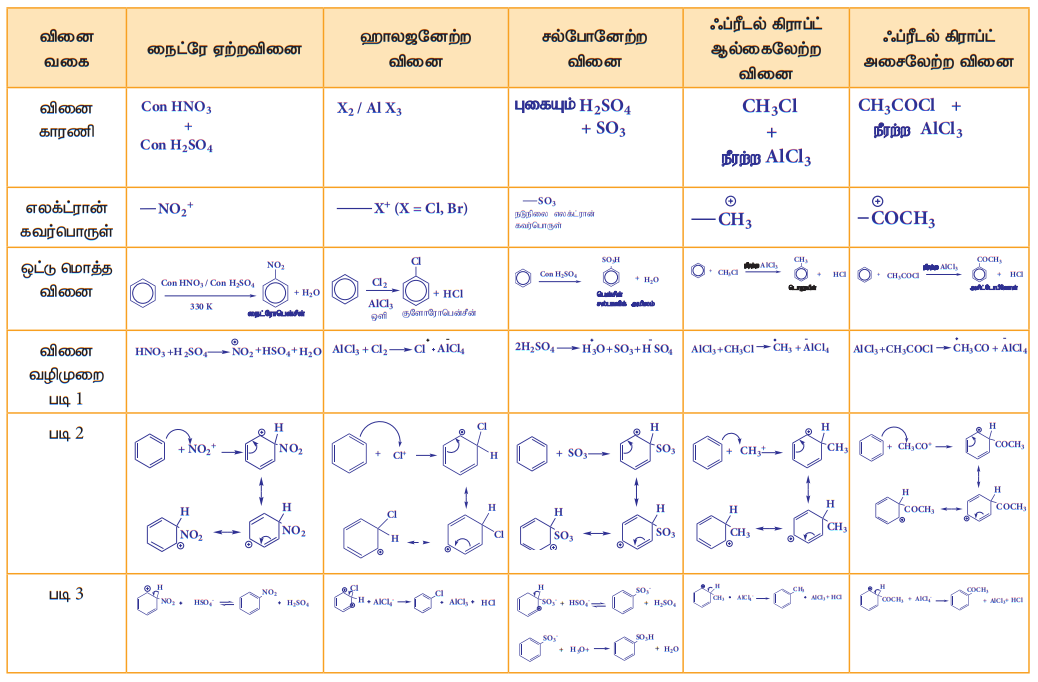
1. எலக்ட்ரான் கவர்பொருள் பதிலீட்டு வினைகள்
(அ) நைட்ரோ ஏற்றம்:
பென்சீனை 330K வெப்பநிலையில் (அடர் HNO3 மற்றும் அடர் H2SO4) அடங்கிய நைட்ரோ ஏற்ற கலவையுடன் வெப்பப்படுத்தும் போது பென்சீனில் உள்ள ஹைட்ரஜன் நைட்ரோனியம் அயனியால் NO2+ ஆல் பதிலீடு செய்யபட்டு நைட்ரோ பென்சீன் உருவாகிறது.
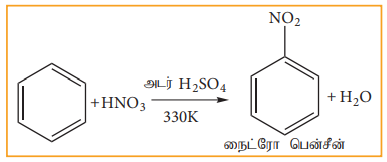
அடர் H2SO4 நைட்ரோனியம் (NO2+) அயனியை உருவாக்குவதற்காக சேர்க்கப்படுகிறது.
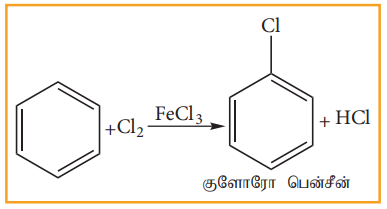
(ஆ) ஹேலஜனேற்றம்:
லூயி அமிலங்களான FeCl3, FeBr3 அல்லது AlCl3 ஆகியவற்றின் முன்னிலையில் பென்சீன் ஹேலஜனுடன் (X2 = Cl2, Br2,) வினைபுரிந்து இணையான ஹேலோ பென்சீனைத் தருகின்றது. வினையூக்கி இல்லாத நிலையில் புளூரின் வீரியத்துடன் வினைபுரிகிறது. எனினும் வினையூக்கி இருப்பினும் அயோடின் வினைத்திறன் அற்றது.
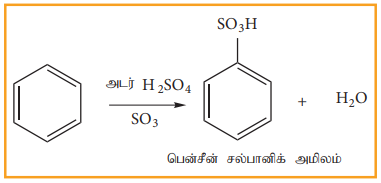
(இ) சல்போனேற்றம் :
புகையும் கந்தக அமிலத்துடன் அடர் H2SO4 + SO3 பென்சீன் வினைபட்டு, பென்சீன் சல்பானிக் அமிலத்தைத் தருகிறது. இங்கு எலட்ரான் கவர் காரணியான SO3 ஒரு நடுநிலை மூலக்கூறாகும். இதில் நேர்மின் சுமை இல்லாத போதிலும், இது ஒரு வலிமையான எலக்ட்ரான் கவர் பொருளாகும். ஏனெனில் சல்பர் அணுவைச் சுற்றி எண்ம எலட்ரான்கள் அமைப்பு இல்லை. இவ்வினை ஒரு மீள்வினையாகும் மேலும் நீரிய ஊடகத்தில் சல்போ நீக்கம் உடனடியாக நடைபெறும்.
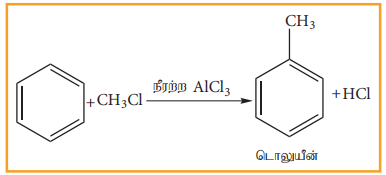
ஈ) பிரீடல் -கிராப்ட் ஆல்கைலேற்றம் (மெத்திலேற்றம்) :
பென்சீனை ஒரு ஆல்கைல் ஹேலைடுடன் நீரற்ற AlCl3 முன்னிலையில் வினைப்படுத்தும் போது ஆல்கைல் பென்சீன் உருவாகிறது.
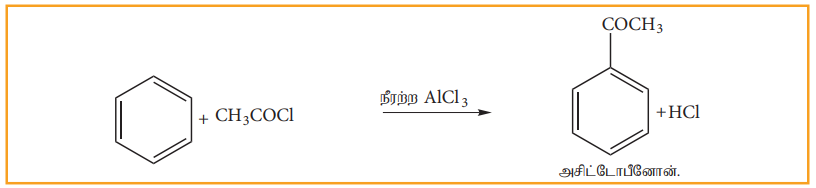
உ) பிரீடல் - கிராப்ட் (அசிட்டைலேற்றம்)
பென்சீனை அசிட்டைல் குளோரைடுடன் நீரற்ற AlCl3 முன்னிலையில் வினைப்படுத்தும் போது அசிட்டைல் பென்சீன் உருவாகிறது.
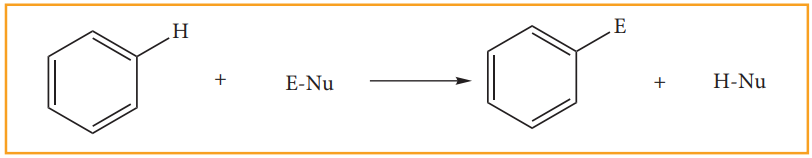
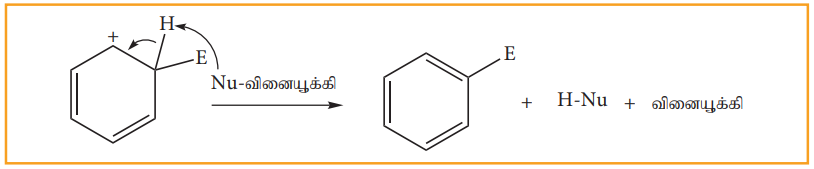
(ஊ) எலக்ட்ரான் கவர்பொருள் பதிலீட்டு வினை :
பென்சீன் உள்ளடங்கா π - எலக்ட்ரான்களைப் பெற்றிருப்பதால் எலக்ரான் அடர்வு மையமாக செயல்படுகிறது எனவே இது எலக்ட்ரான் கவர்பொருள் பதிலீட்டு வினைக்கு உட்படுகின்றது
வினை வழிமுறை,
படி 1: எலக்ட்ரான் கவர்பொருள் உருவாதல்
E-Nu + வினையூக்கி → E+ + Nu-வினையூக்கி

படி 2: எலக்ட்ரான் கவர்பொருள் அரோமேட்டிக் வளையத்தினை தாக்குவதால் கார்பன் நேர் அயனி இடைநிலை உருவாகிறது இது உடனிசைவால் நிலைப்புத்தன்மையினைப் பெறுகின்றது
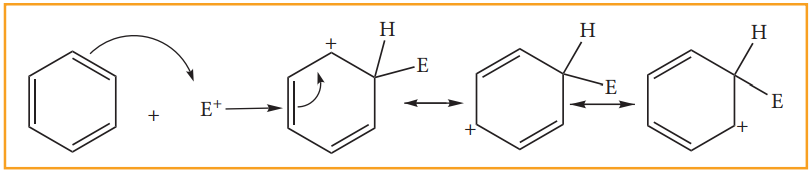
படி 3: புரோட்டான் இழக்கப்பட்டு பதிலீட்டு விளைபொருள் கிடைக்கிறது.
(ii) சேர்க்கை வினை
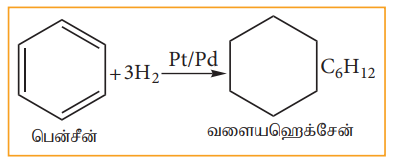
அ) பென்சீனின் ஹைட்ரஜனேற்றம்
பிளாட்டினம் அல்லது பெல்லேடியம் முன்னிலையில் பென்சீன், ஹைட்ரஜனுடன் இணைந்து வளையஹெக்சேனைத் தருகிறது. இதுவே ஹைட்ரஜனேற்றம் எனப்படும்.
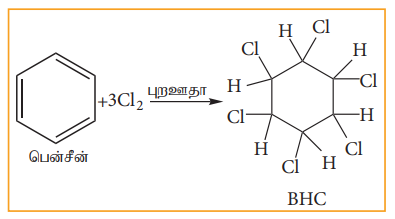
ஆ) பென்சினின் குளோரினேற்றம்
சூரிய ஒளி அல்லது புற ஊதா ஒளி முன்னிலையில், பென்சீன், மூன்று Cl2 மூலக்கூறுகள் உடன் வினைப்பட்டு பென்சீன் ஹெக்சா குளோரைடை (BHC) C6H6Cl6 தருகின்றது. இது கேமக்சேன் அல்லது லிண்டேன் என அழைக்கப்படுகின்றது. இது ஒரு சிறந்த பூச்சிகொல்லி மருந்தாகும்.
இ) ஆக்சிஜனேற்றம்
அ) ஆவி - நிலை ஆக்சிஜனேற்றம்
பென்சீன் வலிமை மிகு ஆக்சிஜனேற்றியுடன் வினைபுரியாமல் நிலைப்புத்தன்மை உடையதாக உள்ளது ஆனால் 773K வெப்பநிலையில், V2O5 முன்னிலையில், பென்சீனின் வாயுவை ஆக்சிஜனுடன் கலந்து செலுத்தும் போது ஆவி-நிலை ஆக்சிஜனேற்றம் அடைகின்றது. இங்கு வளையம் உடைபட்டு மெலியிக் அமில நீரிலி உருவாகின்றது.
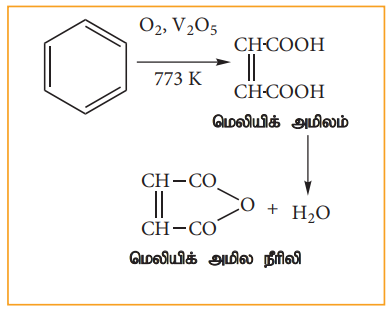
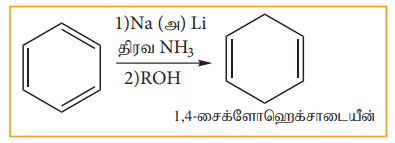
ஆ) பிர்க் ஒடுக்கம்
பென்சீனை நீர்ம அம்மோனியா அல்லது அல்கஹாலில் உள்ள Na அல்லது Li ஐக் கொண்டு ஒடுக்கும் போது 1,4- சைக்ளோஹெக்ஸாடையீன் உருவாகின்றது. இம்முறை வளைய டையீன் எளிதில் தயாரிக்கப் பயன்படுகிறது.