11 வது வேதியியல் : அலகு 5 : கார மற்றும் காரமண் உலோகங்கள்
கார உலோகங்களின் வேதிப் பண்புகள்
கார உலோகங்களின் வேதிப் பண்புகள்
கார உலோகங்கள் அதிக வினைதிறனைக் கொண்டுள்ளன. கார உலோகங்களின் இந்த வினைதிறன் Li லிருந்து Cs வரை அதிகரிக்கிறது. ஏனெனில் தொகுதியில் மேலிருந்து கீழாக அயனியாக்கும் ஆற்றல் குறைகிறது. அனைத்து கார உலோகங்களும், அதிக எலக்ட்ரான் கவர் தன்மை கொண்ட தனிமங்களான ஆக்சிஜன் மற்றும் ஹேலஜன்களுடன் மிக அதிக வீரியத்துடன் வினைபுரிகின்றன. கார உலோகங்களின் சில குறிப்பிடத்தகுந்த பண்புகள் கீழே விளக்கப்பட்டுள்ளன.
ஆக்ஸிஜனுடன் வினை
அனைத்து கார உலோகங்களும் காற்று அல்லது ஆக்சிஜனில் தீவிரமாக எரிந்து அவற்றின் புறப்பரப்பில் ஆக்சைடுகளை உருவாக்குகின்றன. லித்தியம் மோனாக்சைடை மட்டுமே உருவாக்குகிறது. சோடியம் மோனாக்சைடு மற்றும் பெராக்சைடை உருவாக்குகிறது. மற்ற தனிமங்கள் மோனாக்சைடு, பெராக்சைடு மற்றும் சூப்பர் ஆக்சைடுகளை உருவாக்குகின்றன. இந்த ஆக்சைடுகள் இயற்கையாகவே காரத்தன்மையைப் பெற்றுள்ளன.
4 Li + O2 → 2 Li2O (மோனாக்சைடு)
2 Na + O2 → Na2O2 (பெராக்சைடு)
M + O2 → MO2 (சூப்பர் ஆக்சைடு)
(M = K, Rb, Cs)
ஹைட்ரஜனுடன் வினை
அனைத்து கார உலோகங்களும் ஹைட்ரஜனுடன் சுமார் 673 K ( லித்தியம் 1073K வெப்பநிலையில்) வெப்பநிலையில் ஹைட்ரஜனுடன் வினைபுரிந்து அவற்றின் அயனி ஹைட்ரைடுகளை உருவாக்குகின்றன. ஹைட்ரஜனுடன் வினைபுரியும் திறன் கார உலோகங்களில், Li லிருந்து Cs வரை செல்லச் செல்ல குறைகிறது.
2M + H2 → 2 M+H-
(M = Li, Na, K, Rb, Cs)
ஹைட்ரைடுகளின் அயனிப்பண்பு Li லிருந்து Cs வரை செல்லச்செல்ல அதிகரிக்கிறது. மேலும் அவற்றின் நிலைப்புத்தன்மை குறைகிறது. இந்த ஹைட்ரைடுகள் சிறந்த ஒடுக்கும் வினைபொருட்களாக செயல் புரிகின்றன, மேலும் அவற்றின் ஒடுக்கும் தன்மை தொகுதியில் மேலிருந்து கீழாக அதிகரிக்கிறது.
ஹேலஜன்களுடன் வினை
கார உலோகங்கள் ஹேலஜன்களுடன் உடனடியாக வினைபுரிந்து MX என்ற அயனி ஹேலைடுகளைத் தருகின்றன. ஹேலஜன்களுடன் வினைபுரியும் திறன் கார உலோக தொகுதியில் மேலிருந்து கீழாக அதிகரிக்கிறது. ஏனெனில் அவற்றின் அயனியாக்கும் ஆற்றல் குறைகிறது.
2M + X2 → 2 MX
(M = Li, Na, K, Rb, Cs) (X = F, Cl, Br, I)
அனைத்து உலோக ஹேலைடுகளும் அயனிப் படிகங்கள் ஆகும். எனினும் லித்தியம் அயோடைடு, சகப்பிணைப்புப் பண்பை காட்டுகிறது. இதற்குக் காரணம் மிகச்சிறிய நேர்மின் அயனியானது எதிர்மின் அயனியை அதிக முனைவுறுத்தும் திறனை பெற்றுள்ளது. கூடுதலாக அயோடைடு அயனி மிகப்பெரியதாக இருப்பதால், Li+ அயனியால் மிக அதிக அளவிற்கு முனைவுறுத்தப்பட முடியும்.
திரவ அம்மோனியாவுடன் வினை
கார உலோகங்கள் திரவ அம்மோனியாவில் கரைந்து அடர் நீல நிறக் கரைசல்களைத் தருகின்றன. இந்தக் கரைசல்கள் மின்கடத்தும் தன்மை கொண்டவை. இவற்றின் கடத்துத்திறன் தூய உலோகங்களைப் போலவே உள்ளது (Hg ன் நியம கடத்துத்திறன் 104 Ω-1 திரவ அம்மோனியாவில் உள்ள சோடியத்தின் கடத்துத்திறன் 0.5 × 104 Ω-1). திரவ அம்மோனியாவில் கார உலோக அணுக்கள் தங்களின் இணைதிறன் எலக்ட்ரான்களை இழப்பதே இதற்குக் காரணம். நேர்மின் அயனி மற்றும் எலக்ட்ரான் இரண்டும் அம்மோனியா ஏற்றம் அடைந்து, அம்மோனியா ஏறிய நேரயனி மற்றும் அம்மோனியா ஏறிய எலக்ட்ரான் ஆகியவற்றைத் தருகின்றன.
M + (x + y) NH3 → [ M (NH3)x ]+ + [ e (NH3)y ]-
கரைசல் நீல நிறமாக இருப்பதற்கான காரணம், அம்மோனியா ஏறிய எலக்ட்ரான் கட்புலனாகும் ஒளி ஆற்றலை உறிஞ்சுகிறது, ஆதலால் கரைசலுக்கு நீல நிறத்தை அளிக்கிறது. இந்த கரைசல்கள் பாரா காந்தத் தன்மை கொண்டவை, மேலும் நீண்ட நேரம் வைக்கப்பட்டால் மெதுவாக ஹைட்ரஜன் வாயுவை வெளியேற்றி அமைடை உருவாக்குகின்றன.
M+ + e- + NH3 → MNH2 + 1/2 H2
அடர் கரைசல்களில் நீல நிறமானது வெண்கல நிறத்திற்கு மாறுவதுடன், கரைசல் டையா காந்தத் தன்மை கொண்டதாக மாறுகிறது.
நீருடன் வினை
கார உலோகங்கள் நீருடன் வினைப்பட்டு அவற்றின் ஹைட்ராக்சைடுகளைத் தருகின்றன. இதனுடன் ஹைட்ரஜன் வாயு வெளியேற்றப்படுகிறது.
2 Li + 2 H2O → 2 LiOH + H2
அவை மேலும் ஆல்கஹால் மற்றும் வினைதிறன் மிக்க ஹைட்ரஜன்களைக் கொண்ட ஆல்கைன்களுடன் வினைபுரிகின்றன.
2 Na + 2 C2H5OH → 2 C2H5ONa + H2
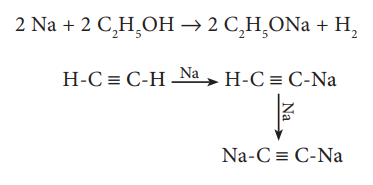
ஒடுக்கும் செயல்
கார உலோகங்கள், தங்களின் இணைதிறன் எலக்ட்ரான்களை எளிதில் இழக்க முடியும், இதனால் அவை சிறந்த ஒடுக்கும் வினைபொருட்களாகச் செயல்படுகின்றன.
M(s) → M+(g) + e-
கார்பனுடன் வினை
லித்தியம் நேரடியாக கார்பனுடன் வினைப்பட்டு லித்தியம் கார்பைடு என்ற அயனிச்சேர்மத்தை உருவாக்குகிறது. மற்ற உலோகங்கள் கார்பனுடன் நேரடியாக வினைபுரிவதில்லை. எனினும், அவற்றை அசிட்டிலீன் போன்ற கரிம சேர்மங்களுடன் வினைப்படுத்தும்போது, அவை அசிட்டிலைடுகளை உருவாக்குகின்றன.
2 Li + 2C → Li2C2