11 வது வேதியியல் : அலகு 13 : ஹைட்ரோகார்பன்கள்
ஆல்கீன்களின் வேதிப்பண்புகள்
ஆல்கீன்களின் வேதிப்பண்புகள்:
இரட்டைப் பிணைப்பை பெற்றிருப்பதால், ஆல்கேன்களை காட்டிலும், ஆல்கீன்கள் வினைத்திறன் மிக்கவை. ஏனெனில் σ-பிணைப்பு வலிமை மிகுந்தும், π பிணைப்பு வலிமை குறைந்தும் இருக்கும். ஆல்கீன்களின் தனித்த முக்கியமான வினையானது அயனி வினை வழிமுறையினைப் பின்பற்றி இரட்டை பிணைப்பின் குறுக்கே நிகழும் எலக்ட்ரான் கவர்பொருள் சேர்க்கை வினையை உள்ளடக்கியது. எனினும், இச்சேர்க்கை வினையானது தனி-உறுப்பு வினைவழிமுறை மூலமாகவும் நடைபெறலாம். ஓசோனேற்றம் மற்றும் பலபடியாக்கல் போன்ற வினைகள், ஆல்கீன்களின் தனித்துவமிக்க வினைகளாகும்.
சேர்க்கை வினைகள்
(i) ஹைட்ரஜன் சேர்க்கை வினை (ஆல்கீன்களின் ஹைட்ரஜனேற்றம்)
உலோக வினையூக்கி முன்னிலையில் (Ni, Pd or Pt) ஆல்கீன்களில் ஹைட்ரஜன் சேர்க்கை நடைபெற்று இணையான ஆல்கேன்கள் உருவாகின்றன. இவ்வினை வினையூக்கி முன்னிலையில் நிகழும் ஹைட்ரஜனேற்றம் எனப்படும். இம்முறையானது தாவர எண்ணையிலிருந்து வனஸ்பதி உற்பத்தி செய்யும் செயல்முறையில் முக்கிய பங்கினை வகிக்கின்றது. தாவர எண்ணெய் கெட்டுப்போகாமல் தடுப்பதற்கு இது உதவுகின்றது.
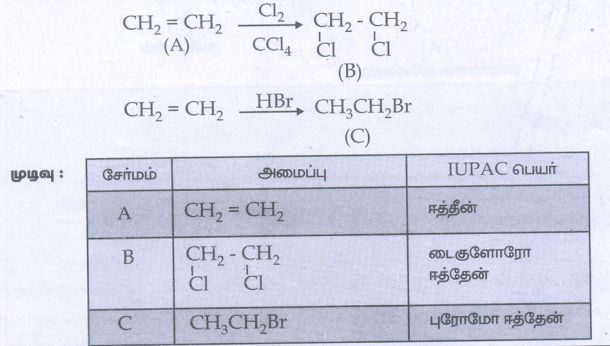
(ii) ஹாலஜன்களை சேர்த்தல்: (ஆல்கீன்களின் ஹாலஜனேற்றம்)
ஹாலஜன்களான குளோரின் அல்லது புரோமின், ஆல்கீன்களுடன் மிகவிரைவாக சேர்க்கை வினைக்கு உட்டுபட்டு, 1,2-டை ஹேலோ ஆல்கேன்கள் அல்லது விசினல் டைஹாலைடுகளைத் தருகின்றன.
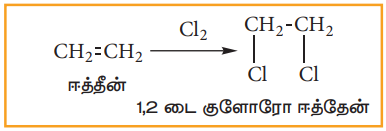
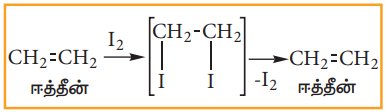
அயோடின் மிக மெதுவாக வினைபட்டு, நிலைப்புத்தன்மையற்ற 1,2-டை அயோடோ ஆல்கேனைத் தருகின்றது. இது நிலைப்புத் தன்மையற்றதால் நீக்க வினைக்கு உட்பட்டு மீண்டும் ஆல்கீனைத் தருகின்றது.
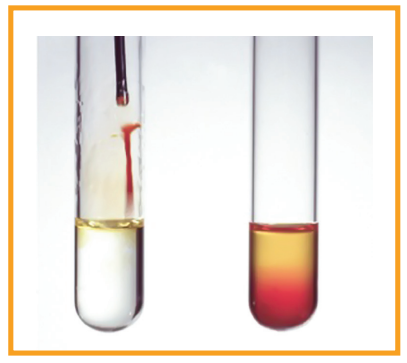
ஆல்கீன்களுக்கான சோதனை:
புரோமின் நீர் செம்பழுப்பு நிறத்தை உடையது. ஆல்கின்களுடன் சிறிதளவு புரோமின் நீர் சேர்க்கப்படும்போது, டைபுரோமோ சேர்மம் உருவாவதால் கரைசல் நிறமற்றதாகிறது. இது நிறைவுறா சேர்மங்களுக்கான முக்கியமான சோதனையாகும்.
மார்கோனிகாஃப் விதி:
“ஓர் சீர்மையற்ற ஆல்கீனுடன் ஹைட்ரஜன் ஹாலைடு வினைபுரியும் போது, அதிலுள்ள ஹைட்ரஜனானது, அதிக ஹைட்ரஜன் அணுக்களை உடைய கார்பனிடமும் ஹாலஜனானது, குறைந்த ஹைட்ரஜன் அணுக்களை உடைய கார்பனிடமும் சேர்க்கின்றன. இவ்விதியை பின்வருமாறும் கூறலாம்.
ஆல்கீன் மற்றும் மற்றும் ஆல்கைன்களின் சேர்க்கை வினைகளில், வினைக்காரணியின் அதிக எலக்ட்ரான் கவர்தன்மை உடைய பகுதியானது இரட்டைப் பிணைப்பால் பிணைக்கப்பட்டுள்ள கார்பன்களில் குறைவான ஹைட்ரஜனைக் கொண்டுள்ள கார்பனில் சென்று சேரும்.
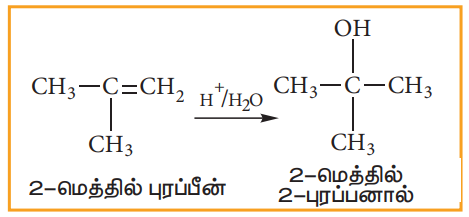
(iii) நீரினை சேர்த்தல்: [ஆல்கீன்களின் நீரேற்ற வினை]
பொதுவாக, ஆல்கீன்கள் நீருடன் வினைபுரிவதில்லை. அடர் கந்தக அமில முன்னிலையில், ஆல்கீன்கள் நீருடன் வினைபட்டு ஆல்கஹாலைத் தருகின்றன. இவ்வினையானது கார்பன் நேர் அயனி வினைவழிமுறை மற்றும் மார்கோனிகாஃப் விதியினை பின்பற்றுகின்றது.
(iv) ஹைட்ரோ ஹாலைடுகளைச் சேர்த்தல் (ஆல்கீன்களின் ஹைட்ரோ ஹாலஜனேற்றம்)
ஆல்கீன்களுடன் ஹைட்ரஜன் ஹாலைடுகள் (HCl, HBr மற்றும் HI) சேர்க்கை வினைக்கு உட்பட்டு ஆல்கைல் ஹாலைடுகளைத் தருகின்றன. ஹைட்ரஜன் ஹாலைடுகளின் வினைத்திறனானது HI > HBr > HCl > HF என அமைகின்றது. இவ்வினையானது எலக்ட்ரான் கவர்பொருள் சேர்க்கை வினைக்கு உதாரணமாகும்.
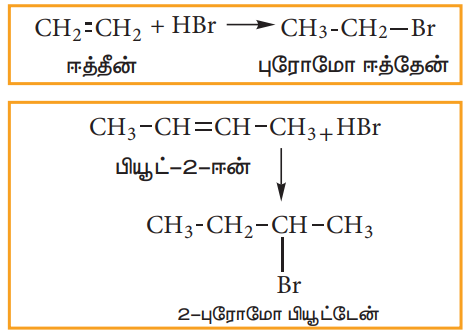
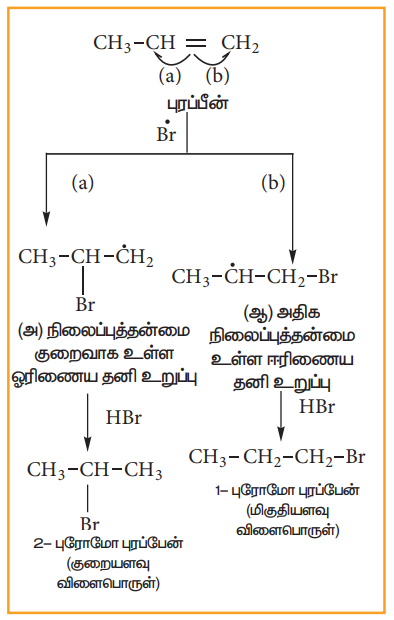
(அ) சீர்மையான ஆல்கீன்களுடன் HBr சேர்த்தல்:
சீர்மையான ஆல்கீன்களுடன் (இரட்டைப் பிணைப்பிற்கு இருபுறம் ஒத்த தொகுதிகளைக் கொண்டவை) HBr-யை சேர்க்கும்போது ஆல்கைல் ஹாலைடுகள் (ஹாலோ ஆல்கேன்கள்) கிடைக்கின்றன
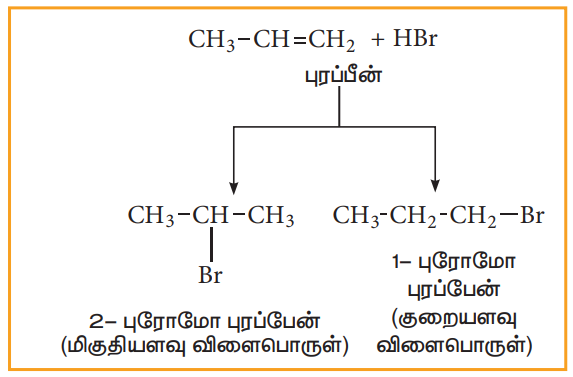
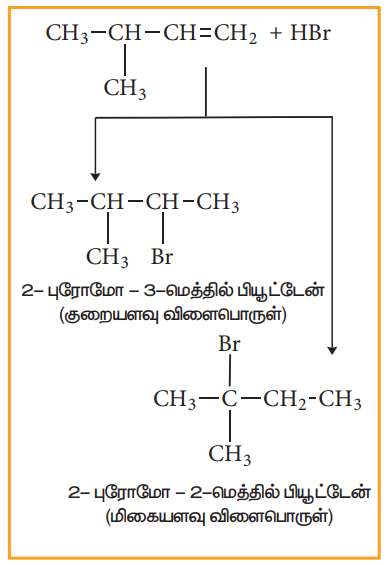
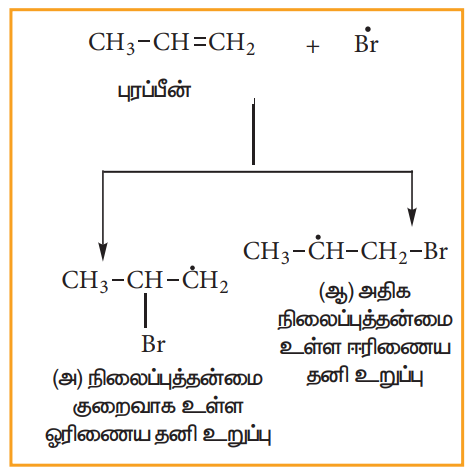
(ஆ) சீர்மையற்ற ஆல்கீன்களுடன் HBr சேர்த்தல் :
சீர்மையற்ற ஆல்கீன்களுடன் HBr சேர்க்கை வினைபுரியும்போது, இரண்டு வினைவிளைப் பொருட்கள் கிடைக்கின்றன.
வினைவழி முறை: HBr புரோப்பீனுடன் வினைபுரியும் சேர்க்கை வினையைக் கருதுக
படி: 1 எலக்ட்ரான் கவர் காரணி உருவாதல்:
H-Br மூலக்கூறில், Br-மிகுந்த எலக்ட்ரான் கவர் தன்மை கொண்டதாகும். பிணைப்பு எலக்ட்ரான்கள் Br-யை நோக்கி நகரும் போது, முனைவாதல் ஏற்படுகிறது. மேலும், எலக்ட்ரான் கவர்பொருள் H+ உருவாகிறது. இது இரட்டைப் பிணைப்பினைத் தாக்கி கார்பன் நேர் அயனியை கீழ்கண்டவாறு உருவாக்குகின்றது.
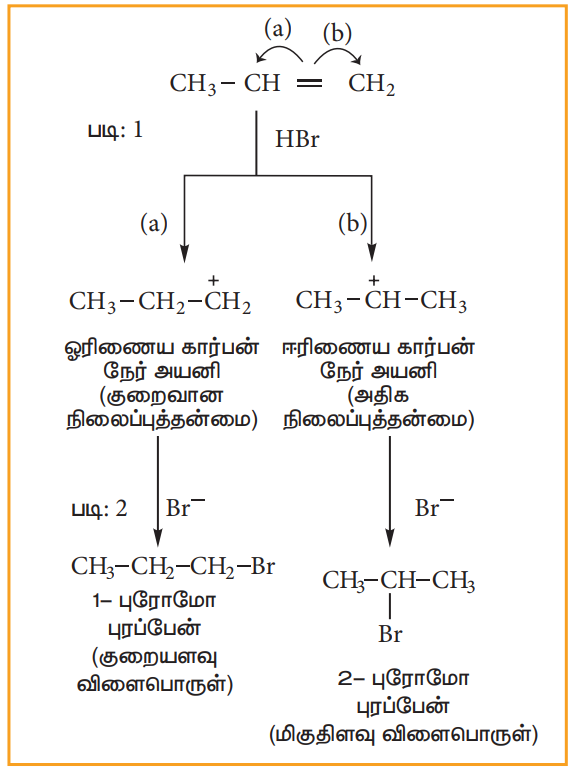
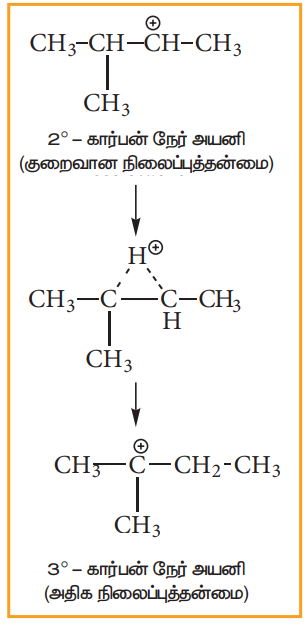
படி:2 ஈரிணைய கார்பன் நேர் அயனி ஆனது ஓரிணைய கார்பன் நேர் அயனியைக் காட்டிலும் அதிக நிலைப்புத்தன்மை உடையது. எனவே இது வினைத்திறனில் ஓரிணைய கார்பன் நேர் அயனியினை விஞ்சுகிறது.
படி: 3 Br- அயனியானது, 20 கார்பன் நேர் அயனியைத் தாக்கி, 2-புரோமோ புரப்பேனைத் தருகிறது. இது அதிக அளவு உருவாகும் விளைப்பொருளாகும்.
3-மெத்தில்-1-பியூட்டீனுடன் HBr இன் சேர்க்கை வினையைக் கருத்தில் கொள்வோம், மார்கோனிகாஃப் விதிபடி, எதிர்பார்த்த விளைப்பொருள் 2-புரோமோ- 3- மெத்தில் பியூட்டேன் ஆகும். ஆனால் அதிக அளவு விளைப்பொருளாக 2-புரோமோ- 2-மெத்தில் பியூட்டேன் உருவாகின்றது. ஏனெனில், இவ்வினையில் உருவாகும் ஈரிணைய கார்பன் நேர் அயனியானது அமைப்பு மாற்றத்திற்கு உட்பட்டு அதிக நிலைப்புத் தன்மையுடைய மூவிணைய கார்பன் நேர் அயனியைத் தருகின்றது. இந்த மூவிணைய கார்பன் நேர் அயனியை Br- தாக்குவதால், அதிக அளவு விளைப்பொருளாக 2-புரோமோ-2-மெத்தில் பியூட்டேன் உருவாகிறது.
கார்பன் நேர் அயனி இடமாற்றம்:
எதிர் - மார்கோனிகாஃப் விதி: (அல்லது) பெராக்சைடு விளைவு (அல்லது) கேராஸ் விதி
கரிம பெராக்சைடு முன்னிலையில், ஆல்கீன்கள் HBr-உடன் சேர்க்கை வினைப் புரியும்போது, மார்கோனிகாஃ விதிக்கு எதிரான விளைப் பொருட்களைத் தருகின்றன.
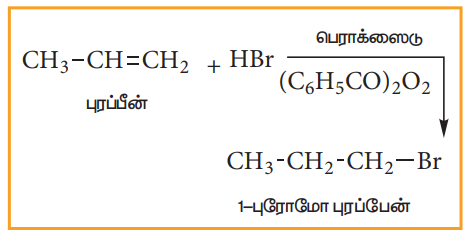
வினைவழி முறை:
இவ்வினையானது தனி உறுப்பு வினை வழி முறையினைப் பின்பற்றுகின்றது.
படி: 1
பெராக்சைடில் உள்ள, வலிமை குறைந்த O-O ஒற்றைப் பிணைப்பு சீர்மையான பிளப்பிற்கு உட்பட்டு தனி உறுப்புக்களை உண்டாக்குகின்றது.
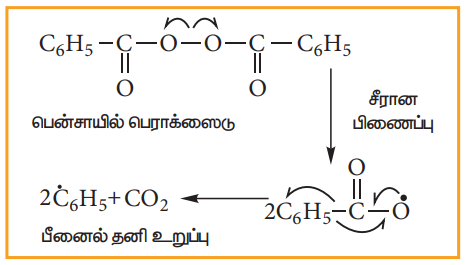
படி: 2
பீனைல் தனி உறுப்பானது, HBr-யில் உள்ள ஹைட்ரஜனை கவர்ந்து புரோமின் தனி உறுப்பினைத் தருகின்றது.

படி: 3
வலிமை மிகுந்த ஆல்கைல் தனி உறுப்பினை உருவாக்கும் வகையில் புரோமின் தனி உறுப்பானது கார்பன் - கார்பன் இரட்டைப் பிணைப்பில் சேர்கின்றது.
படி: 4
ஈரிணைய தனி உறுப்புடன் HBr சேர்த்தல்
H-Cl பிணைப்பானது (430.5 kJ/ மோல்) H-Br பிணைப்பை விட (363.7 kJ / மோல்) அதிக வலிமை மிகுந்தது. எனவே H-Cl பிணைப்பானது தனி உறுப்புகளால் பிளவு படுவதில்லை. H-I பிணைப்பானது, (296.8 kJ / மோல்) H-Cl-ஐ விட வலிமை குறைந்தது. எனவே H-I பிணைப்பு எளிதாக பிளக்கப்பட்டு அயோடின் தனி உறுப்புகள் உருவானாலும், அவை இரட்டை பிணைப்புடன் சேராமல், தமக்குள்ளேயே இணைந்து ஐயோடின் மூலக்கூறுகளைத் தருகின்றன. எனவே HCl மற்றும் HI-யில், பெராக்சைடு விளைவினைக் காண முடியாது.
கேராஸ் சேர்க்கை
CXCl3 யானது உலோக வினையூக்கி முன்னிலையில் ஆல்கீன்களுடன் புரியும் தனி உறுப்பு சேர்க்கை வினை கேராஸ் சேர்க்கை வினை எனப்படும்.
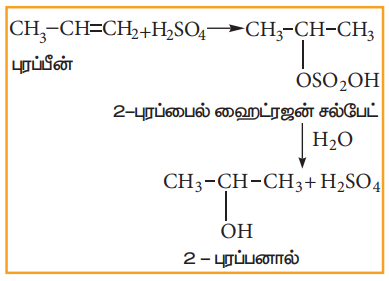
(v) ஆல்கீன்களுடன் கந்தக அமிலத்தின் சேர்க்கை வினை
ஆல்கீன்களுடன் குளிர்ந்த நிலையில் உள்ள அடர் கந்தக அமிலம் மார்கோனிகாப் விதியின்படி வினைப்பட்டு, ஆல்கைல் ஹைட்ரஜன் சல்பேட்டைத் தருகின்றன. இவை மேலும் நீராற் பகுப்படைந்து ஆல்கஹாலைத் தருகின்றது.
(2) ஆக்சிஜனேற்றம்:
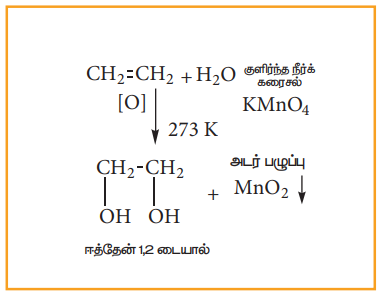
(i) குளிர்ந்த நீர்த்த காரம் கலந்த KMnO4 (பேயர் காரணி) கரைசலுடன் வினை
பேயரின் காரணியுடன் அல்கீன்கள் வினைபட்டு விசினல் டையால்கனைத் தருகின்றன. இவ்வினையில், ஊதா நிற கரைசல் (Mn7+) அடர் பச்சை நிறமாக மாறி (Mn6+) பின்பு அடர் பழுப்பு நிற (Mn4+) வீழ்படிவாக மாறுகின்றது.
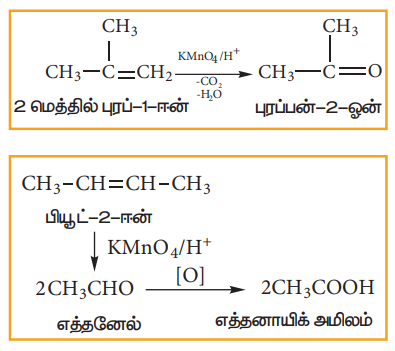
(ii) அமிலம் கலந்த KMnO4 கரைசலுடன் வினை:
ஒலிபீன் கார்பனுடன் இணைக்கப்பட்டுள்ள தொகுதிகளைப் பொறுத்து, ஆல்கீன்கள் அமிலம் கலந்த KMnO4 கரைசலுடன், ஆக்சிஜனேற்றம் அடைந்து, கீட்டோன்கள் அல்லது கார்பாக்சலிக் அமிலங்களைத் தருகின்றன. இவ்வினையில், ஊதா நிறக்கரைசல், நிறமற்றதாக மாறுகிறது. எனவே, இவ்வினையானது, நிறைவுறா தன்மையை அறிய உதவும் ஒரு சோதனையாகும் செயல்படுகின்றது.
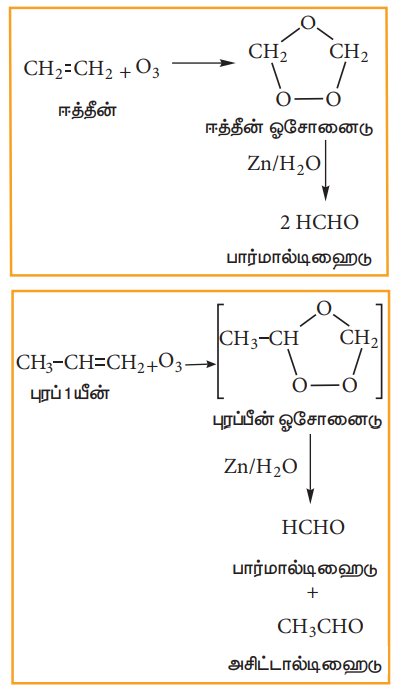
(iii) ஓசோனேற்றம்;
ஓசோனைப் பயன்படுத்தி ஆல்கீன்கள் மற்றும் ஆல்கைன்களை, ஆக்சிஜனேற்ற பிளவிற்கு உட்படுத்தும், வினைகள் ஓசோனேற்ற வினைகள் எனப்படும். ஆல்கீன்கள் ஓசோனுடன் வினைபட்டு ஓசோனைடைத் தருகின்றது. பின்னர் இவை Zn/H2O முன்னிலையில் பிளவடைந்து சிறிய மூலக்கூறுகளாக மாறுகின்றன. இவ்வினையானது ஆல்கீன் மற்றும் ஆல்கைன்களில் உள்ள இரட்டை மற்றும் முப்பிணைப்புகள் காணப்படும் இடங்களை அறிய உதவுகின்றது.
தன் மதிப்பீடு
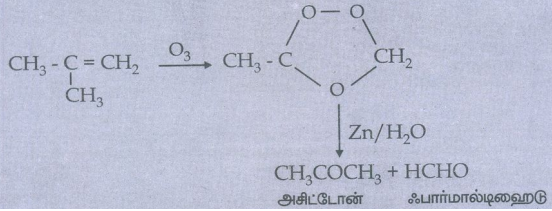
15) ஓசோன், 2-மெத்தில் புரப்பீனுடன் எவ்வாறு வினைபடுகின்றது?
தீர்வு:
2-மெத்தில் புரப்பீனுடன் ஓசோன் வினைபுரிந்து ஓசோனைடு உறுவாகின்றது. பின்னர் Zn/H2O முன்னிலையில் பிளவடைந்து அசிட்டோன் மற்றும் ஃபார்மால்டிஹைடு தருகிறது.
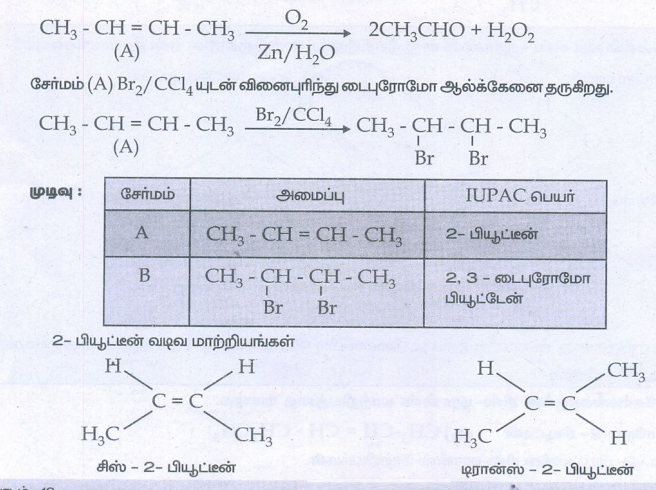
16) (A) என்ற கரிமச் சேர்மம் ஓசோனேற்றத்தின் போது அசிட்டால்டிஹைடை மட்டும் தருகிறது. (A) Br2 /CCl4 உடன் வினைபட்டு சேர்மம் (B)ஐ தருகிறது. (A) மற்றும் (B) சேர்மங்களைக் கண்டறிக. அவைகளின் IUPAC பெயர்களை எழுதுக. (A)ன் வடிவ மாற்றியங்களை எழுதுக.
தீர்வு:
சேர்மம் (A) ஓசோனேற்றமடைந்து அசிட்டால்டிஹைடை தருவதால் – சேர்மம் (A) ஒரு சீர்மையுள்ள ஆல்கீன் ஆகும். எனவே A-2 – பீயூட்டீன் ஆகும்.
17) C2H4 என்ற மூலக்கூறு வாய்ப்பாடுடைய (A) என்ற சேர்மம் புரோமின் நீரை நிறமிழக்கச் செய்கிறது. (A) ஆனது குளோரினுடன் வினைபட்டு (B) யை தருகிறது. (A) ஆனது H Br வினைபுரியும் போது (C) உருவாகிறது. (A), (B), (C) ஐக் கண்டறிக. வினைகளை விளக்குக.
தீர்வு:
சேர்மம் (A) புரோமின் நீரை நிறமிழக்கச் செய்வதால் மற்றும் மூலக்கூறு வாய்பாடுபடி ஒரு ஆல்கீன் தான் இருக்க முடியும். எனவே A – எத்திலீன் ஆகும்.
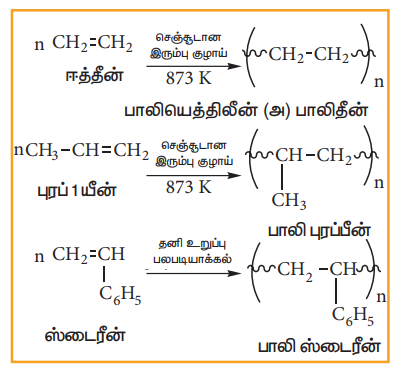
(iv) பல படியாக்கல்:
அதிக அளவில் சிறிய மூலக்கூறுகள் இணைந்து உருவாகும் மிக பெரிய மூலக்கூறானது பலபடி எனப்படுகிறது. இச்செயல்முறை பலபடியாக்கல் எனப்படும். வினையூக்கி முன்னிலையில், அதிக வெப்பநிலை மற்றும் அழுத்தத்தில், ஆல்கீன்களின் பலபடியாக்கல் நடைபெறுகின்றன.
எடுத்துக்காட்டு
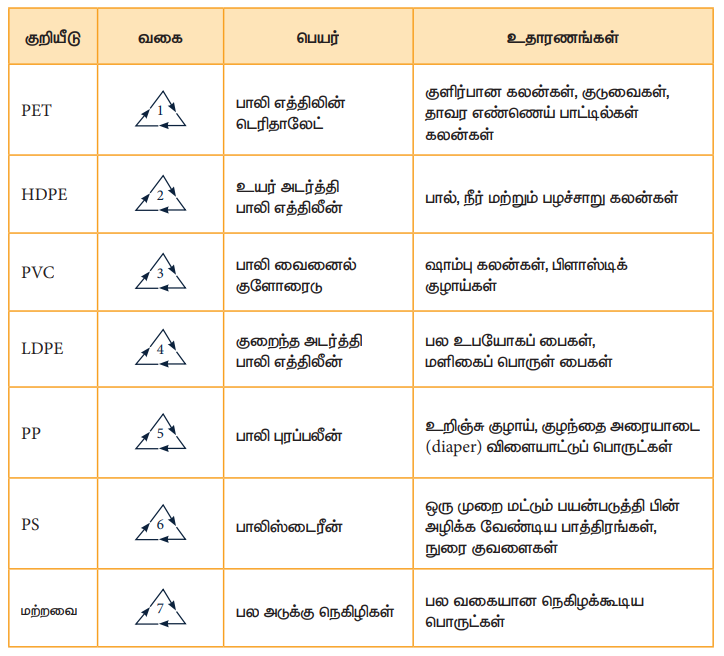
நெகிழி மறுசுழற்சி
அதிக அளவில் பலபடிகளை பயன்படுத்துவதால் நிலங்களில் அடைப்பு ஏற்பட்டு, சுற்றுசூழல் மாசுபடுகின்றது. நுகர்வோர் பயன்படுத்தும் பொருட்களில் பலபடிகள் அதிக பயன்பாட்டில் இருப்பதால், அதனை தக்க முறையில் மறுசுழற்சி செய்தல் வேண்டும், மறுசூழற்சி செய்ய பலபடிகளை உப-வகைகளாக பிரிக்கப்பட்டு, சின்னங்கள் மற்றும் குறியீடுகள் மூலம் அடையாளமிடப்பட்டு பின்பு அவைகளை தனித்தனியாக மறுசுழற்சி செய்யவேண்டும்.
ஈத்தீன் அடிப்படையில் அமைந்த சேர்க்கை பலபடிகளை மறுசுழற்சி செய்வதற்கு பயன்படுத்தப்படும் சின்னம் மற்றும் குறியீடுகளை பின்வரும் அட்டவணை குறிப்பிடுகிறது.
(எண் குறைவாக இருப்பின், அப்பொருளை மிக எளிதாக மறுசுழற்சி செய்ய இயலும்)