எடுத்துக்காட்டு கணக்குகள் - தன்மதிப்பீடு: வேதியியலின் அடிப்படைக் கருத்துக்கள் மற்றும் வேதிக் கணக்கீடுகள் | 11th Chemistry : UNIT 1 : Basic Concepts of Chemistry and Chemical Calculations
11 வது வேதியியல் : அலகு 1 : வேதியியலின் அடிப்படைக் கருத்துக்கள் மற்றும் வேதிக் கணக்கீடுகள்
தன்மதிப்பீடு: வேதியியலின் அடிப்படைக் கருத்துக்கள் மற்றும் வேதிக் கணக்கீடுகள்
தன்மதிப்பீடு
1. வேதித்தன்மை அடிப்படையிலான வகைப்பாட்டு அறிவினை பயன்படுத்தி, பின்வரும் ஒவ்வொன்றையும், தனிமம், சேர்மம் அல்லது கலவை என வகைப்படுத்துக.
(i) சர்க்கரை
(ii) கடல்நீர்
(iii) வாலைவடிநீர்
(iv) கார்பன் டை ஆக்ஸைடு
(v) தாமிர கம்பி (Copper wire)
(vi) சாதாரண உப்பு
(vii) வெள்ளித் தட்டு (Silver plate)
(viii) நாப்தலீன் உருண்டைகள்.
தீர்வு:
(i) தனிமம் - காப்பர் கம்பி, வெள்ளித்தட்டு
(ii) சேர்மம் - சர்க்கரை, வாலை வடிநீர், கார்பன் டை ஆக்ஸைடு, சாதாரண உப்பு, நாஃப்தலீன் உருண்டைகள்.
(iii) கலவை - கடல் நீர்
தன்மதிப்பீடு
2) பின்வருவனவற்றின் ஒப்பு மூலக்கூறு நிறையினைக் கணக்கிடுக.
● எத்தனால் (C2 H5 OH)
● பொட்டாசியம் பெர்மாங்கனேட் (KMnO4)
● பொட்டாசியம் டைகுரோமேட் (K2 Cr2 O7)
● சுக்ரோஸ் (C12 H22 O11)
தீர்வு:
(i) C2H5OH : (2 × 12) + (5 × 1) + (1 × 16) + (1 × 1)
= 46g
(ii) KMnO4 : (1 × 39) + (1 × 55) + (4 × 16)
= 158g
(iii) K2Cr2O7 : (2 × 39) + (2 × 52) + (7 × 16)
= 294g
(iv) C12H22O11 : (12 × 12) + (22 × 1) + (11 × 16)
= 342 g
தன்மதிப்பீடு
3 அ) 9 கிராம் ஈத்தேனில் காணப்படும் மோல்களின் எண்ணிக்கையைக் கணக்கிடுக.
தீர்வு:
அ) ஈத்தேனின் மோலார் நிறை C2H6
= (2 × 12) + (6 × 1) = 30g mol−1
n = நிறை / மோலார் நிறை
= 9g/ 30gmol−1 = 0.3mol
3 ஆ) 273K மற்றும் 3atm அழுத்த நிலையில், 224mL கன அளவினை அடைத்துக்கொள்ளும் ஆக்சிஜன் வாயுவில் காணப்படும் ஆக்சிஜன் மூலக்கூறுகளின் எண்ணிக்கையினைக் கணக்கிடுக.
தீர்வு:
ஆ) 273K மற்றும் 1atm அழுத்தத்தில் 1 மோல் வாயு அடைத்துக் கொள்ளும் கனஅளவு 22.4L. எனவே 273K மற்றும் 3 atm அழுத்தத்தில் 224ml கனஅளவை அடைத்துக் கொள்ளும் ஆக்ஸிஜனின் மோல்களின் எண்ணிக்கை
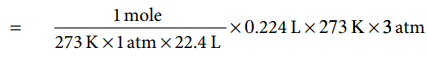
= 0.03 mole
1 மோல் ஆக்ஸிஜனில் 6.022 × 1023 மூலக்கூறுகள் உள்ளன. 0.03 மோல் ஆக்ஸிஜனில்
= 6.022 × 1023 × 0.03
= 1.807 × 1022 ஆக்ஸிஜன் மூலக்கூறுகள் உள்ளன.
தன்மதிப்பீடு
4. அ) 0.456g உலோகமானது 0.606g அதன் உலோகக் குளோரைடினைத் தருகிறது. உலோகத்தின் சமான நிறையைக் கணக்கிடுக.
தீர்வு
அ) உலோகத்தின் நிறை = 0.456g
உலோக குளோரைடின் நிறை = 0.606g
0.456g உலோகமானது 0.15g குளோரினுடன் இணைந்துள்ளது.
35.5 g குளோரினும் இணையும் உலோகத்தின் நிறை (0.456 / 0.15) × 35.5 = 107.92g eq−1
4. ஆ) பொட்டாசியம் டை குரோமேட்டின் சமான நிறையினைக் கணக்கிடுக. அமில ஊடகத்தில் ஒடுக்க அரைவினை
Cr2O72- + 14H+ + 6e- → 2Cr3+ + 7H2O
தீர்வு
ஆ) ஆக்ஸிஜனேற்ற வினைப்பொருளின் சமான நிறை
= மோலார் நிறை / 1 மோல் ஆக்சிஜனேற்றியால் ஏற்கப்பட்ட எலக்ட்ரான்களின் மோல்களின் எண்ணிக்கை.
= 292.2g mol−1 /6eq mol−1 = 48.7g eq−1

தன்மதிப்பீடு
5. ஒரு சேர்மம் பகுப்பாய்வில் பின்வரும் சதவீத இயைபைக் கொண்டுள்ளது. C = 54.55%, H = 9.09%, O = 36.36% அச்சேர்மத்தின் எளிய விகித வாய்ப்பாட்டினைக் கண்டறிக.
தீர்வு:
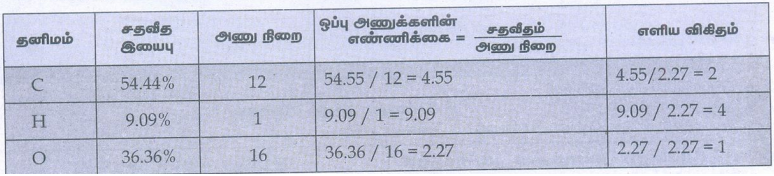
எளிய விகித வாய்ப்பாடு (C2H4O)
தன்மதிப்பீடு
6) x, y, z ஆகிய தனிமங்களைக் கொண்டுள்ள ஒரு சேர்மத்தின் பகுப்பாய்வு முடிவுகளிலிருந்து பின்வரும் தரவுகள் பெறப்பட்டுள்ளது. x = 32%, y = 24%, z = 44% x, y மற்றும் z ன் ஒப்பு அணுக்களின் எண்ணிக்கை முறையே 2, 1 மற்றும் 0.5 ஆகும். (சேர்மத்தின் மூலக்கூறு நிறை 400g)
i) தனிமங்கள் x, y மற்றும் z ன் அணு நிறைகளைக் காண்க.
ii) சேர்மத்தின் எளிய விகித வாய்பாடு மற்றும்
iii) சேர்மத்தின் மூலக்கூறு வாய்ப்பாட்டினைக் கண்டறிக.
தீர்வு
கணக்கிடப்பட்ட எளிய விகித வாய்ப்பாட்டு முறை = (16 × 14) + (24 × 2) + 88
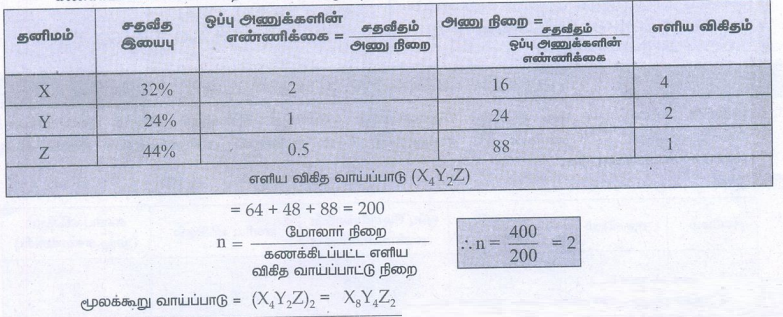
= 64 + 48 + 88 = 200
n = மோலார் நிறை / கணக்கிடப்பட்ட எளிய விகித வாய்ப்பாட்டு நிறை
மூலக்கூறு வாய்ப்பாடு = (X4Y2Z) 2 = X8Y4Z2
∴ n = 400 / 200 = 2
தன்மதிப்பீடு
7) ஒரு வினையின் சமன்படுத்தப்பட்ட சமன்பாடு கீழே கொடுக்கப்பட்டுள்ளது
2x + 3y → 4l + m
8 மோல் x ஆனது 15 மோல் y உடன் வினைபுரிய அனுமதிக்கப்படும் போது,
i) வினைக்கட்டுப்பாட்டு காரணி எது?
ii) உருவாகும் வினைவிளை பொருட்களின் அளவினைக் கணக்கிடுக.
iii) வினையின் இறுதியில், மிகுதியாக எஞ்சியிருக்கும் வினைபடுபொருளின் அளவினைக் கணக்கிடுக.
தீர்வு
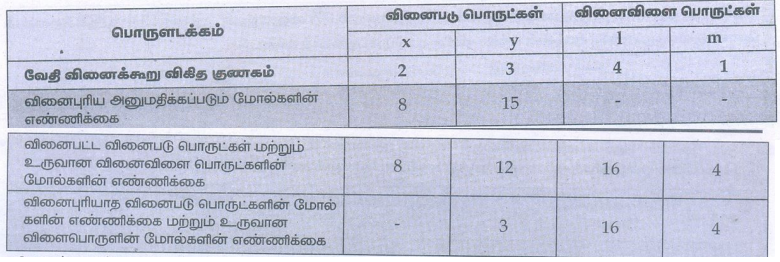
வினைக் கட்டுப்பாட்டுக் காரணி : x
உருவான விளைபொருள் : 16 மோல்கள் 1 மற்றும் 4 மோல்கள் m
கூடுதலாக எஞ்சியுள்ள வினைபடு பொருள் : 3 மோல்கள் y
தன் மதிப்பீடு
8. ஆக்சிஜனேற்ற எண்ணைப் பயன்படுத்தி பின்வரும் சமன்பாட்டினை சமன் செய்க.
As2S3 + HNO3 + H2O → H3AsO4 + H2SO4 + NO
தீர்வு
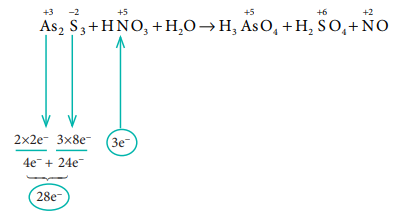
வினைபடு பொருள் உள்ள பகுதியில் எலக்ட்ரான்களின் எண்ணிக்கையை சமன்படுத்துக.
⇒ 3As2S3 + 28HNO3 + H2O → H3AsO4 + H2SO4 + NO
வினைபடு பொருட்களுள்ள பகுதியின் அடிப்படையில் வினைவிளை பொருளை சமன்படுத்துக.
⇒ 3As2S3 + 28HNO3 + H2O → 6H3AsO4 + 9H2SO4 + 28NO
வினைவிளை பொருள் பகுதி : 36 ஹைட்ரஜன் அணுக்கள் & 88 ஆக்ஸிஜன் அணுக்கள்
வினைபடு பொருள் பகுதி : 28 ஹைட்ரஜன் அணுக்கள் & 74 ஆக்ஸிஜன் அணுக்கள்
வேறுபாடானது 8 ஹைட்ரஜன் அணுக்கள் & 14 ஆக்ஸிஜன் அணுக்கள்
ஃ வினைபடு பொருள் பகுதியிலுள்ள H2O மூலக்கூறை '4' ஆல் பெருக்குக. சமன்படுத்தப்பட்ட சமன்பாடானது,
3As2S3 + 28HNO3 + 4H2O → 6H3AsO4 + 9H2SO4 + 28NO