11 வது வேதியியல் : அலகு 5 : கார மற்றும் காரமண் உலோகங்கள்
கார உலோகங்களின் பொதுப் பண்புகள்
கார உலோகங்களின் பொதுப் பண்புகள்:
கார உலோகங்கள் அதிக வினைதிறன் கொண்டவை மேலும் இயற்கையில் இவைகள் சேர்மங்களாக மட்டுமே காணப்படுகின்றன. ருபீடியம் மற்றும் சீசியம் ஆகியன மிகக் குறைவான அளவில் கார உலோக தாதுக்களுடன் சேர்ந்து காணப்படுகின்றன. ஃப்ரான்ஷியம் இயற்கையில் குறிப்பிடத்தகுந்த அளவில் காணப்படவில்லை. மேலும் மிக அதிக கதிரியக்கத் தன்மை கொண்டது. அதன் அதிக நிலைப்புத் தன்மை உடைய ஐசோடோப்பின் அரைவாழ் காலம் 21 நிமிடங்கள் மட்டுமே.
அட்டவணை 5.1 கார உலோகங்களின் வளம் மற்றும் அவற்றின் மூலங்கள்
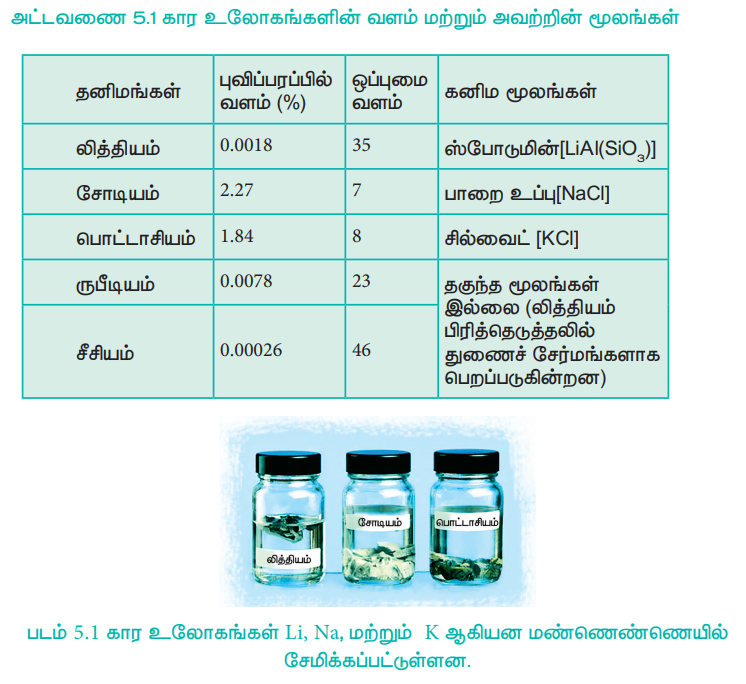
படம் 5.1 கார உலோகங்கள் Li, Na, மற்றும் K ஆகியன மண்ணெண்ணெயில் சேமிக்கப்பட்டுள்ளன.
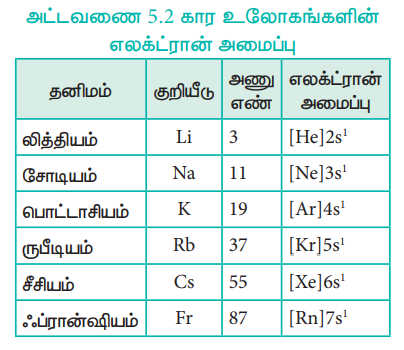
எலக்ட்ரான் அமைப்பு:
கார உலோகங்களின் பொதுவான இணைதிறன் கூட்டு எலக்ட்ரான் அமைப்பு ns1, இங்கு n என்பது வரிசை எண்ணைக் குறிப்பிடுகிறது.
அட்டவணை 5.2 கார உலோகங்களின் எலக்ட்ரான் அமைப்பு
பொதுவான ஆக்ஸிஜனேற்ற நிலை:
இந்த தனிமங்கள் அனைத்தும் அதிக நேர்மின்தன்மை கொண்டவையாக உள்ளன. இவைகள் எளிதில் தங்களின் இணைதிறன் கூட்டு எலக்ட்ரானை இழந்து ஒற்றை மின்சுமையுடைய நேர்மின் அயனிகளை (M+) உருவாக்குகின்றன. கார உலோகங்கள் +1 என்ற ஒரே ஒரு ஆக்ஸிஜனேற்ற நிலையை மட்டுமே கொண்டுள்ளன.
அணு மற்றும் அயனி ஆரங்கள்:
ஒவ்வொரு வரிசையிலும் கார உலோகங்கள், முதல் தனிமமாக இருப்பதால் அந்தந்த வரிசைகளில் அதிகபட்ச அணு மற்றும் அயனி ஆரங்களைக் கொண்டுள்ளன. தொகுதியில் மேலிருந்து கீழாகச் செல்லும்போது, கூடுகளின் எண்ணிக்கை அதிகரிக்கிறது. எனவே அணு மற்றும் அயனி ஆரங்கள் அதிகரிக்கின்றன. எதிர்பார்த்ததைப் போலவே, ஒற்றை இணைதிறன் அயனிகள் (M+), அவற்றின் மூல அணுக்களைக்காட்டிலும் உருவளவில் சிறியவையாக உள்ளன.
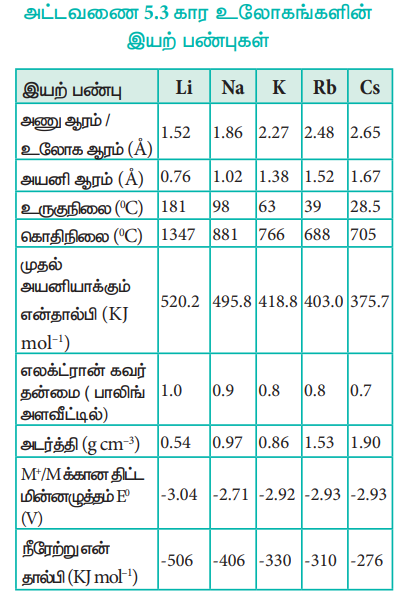
அட்டவணை 5.3 கார உலோகங்களின் இயற் பண்புகள்
அயனியாக்கும் என்தால்பி
ஒவ்வொரு வரிசையிலும் உள்ள தனிமங்களுடன் ஒப்பிடும்போது உலோகங்கள், குறைந்தபட்ச அயனியாக்கும் என்தால்பி மதிப்புகளைக் கொண்டுள்ளன. நாம் ஒரு தொகுதியில் மேலிருந்து கீழாகச் செல்லும்போது, அணுவின் உருவளவு அதிகரிப்பதால் அயனியாக்கும் என்தால்பி குறைகிறது. மேலும் உள்கூடுகளின் எண்ணிக்கையும் அதிகரிக்கின்றன, இதன் விளைவாக திரைமறைப்பு விளைவும் அதிகரிக்கின்றது எனவே தொகுதியில் கீழாக செல்லச் செல்ல அயனியாக்கும் என்தால்பி குறைகிறது.
கார உலோகங்களின் இரண்டாம் அயனியாக்கும் என்தால்பி மதிப்புகள் மிக அதிகம். கார உலோகங்களிலிருந்து ஒரு எலக்ட்ரானை நீக்குவதால் ஒற்றை இணைதிறன் கொண்ட நேர்மின் அயனிகள் கிடைக்கின்றன, இந்த அயனிகள் மந்த வாயுக்களைப் போன்ற நிலையான எலக்ட்ரான் அமைப்பைப் பெற்றுள்ளன. எனவே, ஏற்கெனவே நிலைத்த எலக்ட்ரான் அமைப்பை அடைந்த அயனிகளிடமிருந்து, இரண்டாவதாக மேலும் ஒரு எலக்ட்ரானை நீக்குவது மிகக் கடினமாகிறது.
நீரேற்று என்தால்பி
லித்தியம் உப்புகள், மற்ற தொகுதி-1 உலோக உப்புகளை விட அதிக அளவில் கரைகின்றன. எடுத்துக்காட்டாக LiClO4 ஆனது NaClO4 விட 12 மடங்கு அதிகமாகக் கரைகிறது. KClO4 RbClO4 மற்றும் CsClO4 - யின் கரைதிறனானது LiClO4 இன் கரைதிறனைப்போல 10-3 மடங்கு குறைவான கரைதிறனை பெற்றுள்ளது. லித்தியம் உப்புகளின் அதிக கரைதிறனுக்கு காரணம் சிறிய உருவளவு கொண்ட Li+ அயனியானது எளிதில் நீரேற்றம் அடைவதே ஆகும்.
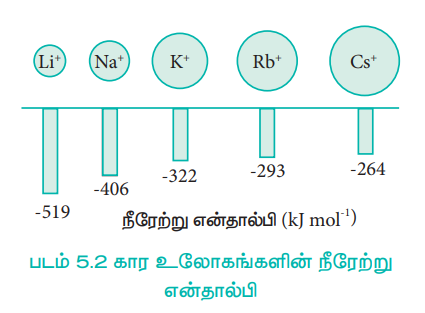
படம் 5.2 கார உலோகங்களின் நீரேற்று என்தால்பி
எலக்ட்ரான் கவர் தன்மை
ஒவ்வொரு வரிசைலும் உள்ள மற்ற தனிமங்களுடன் ஒப்பிடும்போது கார உலோகங்கள், குறைந்த எலக்ட்ரான் கவர் தன்மையைக் கொண்டுள்ளன. மற்ற தனிமங்களுடன் இவை வினைபுரியும் போது வழக்கமாக அயனிச் சேர்மங்களை உருவாக்குகின்றன. எடுத்துக்காட்டாக, கார உலோகங்கள் ஹேலஜன்களுடன் வினைப்பட்டு அயனி ஹேலைடுகளை உருவாக்குகின்றன.
சுடர் நிறம் மற்றும் நிறமாலை
கார உலோக உப்புகளை அடர் ஹைட்ரோகுளோரிக் அமிலத்தில் சேர்த்து ஈரமாக்கி, அதனை பிளாட்டின கம்பியின் முனையில் வைத்து சுடரில் வெப்பப்படுத்தும்போது, பின் வரும் அட்டவணையில் கொடுக்கப்பட்டுள்ளவாறு அதற்குரிய சுடர் நிறங்களைக் காட்டுகின்றன.
அட்டவணை 5.4 சுடரின் நிறம் மற்றும் அலைநீளங்கள்
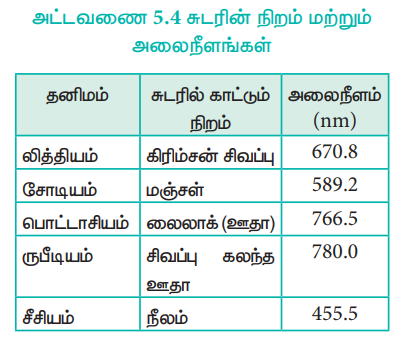
சுடரிலுள்ள வெப்பம், இணைதிறன் எலக்ட்ரானை உயர் ஆற்றல் மட்டத்திற்கு கிளர்வுறச் செய்கின்றது. இது மீளவும் அதன் இயல்பான ஆற்றல் நிலைக்கு திரும்பும்போது, அதிகப்படியான ஆற்றல், ஒளியாக வெளிவிடப்படுகிறது. இந்த ஒளியின் அலைநீளம் அட்டவணையில் காட்டியவாறு கட்புலனாகும் பகுதியில் உள்ளது.

படம் 5.3 சுடரில் கார உலோக உப்புகளின் நிறங்கள்.